Giáo án kì 2 hóa học 7 cánh diều
Giáo án hóa học 7 học kì 2 bộ sách cánh diều. Giáo án là bản word, dễ dàng chỉnh sửa. KHBD kì 2 hóa học cánh diều. Bản tài liệu này được soạn chi tiết, cẩn thận. Mời thầy cô tham khảo
Click vào ảnh dưới đây để xem giáo án rõ






Xem video về mẫu Giáo án kì 2 hóa học 7 cánh diều
Ngày soạn: …/…/…
Ngày dạy: …/…/…
BÀI 6. HOÁ TRỊ, CÔNG THỨC HOÁ HỌC- MỤC TIÊU
- Kiến thức:
Học xong bài này, HS có thể:
- Trình bày được khái niệm về hoá trị (cho chất cộng hoá trị), cách viết công thức hoá học.
- Viết được công thức hoá học của một số đơn chất và hợp chất đơn giản thông dụng.
- Nêu được mối liên hệ giữa hoá trị của nguyên tố với công thức hoá học.
- Tính được phần trăm (%) nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất.
- Xác định được công thức hoá học của hợp chất dựa vào phần trăm nguyên tố và khối lượng phân tử.
- Năng lực
- Năng lực chung:
+ Tự chủ và học tập: vận dụng một cách linh hoạt những kiến thức, kĩ năng đã học để giải quyết vấn đề.
+ Giao tiếp và hợp tác: biết sử dụng ngôn ngữ kết hợp với hình ảnh để trình bày thông tin, ý tưởng và thảo luận những vấn đề của bài học. Biết chủ động và gương mẫu hoàn thành phần việc được giao, góp ý điều chỉnh thúc đẩy hoạt động chung ; khiêm tốn học hỏi các thành viên trong nhóm.
- Năng lực môn hóa học: Nghe và hiểu được nội dung các thuật ngữ hóa học, danh pháp hóa học và các biểu tượng hóa học…
- Phẩm chất: trách nhiệm, chăm chỉ và trung thực.
- THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Đối với giáo viên:
- SGK, SGV, Giáo án.
- Các miếng bìa cắt theo hình trong sách đựng trong các hộp (4 bộ trở lên).
- Máy tính, máy chiếu (nếu có).
- Đối với học sinh:
- Sách giáo khoa
- Tranh ảnh, tư liệu sưu tầm liên quan đến bài học và dụng cụ học tập (nếu cần) theo yêu cầu của GV.
III. TIẾN TRÌNH DẠY HỌC
- HOẠT ĐỘNG KHỞI ĐỘNG
- Mục tiêu:
- Kích thích sự tò mò, mong muốn tìm hiểu nội dung bài mới.
- Thông qua hoạt động ghép hình HS hiểu được nguyên tử của các nguyên tố kết hợp với nhau theo những tỉ lệ nhất định. Từ đó cho HS liên hệ đến việc tìm hiểu khả năng liên kết của các nguyên tố.
- Nội dung: GV tổ chức cho HS ghép hình theo nhóm.
- Sản phẩm học tập: HS ghép đúng các miếng bìa; Biểu thị được kết quả ghép bằng kí hiệu hoá học và các chữ số.
- Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ
- GV chia lớp thành các nhóm, phát cho mỗi nhóm một bộ ghép hình sau đó yêu cầu các nhóm ghép hình và ghi kết quả ghép hình theo kí hiệu hoá học và các con số.
Bước 2: Thực hiện nhiệm vụ
- HS lắng nghe, hoạt động nhóm để tham gia.
Bước 3: Báo cáo, thảo luận:
- Đại diện các nhóm HS xung phong báo cáo kết quả.
Bước 4: Kết luận, nhận xét:
- GV nhận xét, đánh giá và dẫn dắt vào bài: Các nguyên tố kết hợp với nhau theo những tỉ lệ nhất định. Nội dung bài học ngày hôm nay sẽ tìm hiểu tỉ lệ kết hợp giữa các nguyên tử của các nguyên tố. Chúng ta cùng vào Bài 6. Hoá trị, công thức hoá học.
- HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
Hoạt động 1. Tìm hiểu khái niệm hoá trị, quy tắc hoá trị
- Mục tiêu:
- Trình bày được khái niệm hoá trị (cho chất cộng hoá trị). Nêu được trong các hợp chất hoá trị của H là I của O là II.
- Nêu được quy tắc hoá trị, tính được tỉ lệ kết hợp giữa các nguyên tố dựa trên quy tắc hoá trị.
- Nội dung: GV giảng giải, phân tích, yêu cầu HS đọc sgk, thảo luận, trả lời CH1, 2; LT1, 2; VD1 trang 39, 40 SGK; LT3, 4 trang 41 SGK.
- Sản phẩm học tập: Câu trả lời của HS cho các câu hỏi và yêu cầu của GV
- Tổ chức thực hiện :
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS | DỰ KIẾN SẢN PHẨM | ||||||||||||||||||||||||||||||||||||
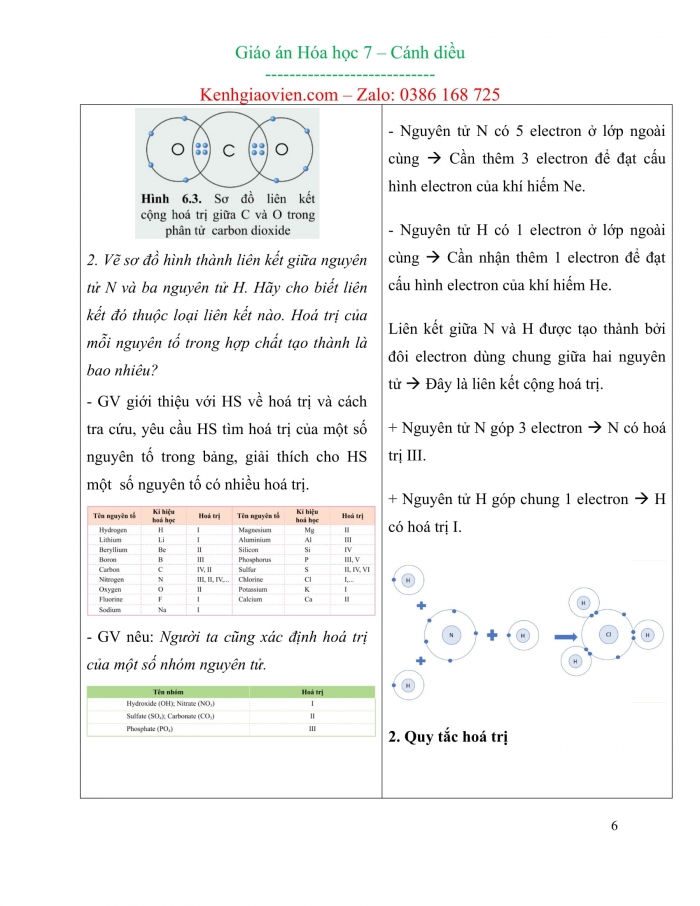
Bước 1. GV chuyển giao nhiệm vụ học tập 1. Tìm hiểu khái niệm hoá trị - GV chiếu lên bảng hai mô hình liên kết của hydrogen chloride, nước và yêu cầu HS nêu: + Số electron của mỗi nguyên tử đã góp chung. + Tỉ lệ giữa các nguyên tử đã liên kết với nhau. - GV kết luận, dẫn dắt đến khái niệm hoá trị: Hoá trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác. - GV yêu cầu HS làm CH1 trang 39 SGK. Quan sát hình 6.1, hãy so sánh hoá trị của nguyên tố và số electron mà nguyên tử của nguyên tố đã góp chung để tạo ra liên kết. - GV: Thông thường, hoá trị của nguyên tố trong hợp chất cộng hoá trị bằng số electron mà nguyên tử nguyên tố đó góp chung với nguyên tử khác. Trong hợp chất, H luôn có hoá trị I, O luôn có hoá trị II. - GV yêu cầu HS làm LT1, LT2 trang 40 SGK. 1. Quan sát hình 6.3 và xác định hoá trị của C và O trong carbon dioxide. 2. Vẽ sơ đồ hình thành liên kết giữa nguyên tử N và ba nguyên tử H. Hãy cho biết liên kết đó thuộc loại liên kết nào. Hoá trị của mỗi nguyên tố trong hợp chất tạo thành là bao nhiêu? - GV giới thiệu với HS về hoá trị và cách tra cứu, yêu cầu HS tìm hoá trị của một số nguyên tố trong bảng, giải thích cho HS một số nguyên tố có nhiều hoá trị. - GV nêu: Người ta cũng xác định hoá trị của một số nhóm nguyên tử.
2. Tìm hiểu quy tắc hoá trị. - GV chiếu lên bảng tính tích hoá trị và số nguyên tử trong phân tử nước và carbon dioxides, yêu cầu HS cung cấp các thông tin còn thiếu để hoàn thiện bảng. - GV yêu cầu HS làm CH2, LT3, LT4 trang 41 SGK. 2. Cát được sử dụng nhiều trong xây dựng và là nguyên liệu chính để sản xuất thuỷ tinh. Silicon oxide là thành phần chính của cát. Phân tử silicon oxide gồm 1 nguyên tử Si liên kết với 2 nguyên tử O. Dựa vào hoá trị của các nguyên tố trong bảng 6.1, hãy tính tích hoá trị và số nguyên tử của mỗi nguyên tố trong phân tử silicon oxide. Nhận xét về tích đó. 3. Dựa vào hoá trị của các nguyên tố trong bảng 6.1 và quy tắc hoá trị, hãy cho biết mỗi nguyên tử Mg có thể kết hợp với bao nhiêu nguyên tử Cl.
4. Nguyên tố A có hoá trị III, nguyên tố B có hoá trị II. Hãy tính tỉ lệ nguyên tử của A và B trong hợp chất tạo thành từ hai nguyên tố đó. Bước 2. HS thực hiện nhiệm vụ học tập - HS đọc thông tin, quan sát hình, bảng để trả lời câu hỏi. Bước 3. Báo cáo kết quả hoạt động, thảo luận - Đại diện 2- 3 HS đứng dậy trình bày câu trả lời - HS khác nhận xét, đánh giá, bổ sung Bước 4. Đánh giá kết quả thực hiện - GV đánh giá, nhận xét, kết luận, chuyển sang nội dung mới. | I. Hoá trị 1. Khái niệm hoá trị. - Khi tạo thành phân tử hydrogen chloride, mỗi nguyên tử H và Cl góp 1 electron tạo ra đôi electron dùng chung giữa hai nguyên tử.
- Đáp án CH1 trang 39 SGK. - Trong hình 6.1, mỗi nguyên tử H và Cl góp 1 electron tạo ra đôi electron dùng chung giữa 2 nguyên tử. - H và Cl đều có hoá trị I à Hoá trị của nguyên tố = số electron mà nguyên tử của nguyên tố đã góp chung để tạo ra liên kết.
Đáp án LT1, LT2 trang 40 SGK. 1. Quan sát vào sơ đồ ta thấy, mỗi nguyên tử O góp chung 2 electron, nguyên tử C góp chung 4 electron để hình thành liên kết. Như vậy C có hoá trị IV, O có hoá trị II. 2. - Nguyên tử N có 5 electron ở lớp ngoài cùng à Cần thêm 3 electron để đạt cấu hình electron của khí hiếm Ne. - Nguyên tử H có 1 electron ở lớp ngoài cùng à Cần nhận thêm 1 electron để đạt cấu hình electron của khí hiếm He. Liên kết giữa N và H được tạo thành bởi đôi electron dùng chung giữa hai nguyên tử à Đây là liên kết cộng hoá trị. + Nguyên tử N góp 3 electron à N có hoá trị III. + Nguyên tử H góp chung 1 electron à H có hoá trị I. 2. Quy tắc hoá trị
Đáp án CH2, LT3, LT4 trang 41 SGK. 2.
Nhận xét: Tích của hoá trị và số nguyên tử tham gia liên kết của Si và O bằng nhau. 3.
Ta có: II 1 = I a à a = 2. Vậy mỗi nguyên tử Mg có thể kết hợp được với 2 nguyên tử Cl. 4.
Ta có: III x = II y = = Vậy tỉ lệ nguyên tử của A và B trong hợp chất tạo thành từ hai nguyên tố đó là 2 : 3. | ||||||||||||||||||||||||||||||||||||
Hoạt động 2. Tìm hiểu công thức hoá học, ý nghĩa của công thức hoá học
- Mục tiêu:
- Viết được công thức hoá học của một số chất.
- Nêu được ý nghĩa của công thức hoá học.
- Biết công thức hoá học tính được phần trăm khối lượng các nguyên tố, hoá trị của nguyên tố trong hợp chất có hai nguyên tố.
- Nội dung: GV trình bày, đặt câu hỏi, HS trả lời CH3, 4; LT5 – 10; VD trang 41 – 44 SGK.
- Sản phẩm học tập: Câu trả lời của HS cho CH3, 4; LT5 – 10; VD trang 41 – 44 SGK và yêu cầu của GV
- Tổ chức thực hiện :
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS | DỰ KIẾN SẢN PHẨM | ||||||||||||||||||||||||||||||
Bước 1: Chuyển giao nhiệm vụ 1. Tìm hiểu công thức hoá học - GV nêu vấn đề: Để biểu thị các chất một cách đơn giản và ngắn gọn người ta dùng công thức hoá học. Công thức hoá học gồm hai thành phần là kí hiệu hoá học và các chữ số + Phần chữ: gồm kí hiệu hoá học của các nguyên tố tạo thành chất. + Phần số: gồm các số được ghi bên phải, dưới chân kí hiệu hoá học, ứng với số nguyên tử của nguyên tố trong một phân tử (nếu chỉ có một nguyên tử thì không ghi). Các số này được gọi là chỉ số. - GV yêu cầu HS làm CH3, LT5, LT6 trang 41, 42 SGK. 3. Cho công thức hoá học của một số chất như sau: a. N2 (nitrogen) b. NaCl (sodium chloride) c. MgSO4 (magnesium sulfate) Xác định nguyên tố tạo thành mỗi chất và số nguyên tử của mỗi nguyên tố có trong phân tử.
5. Viết công thức hoá học của các chất: a. Sodium sulfide, biết trong phân tử có hai nguyên tử Na và một nguyên tử S. b. Phosphoric acid, biết trong phân tử có ba nguyên tử H, một nguyên tử P và bốn nguyên tử O. 6. Viết công thức hoá học cho các chất được biểu diễn bằng những mô hình sau. Biết mỗi quả cầu biểu diễn cho một nguyên tử. 2. Tìm hiểu ý nghĩa của công thức hoá học - GV viết công thức hoá học của phân tử nước lên bảng và nêu câu hỏi: Công thức trên cho biết những thông tin gì? - GV lấy H2SO4 để minh hoạ: Công thức hoá học của sulfuric acid là H2SO4 cho biết: + Sulfuric acid được tạo thành từ H, S và O. + Trong một phân tử sulfuric acid có 2 nguyên tử H, 1 nguyên tử S và 4 nguyên tử O. + Khối lượng phân tử của sulfuric acid là: 2 1 + 1 32 + 4 16 = 98 (amu). - GV yêu cầu HS làm LT7 trang 42 SGK. Đường glucose là nguồn cung cấp năng lượng quan trọng cho hoạt động sống của con người. Đường glucose có công thức hoá học là C6H12O6. Hãy cho biết: a. Glucose được tạo thành từ những nguyên tố nào? b. Khối lượng mỗi nguyên tố trong một phân tử glucose bằng bao nhiêu? c. Khối lượng phân tử glucose là bao nhiêu? - GV hướng dẫn HS các bước tính % khối lượng các nguyên tố trong hợp chất khi biết công thức hoá học. - GV hướng dẫn HS tìm hiểu ví dụ 1 SGK trang 43. - GV yêu cầu HS làm LT8, LT9, VD trang 43 SGK. 8. Calcium carbonate là thành phần chính của đá vôi, có công thức hoá học là CaCO3. Tính phần trăm khối lượng của mỗi nguyên tố trong hợp chất trên.
9. Citric acid là hợp chất được sử dụng nhiều trong công nghiệp thực phẩm, dược phẩm. Trong tự nhiên, citric acid có trong quả chanh và một số loại quả như bưởi, cam,… Citric acid có công thức hoá học là C6H8O7. Hãy tính phần trăm khối lượng của mỗi nguyên tố trong citric acid.
Potassium (kali) rất cần thiết cho cây trồng, đặc biệt trong giai đoạn cây trưởng thành, ra hoa, kết trái, có thể sử dụng phân potassium chloride và potassium sulfate có công thức hoá học lần lượt là KCl và K2SO4. Người trồng cây muốn sử dụng loại phân bón có hàm lượng K cao hơn thì nên chọn loại phân bón nào?
- GV hướng dẫn HS các bước tính hoá trị của nguyên tố trong hợp chất có hai nguyên tố và minh hoạ bằng Ví dụ 2 SGK trang 44. - GV yêu cầu HS làm LT10 trang 44 SGK. Xác định hoá trị của mỗi nguyên tố trong các hợp chất sau: HBr, BaO. Bước 2. HS thực hiện nhiệm vụ học tập - HS quan sát, tiếp nhận câu hỏi, trả lời - GV quan sát và hướng dẫn HS thực hiện Bước 3. Báo cáo kết quả hoạt động, thảo luận - HS trình bày câu trả lời, ghi chép Bước 4. Đánh giá kết quả thực hiện - GV đánh giá, nhận xét, kết luận, chuyển sang nội dung mới. | II. Công thức hoá học 1. Công thức hoá học
Đáp án CH3, LT5, LT6 trang 41, 42 SGK. 3. a. N2 gồm: Nguyên tốN, có 2 nguyên tử N. b. NaCl gồm: + Nguyên tố Na, có 1 nguyên tử Na. + Nguyên tố Cl, có 1 nguyên tử Cl. c. MgSO4 gồm: + Nguyên tố Mg, có 1 nguyên tử Mg. + Nguyên tố S, có 1 nguyên tử S. + Nguyên tố O, có 4 nguyên tử O. 5. Công thức hoá học của các chất là: a. Na2S b. H3PO4 6.
2. Ý nghĩa của công thức hoá học - Công thức hoá học của một chất cho biết một số thông tin: + Nguyên tố tạo ra chất. + Số nguyên tử của mỗi nguyên tố có trong phân một phân tử chất. + Khối lượng phân tử của chất.
Đáp án LT7 trang 42 SGK. a. Glucose được tạo thành từ ba nguyên tố là C, H và O. b. Trong một phân tử glucose: Khối lượng C là 6 12 = 72 amu. Khối lượng H là 12 1 = 12 amu. Khối lượng O là 16 6 = 96 amu. c. Khối lượng phân tử glucose = 72 + 12 + 96 = 180 amu.
Đáp án LT8, LT9, VD trang 43 SGK. 8.
9.
- Xét hợp chất KCl có: MKCl = 1 39 + 1 35, 5 = 74,5 amu à % mK = = 52,3% - Xét hợp chất K2SO4 có: MK2SO4 = 2 39 + 1 32 + 4 16 = 174 amu à % mK = = 44,8% Ta thấy hàm lượng K trong KCl nhiều hơn trong K2SO4 Vậy người dùng muốn sử dụng loại phân bón có hàm lượng K cao hơn thì nên chọn phân bón potassium sulfate Đáp án LT10 trang 44 SGK: - Xét hợp chất HBr: + Gọi hoá trị của Br trong hợp chất là a + Vì H có hoá trị I nên ta có biểu thức: a 1 = I 1 à a = I Vậy H có hoá trị I và Br có hoá trị I. - Xét hợp chất BaO: + Gọi hoá trị của Ba trong hợp chất là a + Vì O có hoá trị II nên ta có biểu thức: a 1 = II 1 à a = II Vậy O có hoá trị II và Ba có hoá trị II. | ||||||||||||||||||||||||||||||
Hoạt động 3. Xác định công thức hoá học của hợp chất khi biết hoá trị hoặc phần trăm khối lượng của các nguyên tố.
- Mục tiêu:
- Lập công thức hoá học của hợp chất do hai nguyên tố tạo thành khi biết hoá trị của chúng.
- Xác định công thức hoá học của hợp chất khi biết % khối lượng của các nguyên tố và khối lượng phân tử của hợp chất.
- Nội dung: GV giảng giải, phân tích, yêu cầu HS đọc sgk, thảo luận, trả lời LT1 trang 45 SGK.
- Sản phẩm học tập: Câu trả lời của HS cho các câu hỏi và yêu cầu của GV
- Tổ chức thực hiện :
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS | DỰ KIẾN SẢN PHẨM |
Bước 1. GV chuyển giao nhiệm vụ học tập - GV nêu các bước xác định công thức hoá học của hợp chất gồm hai nguyên tố khi biết hoá trị: Nếu hai nguyên tố A, B có hoá trị tương ứng là a, b thì công thức hoá học của hợp chất tạo thành A và B được xác định như sau: + Đặt công thức hoá học của hợp chất AxBy. + Áp dụng quy tắc hoá trị, xác định tỉ lệ + Xác định x, y (x, y thường là những số nguyên nhỏ nhất thoả mãn tỉ lệ trên). - GV hướng dẫn HS tìm hiểu Ví dụ 3 SGK trang 45. - GV nêu các bước lập công thức hoá học của hợp chất khi biết phần trăm khối lượng của các nguyên tố và khối lượng phân tử của hợp chất: Khi biết phần trăm khối lượng của hai nguyên tố A, B tạo nên hợp chất và khối lượng phân tử của chất đó, xác định công thức hoá học theo các bước sau: + Đặt công thức hoá học của chất là AxBy. + Tính khối lượng của A, B trong phân tử chất. + Tìm x, y. - GV yêu cầu HS làm LT11 trang 45 SGK: Hợp chất X được tạo thành bởi Fe và O có khối lượng phân tử là 160 amu. Biết phần trăm khối lượng của Fe trong X là 70%. Hãy xác định công thức hoá học của X. Bước 2. HS thực hiện nhiệm vụ học tập - HS đọc thông tin, quan sát các ví dụ, trả lời câu hỏi. Bước 3. Báo cáo kết quả hoạt động, thảo luận - Đại diện 2- 3 HS đứng dậy trình bày câu trả lời - HS khác nhận xét, đánh giá, bổ sung Bước 4. Đánh giá kết quả thực hiện - GV đánh giá, nhận xét, kết luận, chuyển sang nội dung mới. | 3. Xác định công thức hoá học của hợp chất khi biết hoá trị hoặc phần trăm khối lượng của các nguyên tố.
Đáp án LT11 trang 45 SGK: Đặt công thức hoá học của X là FexOy Khối lượng nguyên tố Fe trong một phân tử X là: = 112 (amu) Khối lượng của nguyên tố O trong một phân tử X là: 160 – 112 = 48 (amu). Ta có: 56 amu x = 112 amu à x = 2. 16 amu y = 48 amu à y = 3. Vậy công thức hoá học của X là Fe2O3. |
- HOẠT ĐỘNG LUYỆN TẬP
- Mục tiêu: Giúp HS hệ thống lại kiến thức đã học
- Nội dung: GV chiếu câu hỏi, HS suy nghĩ, trả lời câu hỏi câu hỏi trắc nghiệm.
- Sản phẩm học tập: Câu trả lời của HS cho các câu hỏi trắc nghiệm.
- Tổ chức thực hiện:
Bước 1. GV chuyển giao nhiệm vụ học tập
- GV trình chiếu câu hỏi:
Câu 1. Hoá trị của một nguyên tố là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với
- A. nguyên tử hydrogen nguyên tử oxygen
- nguyên tử của nguyên tố khác D. nguyên tử helium.
------------------Còn tiếp-------------------------

MỘT VÀI THÔNG TIN:
- Word được soạn: Chi tiết, rõ ràng, mạch lạc
- Powerpoint soạn: Hiện đại, đẹp mắt để tạo hứng thú học tập
- Word và powepoint đồng bộ với nhau
PHÍ GIÁO ÁN:
- Giáo án word: 250k/học kì - 300k/cả năm
- Giáo án Powerpoint: 350k/học kì - 400k/cả năm
- Trọn bộ word + PPT: 400k/học kì - 450k/cả năm
=> Khi đặt sẽ nhận đủ giáo án cả năm ngay vào luôn
CÁCH ĐẶT:
- Bước 1: Chuyển phí vào STK: 10711017 - Chu Văn Trí- Ngân hàng ACB (QR)
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận giáo án
