Giáo án điện tử bài 2: Nguyên tử ( 6 tiết)
Bài giảng điện tử hóa học 7 kết nối tri thức. Giáo án powerpoint bài 2: Nguyên tử ( 6 tiết). Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 7 kết nối tri thức (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét









Xem video về mẫu Giáo án điện tử bài 2: Nguyên tử ( 6 tiết)
Xem toàn bộ: Giáo án điện tử hóa học 7 kết nối tri thức
CHÀO MỪNG CÁC EM ĐẾN VỚI TIẾT HỌC HÔM NAY!
KHỞI ĐỘNG
Quan sát các mẫu sau:
Các vật thể trên được tạo thành từ các chất gì?
CHƯƠNG I. NGUYÊN TỬ
SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
BÀI 2: NGUYÊN TỬ (6 Tiết)
NỘI DUNG BÀI HỌC
- Quan niệm ban đầu về nguyên tử
- Mô hình nguyên tử của Rơ-dơ- pho - Bo
- Cấu tạo nguyên tử
- Khối lượng nguyên tử
- Quan niệm ban đầu về nguyên tử
- Hàng ngàn năm về trước nhiều nhà thông thái Hy Lạp mà đại diện là Đê – mô – crit cho rằng: Sự tồn tại của một hạt vô cùng nhỏ bé (được gọi là nguyên tử) tạo nên sự đa dạng của vạn vật.
- Khởi nguồn của quan niệm nguyên tử là sự chia nhỏ một vật sẽ đến một giới hạn “không thể phân chia được nữa”.
- Đầu thế kỉ XIX, nhà khoa học người Anh tên Đan – tơn giải thích: Khi tiến hành các thí nghiệm hóa học, các chất thải tác dụng với nhau theo các lượng xác định ⇒ Chứng tỏ: có các đơn vị chất tối thiểu (được gọi là nguyên tử) để chúng kết hợp vừa đủ với nhau trong các phản ứng hóa học.
- Theo Đê-mô-crit và Đan-tơn, nguyên tử được quan niệm như thế nào?
- Đê–mô–crit quan niệm nguyên tử là những hạt vô cùng nhỏ, không thể phân chia nhỏ hơn được nữa, tạo nên các vật.
- Đan–tơn quan niệm tất cả các chất đều được cấu tạo nên từ nguyên tử. Nguyên tử là những hạt nhỏ nhất của vật chất, chúng không thể bị phân chia thành các hạt nhỏ hơn.
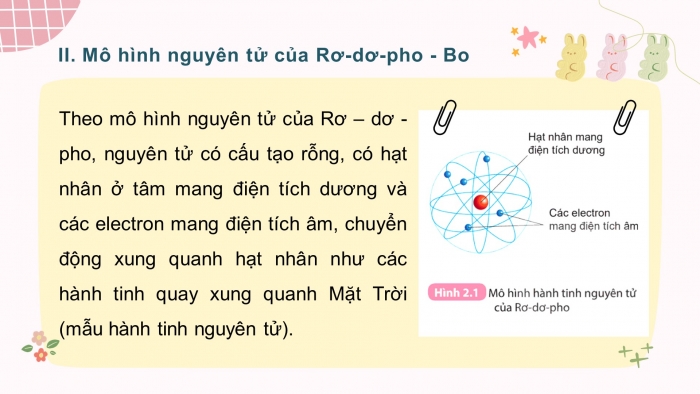
- Mô hình nguyên tử của Rơ-dơ-pho - Bo
Theo mô hình nguyên tử của Rơ – dơ - pho, nguyên tử có cấu tạo rỗng, có hạt nhân ở tâm mang điện tích dương và các electron mang điện tích âm, chuyển động xung quanh hạt nhân như các hành tinh quay xung quanh Mặt Trời (mẫu hành tinh nguyên tử).
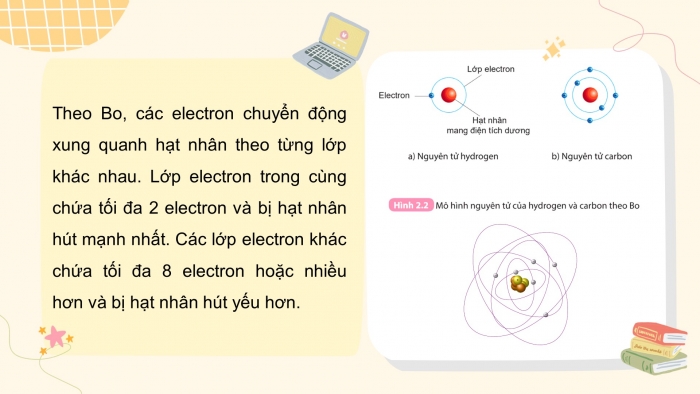
Theo Bo, các electron chuyển động xung quanh hạt nhân theo từng lớp khác nhau. Lớp electron trong cùng chứa tối đa 2 electron và bị hạt nhân hút mạnh nhất. Các lớp electron khác chứa tối đa 8 electron hoặc nhiều hơn và bị hạt nhân hút yếu hơn.
Thực hành: Làm mô hình nguyên tử carbon theo Bo
- Chuẩn bị: bìa carton, giấy màu vàng, các viên bi nhựa to màu đỏ và các viên bi nhỏ màu xanh.
Tiến hành:
- Gắn các viên bi xanh và đỏ lên bìa carton (như hình).
Thảo luận nhóm và trả lời câu hỏi:
- Các đường tròn bằng giấy màu vàng biểu diễn gì?
- Em hãy cho biết số electron có trong lớp electron thứ nhất, thứ hai của nguyên tử carbon và chỉ ra lớp electron đã chứa tối đa electron.
- Các đường tròn bằng giấy màu vàng biểu diễn các lớp electron.
- Số electron có trong lớp electron thứ nhất và thứ hai của nguyên tử carbon lần lượt là 2 và 4. Lớp thứ nhất đã chứa tối đa electron.
Thảo luận nhóm đôi, hoàn thành phần câu hỏi và bài tập:
- Quan sát Hình 2.1 và cho biết các thành phần cấu tạo nên nguyên tử.
Hạt nhân ở tâm nguyên tử và electron chuyển động xung quanh hạt nhân nguyên tử.
- Quan sát Hình 2.2 và áp dụng mô hình nguyên tử của Bo, mô tả cấu tạo nguyên tử hydrogen và nguyên tử carbon.
- Nguyên tử hydrogen gồm hạt nhân ở tâm nguyên tử và một electron ở lớp electron thứ nhất của nguyên tử.
- Nguyên tử carbon có hạt nhân ở tâm và hai lớp electron: lớp thứ nhất có 2 electron và lớp thứ hai có 4 electron.
III. Cấu tạo nguyên tử
- Hạt nhân nguyên tử
Nguyên tử có kích thước vô cùng nhỏ, chỉ khoảng một phần mười tỉ mét. Kích thước của hạt nhân còn nhỏ hơn nữa và chỉ bằng khoảng một phần mười ngàn kích thước của nguyên tử.
Cấu tạo hạt nhân nguyên tử
Hạt nhân nguyên tử tạo thành từ các hạt proton (p) và neutron (n):
- Hạt neutron không mang điện.
- Mỗi hạt proton mang đơn vị điện tích dương, quy ước +1.
- Số đơn vị điện tích hạt nhân bằng tổng số hạt proton có trong hạt nhân kí hiệu Z. (Z = tổng số p trong hạt nhân).
Quan sát Hình 2.4 và cho biết:
- Hạt nhân nguyên tử có một hay nhiều hạt? Các hạt đó thuộc cùng một loại hạt hay nhiều loại hạt?
- Số đơn vị điện tích hạt nhân của helium bằng bao nhiêu?
Câu 1. Hình 2.4 cho biết hạt nhân nguyên tử có nhiều hạt. Các hạt đó thuộc hai loại hạt khác nhau là proton và neutron.
Câu 2. Số đơn vị diện tích hạt nhân của helium bằng +2.
- Vỏ nguyên tử
Vỏ nguyên tử được tạo nên bởi các electron. Mỗi electron mang một đơn vị điện tích âm, quy ước là -1.
- Các electron sắp xếp thành từng lớp: lớp thứ nhất (hần hạt nhân nhất) có tối đa 2 electron, lớp thứ hai có tối đa 8 electron,.. các electron sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết.
- Các lớp electron ngoài cùng quyết định tính chất hóa học của nguyên tử.
Tìm hiểu cấu tạo một số nguyên tố
Quan sát các mô hình nguyên tử trên, thảo luận nhóm và hoàn thành bảng theo mẫu sau:
Quan sát Hình 2.6 và cho biết:
- Thứ tự sắp xếp các electron ở vỏ nguyên tử chlorine.
- Số electron trên từng lớp ở vỏ nguyên tử chlorine.
Câu 1.
Thứ tự sắp xếp các electron ở vỏ nguyên tử chlorine: lần lượt ở lớp trong cùng, gần hạt nhân nhất ra phía ngoài xa hạt nhân hơn.
Câu 2.
Lớp electron thứ nhất (lớp trong cùng gần hạt nhân nhất) có 2 electron, lớp electron thứ hai có 8 electron và lớp electron ngoài cùng có 7 electron.
- Khối lượng nguyên tử
Khối lượng nguyên tử bằng tổng khối lượng của các hạt proton, neutron trong hạt nhân và các hạt electron ở vỏ nguyên tử.
Đơn vị khối lượng nguyên tử: amu (atomic mass unit) = khối lượng nguyên tử carbon:
- p ≈ n ≈ 1 amu.
- e ≈ 0,00055 amu.
Hoạt động nhóm đôi, thảo luận và trả lời câu hỏi 1, 2 trang 18 SGK.
Câu 1. Em hãy cho biết vì sao khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử.
Câu 2. Hãy so sánh khối lượng của nguyên tử nhôm (13p, 14n) và nguyên tử đồng (29p, 36n).
Câu 1.
Vì khối lượng mỗi hạt proton hoặc neutron ở hạt nhân lớn hơn khối lượng mỗi hạt electron ở vỏ nguyên tử hàng nghìn lần, nên có thể coi khối lượng của hạt nhân nguyên tử là khối lượng của nguyên tử.
Câu 2.
Mỗi proton có khối lượng xấp xỉ bằng khối lượng mỗi neutron và bằng 1amu. Do vậy, khối lượng nguyên tử nhôm (xấp xỉ bằng 27 amu), nhỏ hơn khối lượng nguyên tử đồng đã cho (xấp xỉ bằng 65 amu).
LUYỆN TẬP
Câu 1. Phát biểu nào sau đây không mô tả đúng mô hình nguyên tử của Ro-do-pho - Bo?
- Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở tâm nguyên tử và các electron ở vỏ nguyên tử.
- Nguyên tử có cấu tạo đặc khít, gồm hạt nhân nguyên tử và các electron.
- Electron chuyển động xung quanh hạt nhân theo những quỹ đạo xác định tạo thành các lớp electron.
- Hạt nhân nguyên tử mang điện tích dương, electron mang điện tích âm.
Câu 2. Cho các phát biểu:
(1) Nguyên tử trung hoà về điện.
(2) Khối lượng của nguyên tử tập trung chủ yếu ở hạt nhân.
(3) Trong nguyên tử, số hạt mang điện tích dương bằng số hạt mang điện tích âm nên số hạt electron bằng số hạt neutron.
(4) Vỏ nguyên tử, gồm các electron có khoảng cách khác nhau đối với hạt nhân.
Trong các phát biểu trên, số phát biểu đúng là:
- 1 B. 2 C. 3 D. 4
Câu 3. Trừ hạt nhân của nguyên tử hydrogen, hạt nhân các nguyên tử còn lại được tạo thành từ hạt
- electron và proton.
- electron, proton và neutron.
- neutron và electron.
- proton và neutron.
Câu 4. Muối ăn chứa hai nguyên tố hoá học là natri (sodium) và chlorine. Trong hạt nhân nguyên tử của các nguyên tố natri và chlorine có lần lượt 11 và 17 proton. Số electron ở lớp ngoài cùng của vỏ nguyên tử natri và chlorine lần lượt là
- 1 và 7. 3 và 9.
- 9 và 15. D. 3 và 7.
Câu 5. Mặt Trời chứa chủ yếu hai nguyên tố hóa học là hydrogen (H) và hedium (He). Hình 2.2 biểu diễn một nguyên tử hydrogen và một nguyên tử helium.
Dựa vào hình vẽ trên hãy cho biết:
- a) Mỗi vòng tròn xung quanh hạt nhân được gọi là gì?
- Một liên kết.
- Một electron.
- Một lớp vỏ electron.
- Một proton.
- b) Có bao nhiêu electron trong lớp vỏ của nguyên tử H, He? Có bao nhiêu proton trong hạt nhân của nguyên tử H, He?
Nguyên tử H có 1 electron, 1 proton.
Nguyên tử He có 2 electron, 2 proton.
VẬN DỤNG
Câu 1. Giải thích vì sao có thể coi khối lượng nguyên tử tập trung ở hạt nhân, lấy ví dụ về một nguyên tử để minh họa.
Câu 2. Mô tả sự khác nhau giữa cấu tạo một nguyên tử hydrogen và cấu tạo một nguyên tử helium.
Câu 1.
Nguyên tử được tạo thành từ ba loại hạt là electron, proton, neutron. Khối lượng nguyên tử là tổng khối lượng của các hạt có trong nguyên tử. Tuy nhiên, do khối lượng của electron nhỏ hơn khối lượng của proton và neutron rất nhiều nên có thể coi khối lượng electron là không đáng kể so với khối lượng của nguyên tử, hay nói cách khác, có thể coi khối lượng nguyên tử tập trung ở hạt nhân.
Ví dụ: Nguyên tử carbon có 6 electron, 6 proton và 6 neutron.
Khối lượng của nguyên tử là: 6. 0,00055 + 6.1 + 6. 1 = 12,0033(amu), xấp xỉ khối lượng hạt nhân là 12 amu.
Câu 2.
Một nguyên tử hydrogen có 1 electron ở vỏ nguyên tử và 1 proton ở hạt nhân nguyên tử.
Nguyên tử helium có 2 electron ở vỏ nguyên tử, hạt nhân nguyên tử gồm 2 proton và 2 neutron.
HƯỚNG DẪN VỀ NHÀ
Ôn lại kiến thức đã học
Hoàn thành bài tập trong SBT
Chuẩn bị trước Bài 3. Nguyên tố hóa học.
HẸN GẶP LẠI CÁC EM TRONG TIẾT HỌC SAU!
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hóa học 7 kết nối tri thức
GIÁO ÁN WORD LỚP 7 - SÁCH KẾT NỐI
GIÁO ÁN POWERPOINT LỚP 7 - SÁCH KẾT NỐI
GIÁO ÁN LỚP 7 CÁC BỘ SÁCH KHÁC
Giáo án lớp 7 sách cánh diều (bản powrerpoint)
Giáo án lớp 7 sách chân trời sáng tạo (bản powrerpoint)
Giáo án lớp 7 sách chân trời sáng tạo (bản word)
Giáo án lớp 7 sách cánh diều (bản word)
