Giáo án powerpoint hóa học 10 kì 2 kết nối tri thức
Giáo án powerpoint hay còn gọi là giáo án điện tử, bài giảng điện tử, giáo án trình chiếu. Dưới đây là bộ giáo án powerpoint hóa học 10 kì 2 sách kết nối tri thức. Giáo án được thiết kế theo phong cách hiện đại, đẹp mắt để tạo hứng thú học tập cho học sinh. Với tài liệu này, hi vọng việc dạy môn hóa học 10 kết nối tri thức của thầy cô sẽ nhẹ nhàng hơn
Click vào ảnh dưới đây để xem giáo án rõ











Xem video về mẫu Giáo án powerpoint hóa học 10 kì 2 kết nối tri thức
Phần trình bày nội dung giáo án
I. GIÁO ÁN WORD HÓA HỌC 10 KẾT NỐI TRI THỨC
Ngày soạn: .../.../...
Ngày dạy: .../.../...
BÀI 15. PHẢN ỨNG OXI HÓA – KHỬ
- MỤC TIÊU:
- Kiến thức: Học xong bài này, HS đạt các yêu cầu sau:
- Nêu được khái niệm và xác định được só oxi hóa của nguyên tử các nguyên tố trong hợp chất.
- Nêu được khái niệm về phản ứng oxi hóa – khử và ý nghĩa của phản ứng oxi hóa – khử.
- Lập được phương trình hóa học của phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron.
- Mô tả được một số phản ứng oxi hóa – khử quan trọng trong cuộc sống.
- Năng lực
- Năng lực chung:
- Năng lực tự chủ và tự học: Chủ động, tích cực tìm hiểu về phản ứng oxi hóa – khử, các ứng dụng và vai trò của phản ứng oxi hóa – khử.
- Năng lực giao tiếp và hợp tác: Hoạt động nhóm và cặp đôi theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo; Sử dụng ngon ngữ hóa học để diễn đạt về phản ứng oxi hóa – khử.
- Năng lực giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
- Năng lực riêng:
- Năng lực nhận thức hóa học: Nêu được khái niệm và xác định được số oxi hóa của nguyên tử và các nguyên tố hóa học trong hợp chất; Nêu được khái niệm về phản ứng oxi hóa – khử và ý nghĩa của phản ứng oxi hóa – khử; Mô tả được một số phản ứng oxi hóa – khủ quan trọng gắn liền với cuộc sống; Cân bằng được phản ứng oxi hóa – khử bẳng phương pháp thăng bằng electron.
- Tìm hiểu thế giới tự nhiên dưới góc độ hóa học: Tiến hành được thí nghiệm về phản ứng oxi hóa khử.
- Vận dụng kiến thức kĩ năng đã học: Tìm hiểu, đưa ra được ví dụ về phản ứng oxi hóa – khủ và rút ra kết luận về vai trò của phản ứng oxi hóa – khử với cuộc sống.
- Phẩm chất
- Cẩn trọng, trung thực và thực hiện an toàn trong quá trình làm thực hành.
- Có niềm say mê, hứng thú với việc học tập.
- Tham gia tích cực hoạt động cặp đôi hay hoạt động nhóm.
- THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Đối với GV: SGK, Tài liệu giảng dạy, giáo án PPT, dụng cụ thí nghiệm
- Đối với HS: SGK, vở ghi, giấy nháp, đồ dùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm.
III. TIẾN TRÌNH DẠY HỌC
- HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
- a) Mục tiêu: Hoạt động này giúp HS vừa liên hệ kiến thức vừa kết nối vào nội dung chính của bài mới.
- b) Nội dung: HS hoạt động cá nhân trả lời câu hỏi mở đầu liên quan đến bài học.
- c) Sản phẩm: Câu trả lời của HS cho câu hỏi mở đầu.
- d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ
- GV yêu cầu HS trả lời câu hỏi mở đầu: Trong lò luyện gang, xảy ra phản ứng oxi hóa khử theo sơ đồ sau:
Fe2O3 + CO Fe + CO2
Hình ảnh trong 1 nhà máy luyện gang
Về bản chất, phản ứng oxi hóa khử là gì? Dựa vào đâu để nhận ra loại phản ứng đó? Làm thế nào để lập phương trình hóa học của phản ứng trên?
Bước 2: Thực hiện nhiệm vụ
- HS quan sát và chú ý lắng yêu cầu và dự đoán đáp án.
Bước 3: Báo cáo, thảo luận:
- Các HS xung phong phát biểu trả lời.
Bước 4: Kết luận, nhận xét:
- GV nhận xét, đánh giá và dẫn dắt vào bài mới: Để biết được chính xác đáp án những câu hỏi trên chúng ta cùng nhau đi tìm hiểu bài mới: Bài 15. Phản ứng oxi hóa – khử.
- HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu về số oxi hóa
- a) Mục tiêu: HS nêu được khái niệm và xác định được số oxi hóa của nguyên tử các nguyên tố trong hợp chất.
- b) Nội dung: HS làm việc nhóm, trả lời các câu hỏi trong sgk và hình thành nên kiến thức.
- c) Sản phẩm: Khái niệm số oxi hóa và cách biểu diễn số oxi hóa, cách xác định số oxi hóa, đáp án câu hỏi 1 sgk trang 72.
- d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS | SẢN PHẨM DỰ KIẾN |
Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS đọc thông tin trong sgk, xung phong phát biểu nêu khái niệm số oxi hóa và cách biểu diễn số oxi hóa.
- GV đưa ra ví dụ 1: Xét phân tử NaCl Nguyên tử Na nhường 1 electron cho nguyên tử Cl, khi đó, nguyên tử Na trở thành ion dương mang điện tích 1+ ( số oxi hóa của Na là +1) và nguyên tử Cl nhận 1 electron của nguyên tử Na trở thành ion âm mang điện tích 1- ( số oxi hóa của Cl là -1) - GV yêu cầu HS đọc ví dụ 2, 3 và tìm số oxi hóa của phân tử HCl và N2.
- GV dẫn lời: “Những quy tắc xác định số oxi hóa sẽ giúp chúng ta tìm ra số oxi hóa của nguyên tử trong hợp chất nhanh hơn.” - GV yêu cầu HS đọc sgk nêu quy tắc 1 và yêu cầu lấy thêm ví dụ khác sgk.
- GV yêu cầu HS đọc sgk, quan sát bảng 15.2, nêu quy tắc 2. - GV yêu cầu HS đọc sgk nêu quy tắc 3 và yêu cầu lấy ví dụ minh họa bằng phân tử CO2.
- GV yêu cầu HS đọc sgk nêu quy tắc 4 và yêu cầu lấy ví dụ minh họa bằng ion Cl- và NH4+
- GV đưa ra các bước xác định số oxi hóa, yêu cầu HS hoạt động nhóm 4 vận dụng các bước để trả lời câu hỏi 1 sgk trang 73. Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS thảo luận nhóm suy nghĩ trả lời câu hỏi. Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS giơ tay phát biểu. - Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. | I. Số oxi hóa 1. Khái niệm Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn. Cách biểu diễn số oxi hóa: Số oxi hóa được viết ở dạng đại số, dấu viết trước số viết sau. Xét phân tử HCl: Độ âm điện của Cl lớn hơn độ âm điện của nguyên tử H, nếu các cặp electron liên kết chuyển hoàn toàn về nguyên tử Cl thì nguyên tử Cl có thêm 1 cặp electron và trở thành ion âm có điện tích 1- ( số oxi hóa của Cl là -1); nguyên tử H mất đi 1 electron và trở thành ion dương có điện tích 1+ ( số oxi hóa của H là +1) Xét phân tử N2: Hai nguyên tử N giống hệt nhau nên cặp electron liên kết không lệch về nguyên tử nào. Do vậy, mỗi nguyên tử H đều trung hòa về điện, có điện tích bằng 0 và số oxi hóa là 0. 2. Quy tắc xác định số oxi hóa
- Quy tắc 1: Trong đơn chất, số oxi hóa của nguyên tử bằng 0. Ví dụ:
- Quy tắc 2: Trong phân tử hợp chất thông thường, số oxi hóa của hydrogen là +1, của oxygen là -2, các kim loại điển hình có số oxi hóa dương và có giá trị bằng số electron hóa trị. - Quy tắc 3: Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0 Ví dụ:
Tổng số oxi hóa = (+4).1 + (-2).2 = 0 - Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion. Ví dụ: ion Cl- có số oxi hóa là -1 Ion NH4+ : Tổng số oxi hóa = (-3) + (+1).4 = +1 Các bước xác định số oxi hóa: Bước 1: Xác định chất cần xác định là đơn chất, hợp chất hay ion. -TH1: Là đơn chất → áp dụng quy tắc 1 -TH2: Là hợp chất/ion → bước 2: Bước 2: Xác định số oxi hóa của các nguyên tố số có SOH thường không đỏi. Bước 3:Đặt SOH của nguyên tố còn lại là x, Áp dụng QT3 hoặc QT4 để tìm x. - Trả lời câu hỏi 1 sgk trang 73: a) Số oxi hóa của nguyên tử Fe trong Fe, FeO, Fe2O3, Fe(OH)3, Fe3O4 lần lượt là 0, +2, +3, +3, b) Số oxi hóa của nguyên tử S trong S, H2S, SO2, SO3, H2SO4, Na2SO3 lần lượt là 0, -2, +4, +6, +6, +4.
|
II. GIÁO ÁN POWERPOINT HÓA HỌC 10 KẾT NỐI TRI THỨC
BÀI 15: PHẢN ỨNG OXI HÓA – KHỬ
- KHỞI ĐỘNG
Trong lò luyện gang, xảy ra phản ứng oxi hóa khử theo sơ đồ sau:
Fe2O3 + CO Fe + CO2
Hình ảnh
Về bản chất, phản ứng oxi hóa khử là gì? Dựa vào đâu để nhận ra loại phản ứng đó? Làm thế nào để lập phương trình hóa học của phản ứng trên?
- NỘI DUNG BÀI HỌC
- Số oxi hoá
- Chất oxi hoá, chất khử, phản ứng oxi hoá – khử
- Lập phương trình hoá học của phản ứng oxi hoá – khử
- Phản ứng oxi hoá – khử trong thực tiễn
III. PHẦN TRIỂN KHAI KIẾN THỨC
- Số oxi hoá
1.1. Khái niệm
Em hãy đọc đọc SGK và trả lời câu hỏi:
Nêu khái niệm số oxi hóa và cách biểu diễn số oxi hóa.
Khái niệm: Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn.
Cách biểu diễn số oxi hóa: Số oxi hóa được viết ở dạng đại số, dấu viết trước số viết sau.
Ví dụ 1: Xét phân tử NaCl
|
|
Nguyên tử Na nhường 1 electron cho nguyên tử Cl, khi đó, nguyên tử Na trở thành ion dương mang điện tích 1+ ( số oxi hóa của Na là +1) và nguyên tử Cl nhận 1 electron của nguyên tử Na trở thành ion âm mang điện tích 1- ( số oxi hóa của Cl là -1)
Em hãy đọc Ví dụ 2, 3 SGK trang 71 và trả lời câu hỏi:
|
|
Ví dụ 2: Xét phân tử H2O
|
|
Ví dụ 3: Xét phân tử H2
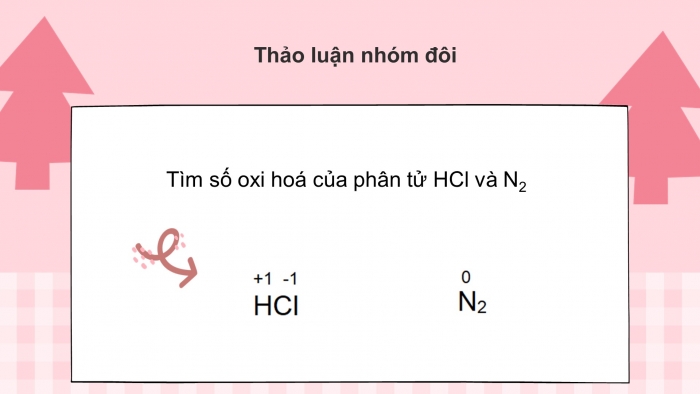
Câu hỏi: Tìm số oxi hoá của phân tử HCl và N2
|
|
|
|
Đáp án:
- Quy tắc xác đinh số oxi hoá
Em hãy đọc sgk và nêu quy tắc 1.
Quy tắc 1: Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
Ví dụ:
Em hãy đọc sgk, quan sát bảng 15.1 và nêu quy tắc 2.
Bảng 15.1. Số oxi hoá thường gặp của một số nguyên tử trong hợp chất
Nguyên tử | Hydrogen | Oxygen | Kim loại kiềm (nhóm IA) | Kim loại kiềm thổ (nhóm IIA) | Aluminium |
Số oxi hoá | +1 | -2 | +1 | +2 | +3 |
Quy tắc 2: Trong phân tử hợp chất thông thường, số oxi hóa của hydrogen là +1, của oxygen là -2, các kim loại điển hình có số oxi hóa dương và có giá trị bằng số electron hóa trị.
Em hãy đọc sgk, nêu quy tắc 3 và lấy ví dụ minh hoạ.
Quy tắc 3: Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0
|
Ví dụ:
|
Tổng số oxi hoá = (+4).1 + (-2).2 = 0
Em hãy đọc sgk, nêu quy tắc 4 và lấy ví dụ minh hoạ.
Quy tắc 3: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.
Ví dụ: ion Cl- có số oxi hóa là -1
Ion NH4+ :
Tổng số oxi hoá = (-3) + (+1).4 = +1
Các bước xác định số oxi hóa:
Bước 1: Xác định chất cần xác định là đơn chất, hợp chất hay ion.
- TH1: Là đơn chất → áp dụng quy tắc 1
- TH2: Là hợp chất/ion → bước 2:
Bước 2: Xác định số oxi hóa của các nguyên tố số có số oxi hoá thường không đổi.
Bước 3:Đặt số oxi hoá của nguyên tố còn lại là x, Áp dụng QT3 hoặc QT4 để tìm x.
Em hãy trả lời câu hỏi 1 SGK trang 73
- Xác định số oxi hoá của nguyên tử Fe và S trong các chất sau:
- Fe, FeO, Fe2O3, Fe(OH)3, Fe3O4
- S, H2S, SO2, SO3, H2SO4, Na2SO3
Đáp án:
- a) Số oxi hóa của nguyên tử Fe trong Fe, FeO, Fe2O3, Fe(OH)3, Fe3O4 lần lượt là 0, +2, +3, +3,
- b) Số oxi hóa của nguyên tử S trong S, H2S, SO2, SO3, H2SO4, Na2SO3 lần lượt là 0, -2, +4, +6, +6, +4.
- Chất oxi hoá, chất khử, phản ứng oxi hoá – khử
2.1. Chất oxi hoá, chất khử
Thảo luận nhóm đôi: Tìm hiểu Ví dụ 1, áp dụng viết quá trình khử, oxi hoá của các nguyên tử, phân tử trong Ví dụ 2, 3 SGK trang 73.
|
Ví dụ 1: Đưa mẩu than gỗ nóng đỏ vào bình đựng khí O2, mẩu than cháy sáng.
C + O2 CO2
|
Trong phản ứng trên, nguyên tử C nhường 4 electron, là chất khử; phân tử O2 nhận 4 electron, là chất oxi hoá.
|
C C + 4e (quá trình oxi hoá)
|
O2 + 4e 2O (quá trình khử)
Ví dụ 2:
|
Nguyên tử C nhường 4 electron, C là chất khử:
C C + 8e (quá trình oxi hóa)
|
Phân tử O2 nhận 4 electron, là chất oxi hoá:
O2 + 4e 2O (quá trình khử)
Ví dụ 3:
|
Nguyên tử C nhận 4 electron, C là chất khử:
C C + 8e (quá trình oxi hóa)

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
