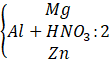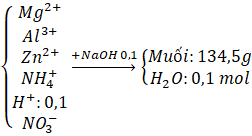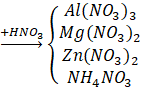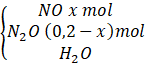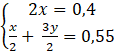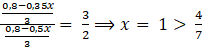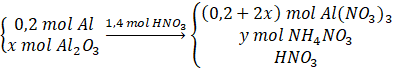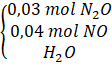Giáo án bồi dưỡng học sinh giỏi Hoá học 9
Giáo án Chuyên đề Bồi dưỡng học sinh giỏi môn Hoá học 9 dùng chung cho các bộ sách mới: Kết nối tri thức với cuộc sống, Chân trời sáng tạo, Cánh diều. Bộ tài liệu soạn theo chủ đề bao gồm tóm tắt lí thuyết, câu hỏi và bài tập sẽ giúp học sinh ôn luyện nâng cao, ôn thi HSG đạt kết quả tốt. Giáo án tải về và chỉnh sửa được. Mời thầy cô tham khảo.
Click vào ảnh dưới đây để xem giáo án rõ








Phần trình bày nội dung giáo án
CHỦ ĐỀ 1. KIM LOẠI. SỰ KHÁC NHAU CƠ BẢN
GIỮA PHI KIM VÀ KIM LOẠI
A. TÓM TẮT KIẾN THỨC LÝ THUYẾT
I. TÍNH CHẤT CHUNG CỦA KIM LOẠI
1. Tính chất vật lí của kim loại
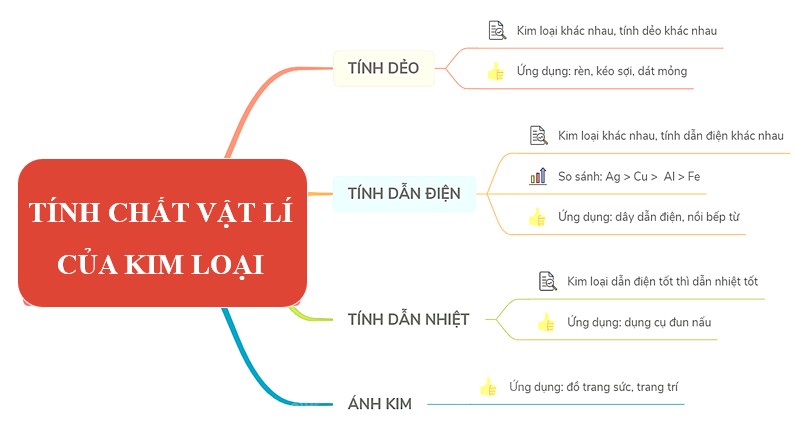
Tính chất hóa học của kim loại

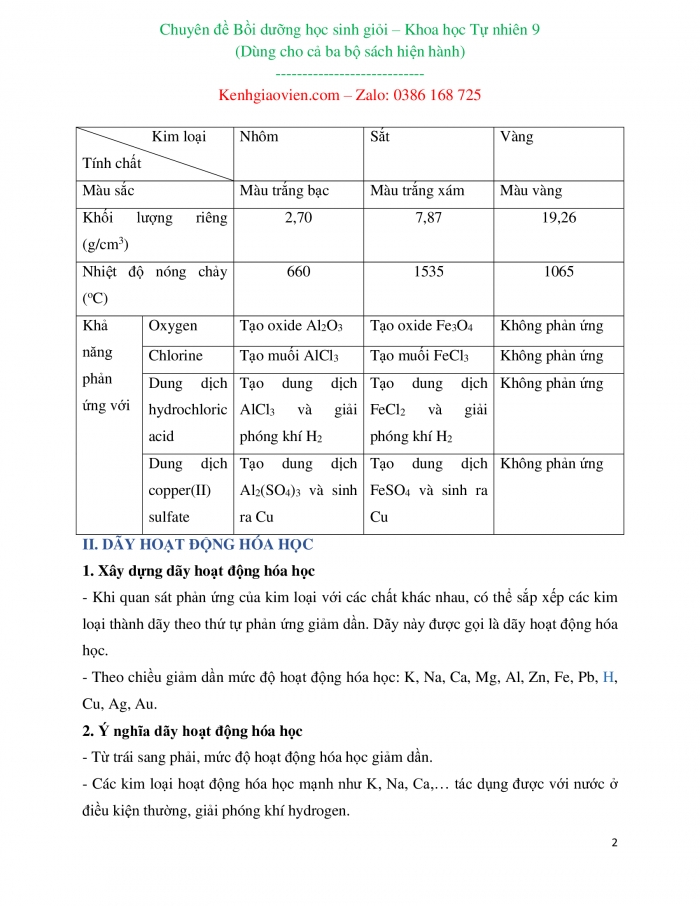
Sự khác biệt về tính chất của một số kim loại
Kim loại Tính chất | Nhôm | Sắt | Vàng | |
Màu sắc | Màu trắng bạc | Màu trắng xám | Màu vàng | |
Khối lượng riêng (g/cm3) | 2,70 | 7,87 | 19,26 | |
Nhiệt độ nóng chảy (oC) | 660 | 1535 | 1065 | |
Khả năng phản ứng với | Oxygen | Tạo oxide Al2O3 | Tạo oxide Fe3O4 | Không phản ứng |
Chlorine | Tạo muối AlCl3 | Tạo muối FeCl3 | Không phản ứng | |
Dung dịch hydrochloric acid | Tạo dung dịch AlCl3 và giải phóng khí H2 | Tạo dung dịch FeCl2 và giải phóng khí H2 | Không phản ứng | |
Dung dịch copper(II) sulfate | Tạo dung dịch Al2(SO4)3 và sinh ra Cu | Tạo dung dịch FeSO4 và sinh ra Cu | Không phản ứng | |
II. DÃY HOẠT ĐỘNG HÓA HỌC
1. Xây dựng dãy hoạt động hóa học
- Khi quan sát phản ứng của kim loại với các chất khác nhau, có thể sắp xếp các kim loại thành dãy theo thứ tự phản ứng giảm dần. Dãy này được gọi là dãy hoạt động hóa học.
- Theo chiều giảm dần mức độ hoạt động hóa học: K, Na, Ca, Mg, Al, Zn, Fe, Pb, H, Cu, Ag, Au.
Ý nghĩa dãy hoạt động hóa học
- Từ trái sang phải, mức độ hoạt động hóa học giảm dần.
- Các kim loại hoạt động hóa học mạnh như K, Na, Ca,… tác dụng được với nước ở điều kiện thường, giải phóng khí hydrogen.
- Kim loại đứng trước H có thể tác dụng với dung dịch acid, giải phóng khí hydrogen.
- Kim loại đứng trước (trừ K, Na, Ca,…) có thể đẩy kim loại đứng sau ra khỏi dung dịch muối.
III. TÁCH KIM LOẠI VÀ VIỆC SỬ DỤNG HỢP KIM
1. Phương pháp tách kim loại
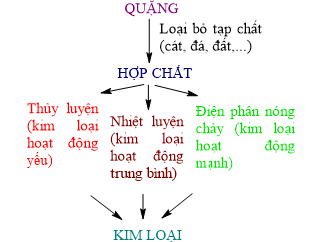
2. Tách một số kim loại có nhiều ứng dụng
Tách nhôm ra khỏi aluminium oxide bằng phản ứng điện phân
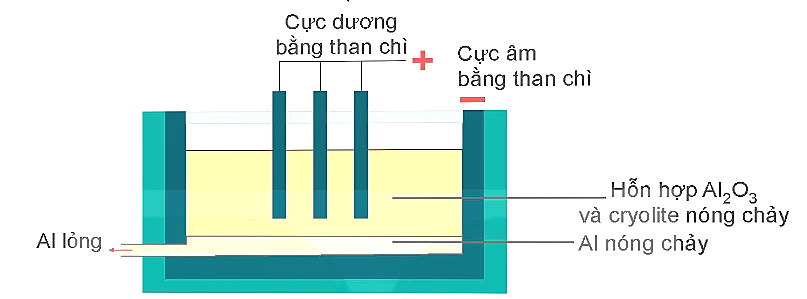
Sơ đồ bể điện phân aluminium oxide nóng chảy
Tách sắt ra khỏi iron(III) oxide
Fe2O3 + 3CO ![]() 2Fe + 3CO2
2Fe + 3CO2
c) Tách kẽm ra khỏi zinc sulfide
2ZnS + 3O2 ![]() 2ZnO + 2SO2
2ZnO + 2SO2
ZnO + C ![]() Zn + CO
Zn + CO
Hợp kim
Khái niệm
- Là vật liệu kim loại có chứa ít nhất một kim loại cơ bản và một số kim loại hoặc phi kim khác.
- Thành phần chính: kim loại cơ bản.
Ưu điểm
- Có nhiều ưu điểm vượt trội so với kim loại nguyên chất về độ cứng, độ bền, khả năng chống ăn mòn và gỉ sét.
Một số hợp kim phổ biến
Hợp kim | Thành phần chính | Tính chất đặc trưng | Ứng dụng phổ biến | |
Gang | Fe và 2-5% C. | Cứng, giòn | Làm đường ống, phụ kiến đường ống dẫn nước cấp, nồi, chảo, khuôn đúc,…. |
|
Thép (thông thường) | Fe và dưới 2% C. | Cứng, dẻo hơn gang | Làm khung công trình xây dựng, thiết bị, máy móc. |
|
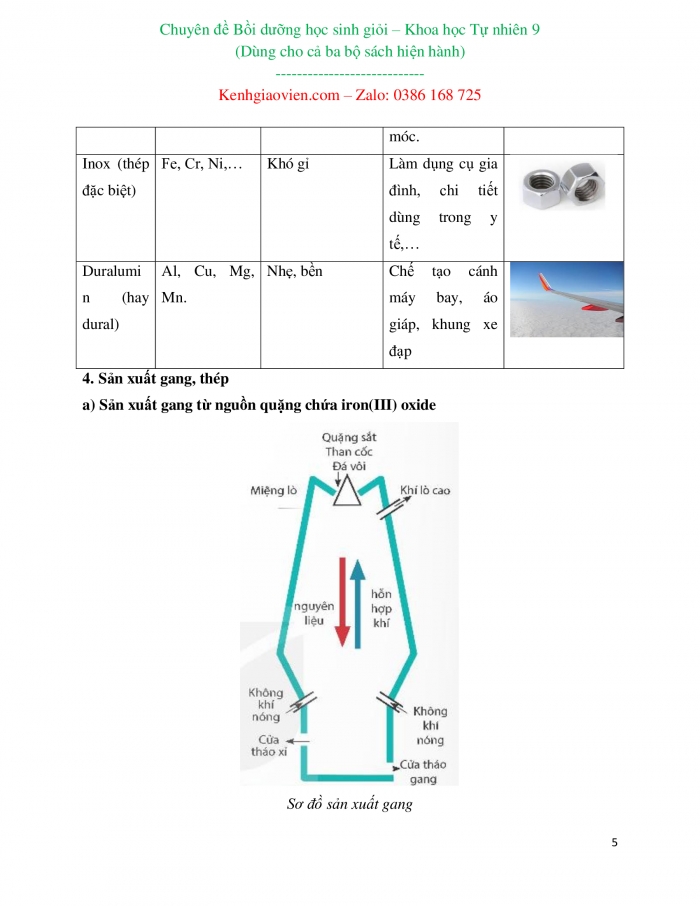
Inox (thép đặc biệt) | Fe, Cr, Ni,… | Khó gỉ | Làm dụng cụ gia đình, chi tiết dùng trong y tế,… |
|
Duralumin (hay dural) | Al, Cu, Mg, Mn. | Nhẹ, bền | Chế tạo cánh máy bay, áo giáp, khung xe đạp |
|
4. Sản xuất gang, thép
a) Sản xuất gang từ nguồn quặng chứa iron(III) oxide
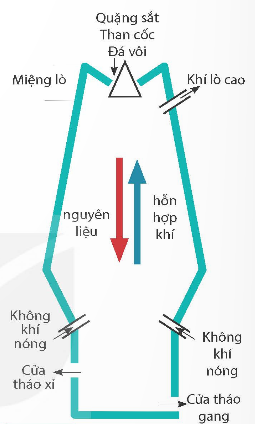
Sơ đồ sản xuất gang
b) Sản xuất thép
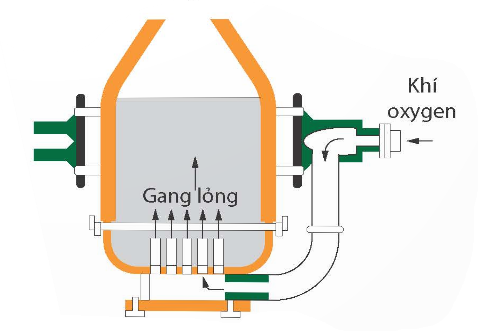
Sơ đồ sản xuất thép
IV. SỰ KHÁC NHAU CƠ BẢN GIỮA PHI KIM VÀ KIM LOẠI
1. Ứng dụng của một số phi kim quan trọng
a) Carbon
Than hoạt tính: dùng trong mặt nạ phòng độc, chất khử màu, khử mùi. |
|
Than cốc: làm nhiên liệu, nguyên liệu trong công nghiệp luyện kim,… |
|
Than chì: làm điện cực, chất bôi trơn, ruột bút chì,… |
|
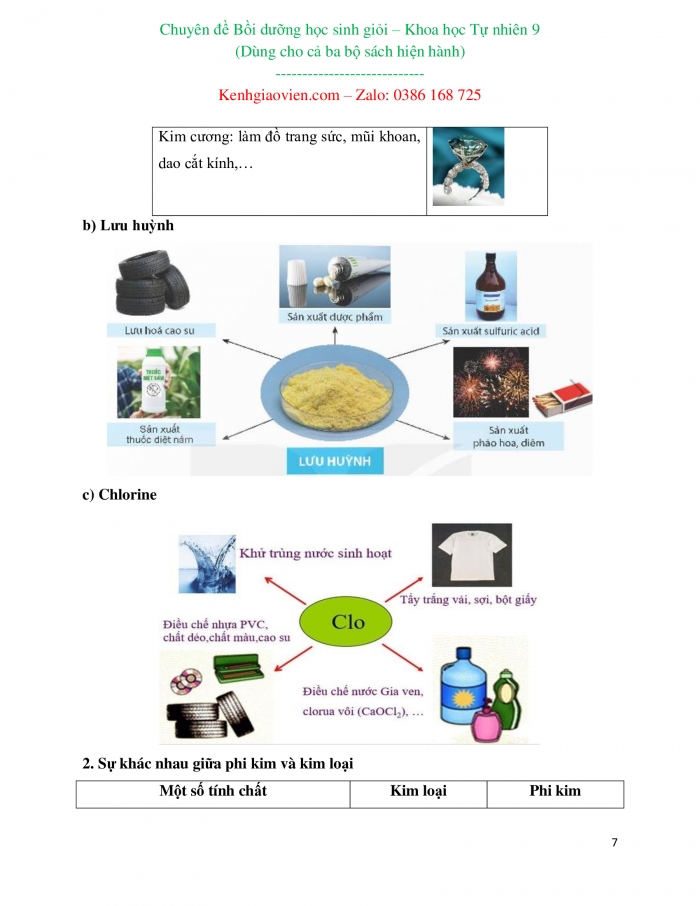
Kim cương: làm đồ trang sức, mũi khoan, dao cắt kính,… |
|
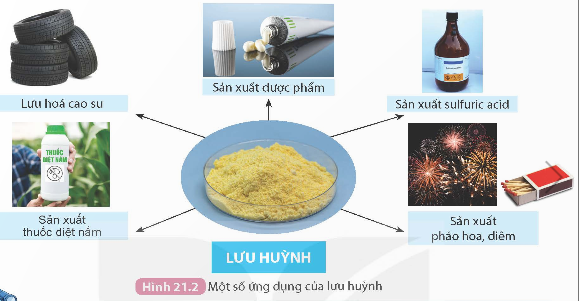
b) Lưu huỳnh
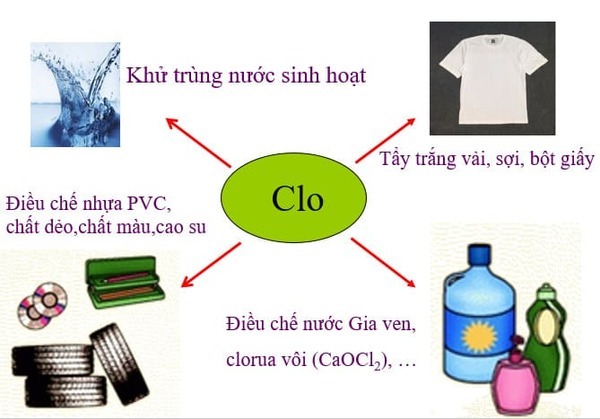
c) Chlorine
2. Sự khác nhau giữa phi kim và kim loại
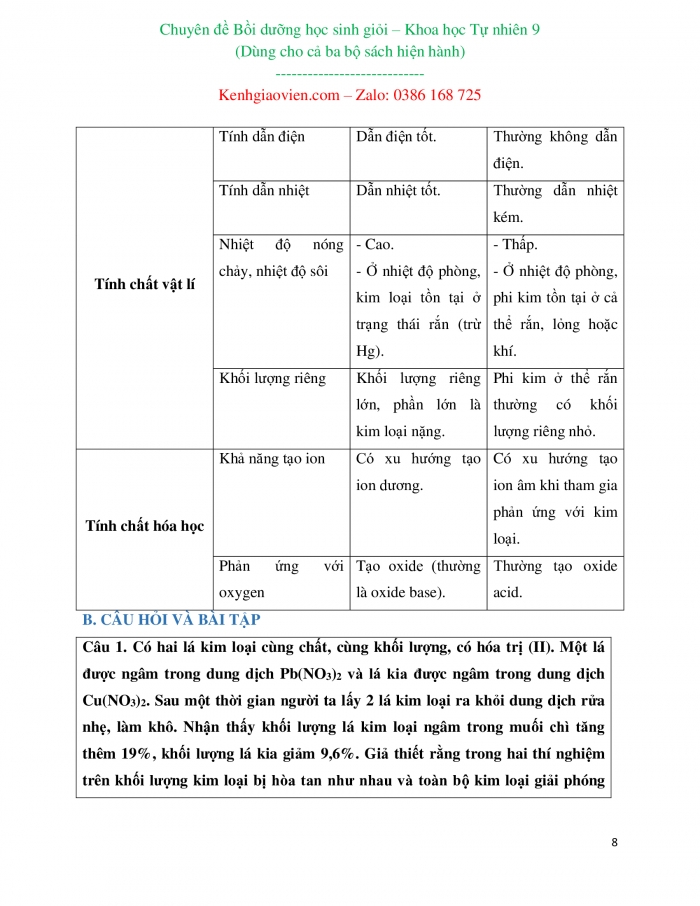
Một số tính chất | Kim loại | Phi kim | |
Tính chất vật lí | Tính dẫn điện | Dẫn điện tốt. | Thường không dẫn điện. |
Tính dẫn nhiệt | Dẫn nhiệt tốt. | Thường dẫn nhiệt kém. | |
Nhiệt độ nóng chảy, nhiệt độ sôi | - Cao. - Ở nhiệt độ phòng, kim loại tồn tại ở trạng thái rắn (trừ Hg). | - Thấp. - Ở nhiệt độ phòng, phi kim tồn tại ở cả thể rắn, lỏng hoặc khí. | |
Khối lượng riêng | Khối lượng riêng lớn, phần lớn là kim loại nặng. | Phi kim ở thể rắn thường có khối lượng riêng nhỏ. | |
Tính chất hóa học | Khả năng tạo ion | Có xu hướng tạo ion dương. | Có xu hướng tạo ion âm khi tham gia phản ứng với kim loại. |
Phản ứng với oxygen | Tạo oxide (thường là oxide base). | Thường tạo oxide acid. | |
B. CÂU HỎI VÀ BÀI TẬP
Câu 1. Có hai lá kim loại cùng chất, cùng khối lượng, có hóa trị (II). Một lá được ngâm trong dung dịch Pb(NO3)2 và lá kia được ngâm trong dung dịch Cu(NO3)2. Sau một thời gian người ta lấy 2 lá kim loại ra khỏi dung dịch rửa nhẹ, làm khô. Nhận thấy khối lượng lá kim loại ngâm trong muối chì tăng thêm 19%, khối lượng lá kia giảm 9,6%. Giả thiết rằng trong hai thí nghiệm trên khối lượng kim loại bị hòa tan như nhau và toàn bộ kim loại giải phóng bám vào thanh kim loại ban đầu. Hãy xác định tên kim loại đã dùng. Trả lời: Gọi kim loại cần tìm là R với số mol là a (mol). Phương trình hóa học: R + Pb(NO3)2 → R(NO3)2 + Pb a a mol R + Cu(NO3)2 → R(NO3)2 + Cu a a mol Theo bài ra, ta có: ⇒ |
Câu 2: Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg, Al, Zn trong 500 ml dung dịch HNO3 4M, sau phản ứng thu được dung dịch Y và 4,958 lít A (đkc) hỗn hợp gồm hai khí không màu có tỉ khối so với H2 là 18,5 trong đó có 1 khí hóa nâu ngoài không khí. Trung hòa dung dịch Y bằng lượng vừa đủ 100 mL dung dịch NaOH 1M, thu được dung dịch Z. Cô cạn Z, thu được 134,5 gam muối khan. Tính giá trị của m. Trả lời: Sơ đồ bài toán: m(g) - Khí hóa nâu ngoài không khí là NO MA = 18,5.2 = 37 (gam/mol) Khí còn lại trong A có M > 37 g/mol A là: N2O
Gọi số mol NO là x ⇒ Số mol N2O là 0,2 – x. Theo bài ra, ta có: 30x + (0,2 – x)44 = 0,2.37 ⇒ x = 0,1 (mol). Ta có:
Bảo toàn N: Gọi số mol gốc ⇒ Bảo toàn H: Áp dụng định luật bảo toàn khối lượng: 1,9.63 = a.62 + (1,6 – a).18 + 0,2.37 + (2a – 2,25).18 ⇒ a = 1,55 ⇒ m = 126 – 1,55.62 – (1,6 – 1,55).18 = 29 (g). |
Câu 3: Cho một thanh kim loại R hóa trị (II) không phản ứng với nước ở nhiệt độ phòng vào 200 gam dung dịch CuSO4 12% sau khi kết thúc phản ứng thu được dung dịch A chỉ có một muối tan của R có nồng độ 9,27835%. a) Xác định tên kim loại. b) Tính khối lượng kim loại R đã phản ứng. Trả lời: a) Phương trình hóa học: R + CuSO4 → RSO4 + Cu 0,15 0,15 0,15 0,15 (mol) Theo bài ra, ta có: ⇒ b) |
Câu 4: Nêu hiện tượng xảy ra và viết phương trình hóa học khi tiến hành các thí nghiệm sau: - Thí nghiệm 1: Cho đinh sắt sạch vào dung dịch copper (II) sulfate. - Thí nghiệm 2: Cho dây đồng vào dung dịch sulfuric acid có nồng độ 98% đun nóng. - Thí nghiệm 3: Cho mẫu kim loại Sodium bằng hạt đậu xanh vào dung dịch copper (II) sulfate. - Thí nghiệm 4: Sục từ từ khí carbon dioxide đến dư vào dung dịch nước vôi trong. Trả lời: - Thí nghiệm 1. Khi cho đinh sắt sạch vào dung dịch copper(II) sulfate, trên bề mặt đinh sắt (phần bị nhấn chìm trong dung dịch) có một lớp kim loại màu đỏ bám vào, màu xanh của dung dịch nhạt dần rồi mất hẳn (nếu đinh sắt dư). PTHH: Fe + CuSO4 → FeSO4 + Cu - Thí nghiệm 2. Cho dây đồng vào dung dịch sulfuric acid có nồng độ 98% rồi đun nóng thì dung dịch từ không màu chuyển dần sang màu xanh đồng thời có khí mùi hắc thoát ra. PTHH: Cu + 2H2SO4(đặc) → CuSO4 + SO2 + 2H2O - Thí nghiệm 3. Cho mẫu kim loại Sodium bằng hạt đậu xanh vào dung dịch copper (II) sulfate, viên kim loại sodium nóng chảy, vo tròn, chạy vòng quanh, nổi trên mặt nước, có khí không màu thoát ra đồng thời dung dịch xuất hiện kết tủa xanh lơ, màu xanh của dung dịch nhạt dần rồi mất hẳn (nếu sodium dư). PTHH: 2Na + 2H2O → 2NaOH + H2 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4. - Thí nghiệm 4. Sục từ từ khí carbon dioxide vào dung dịch nước vôi trong cho đến dư, đầu tiên dung dịch xuất hiện kết tủa trắng, lượng kết tủa tăng dần, sau đó lượng kết tủa giảm dần rồi mất hẳn tạo thành dung dịch trong suốt không màu. PTHH: CO2 + Ca(OH)2 → CaCO3 + H2O CO2 + H2O + CaCO3 → Ca(HCO3)2. |
Câu 5: Chia m gam hỗn hợp gồm Na và Al thành hai phần bằng nhau: Phần 1: cho vào nước thu được dung dịch A, chất rắn B và 9,916 lít H2 (đkc). Phần 2: Cho vào dung dịch NaOH dư thu được dung dịch D và 13,6345 lít H2 (đkc). (Biết các phản ứng xảy ra hoàn toàn) a) Tính m. b) Lấy 350 mL dung dịch HCl xM cho vào A thu được 3a gam kết tủa. Mặt khác cho 500 mL dung dịch HCl xM cho vào dung dịch A thu được 2a gam kết tủa. Tính x và a. Trả lời: a) Phương trình phản ứng Phần 1: 2Na + 2H2O → 2NaOH + H2 (1) x x 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (2) x x x Phần 2: 2Na + 2H2O → 2NaOH + H2 (3) x x 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (4) y Vì thể tích H2 thoát ra ở phần 2 nhiều hơn phần 1 nên ở phản ứng (2) Al dư. Gọi x, y lần lượt là số mol của Na và Al trong một phần: Từ (1), (2), (3), (4) ta có hệ phương trình:
Giá trị của m là: m = 2(0,2.23 + 0,3.27) = 25,4 (gam) b) Dung dịch A chứa 0,2 mol NaAlO2 Khi cho HCl vào dung dịch A thì các phản ứng xảy ra theo thứ tự ưu tiên sau: NaAlO2 + HCl + H2O → Al(OH)3 + NaCl (1) Al(OH)3 + 3HCl → AlCl3 + 3H2O (2) Ta có:
Do khi tăng số mol HCl thì lượng kết tủa giảm nên trong trường hợp (**) đã xảy ra phản ứng (2). TH1: (*) kết tủa chưa bị hòa tan (chưa xẩy ra phản ứng (2): 0,35x Xét ở (*) NaAlO2 + HCl + H2O → Al(OH)3 + NaCl (1) 0,35x 0,35x 0,35x Xét ở (**) NaAlO2 + HCl + H2O → Al(OH)3 + NaCl (1) 0,2 mol 0,2 mol 0,2 mol Al(OH)3 + 3HCl → AlCl3 + 3H2O (2)
Theo bài ra ta có phương trình
TH2: (*) kết tủa bị hòa tan một phần 0,35x > 0,2 ⇒ x > Xét ở (*) NaAlO2 + HCl + H2O → Al(OH)3 + NaCl (1) 0,2 mol 0,2 mol 0,2 mol Al(OH)3 + 3HCl → AlCl3 + 3H2O (2)
Xét ở (**) NaAlO2 + HCl + H2O → Al(OH)3 + NaCl (1) 0,2 mol 0,2 mol 0,2 mol Al(OH)3 + 3HCl → AlCl3 + 3H2O (2)
Theo bài ra ta có phương trình
|
Câu 6: Nêu hiện tượng và viết các phương trình hóa học xảy ra khi cho kim loại Ba (dư) lần lượt vào các dịch: CuSO4, AlCl3, (NH4)2CO3. Trả lời: - Khi cho Ba vào dung dịch CuSO4 đầu tiên thấy có khí không màu thoát ra, sau đó thấy có kết tủa trắng lẫn kết tủa xanh lam xuất hiện: Ba + 2H2O → Ba(OH)2 + H2 Ba(OH)2 + CuSO4 →Cu(OH)2 + BaSO4 - Khi cho Ba (dư) vào dung dịch AlCl3 đầu tiên thấy có khí thoát ra, sau đó có kết tủa trắng xuất hiện, kết tủa trắng tan dần. Ba + 2H2O → Ba(OH)2 + H2 3Ba(OH)2 + 2AlCl3 → 2Al(OH)3 + 3BaCl2 2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O - Khi cho Ba vào dung dịch (NH4)2CO3 đầu tiên thấy có khí thoát ra, sau đó thấy có khí mùi khai thoát ra và kết tủa trắng xuất hiện. Ba + 2H2O → Ba(OH)2 + H2 Ba(OH)2 + (NH4)2CO3 → BaCO3 + 2NH3 + 2H2O |
Câu 7: Hỗn hợp rắn X gồm K, K2O, Al, Al2O3. Hòa tan hoàn toàn m gam X vào nước dư, thu được dung dịch Y (chỉ chứa 1 chất tan duy nhất) và 7,437 lít (đkc) khí H2. Sục CO2 dư vào Y, thu được 23,4 gam kết tủa. Tìm m (biết các phản ứng xảy ra hoàn toàn). Trả lời: Số mol H2 = 0,3 mol, số mol Al(OH)3 = 0,3 mol Theo giả thiết thì trong dung dịch chỉ còn KAlO2, lượng KOH phản ứng vừa hết Gọi x, y, z, t lần lượt là số mol của K, K2O, Al, Al2O3 Các phương trình hóa học: 2K + 2H2O → 2KOH + H2 (1) x x 0,5x mol K2O + H2O → 2KOH (2) y 2y mol 2Al + 2KOH + 2H2O → 2KAlO2 + 3H2 (3) z z z 1,5z mol Al2O3 + 2KOH → 2KAlO2 + H2O (4) t 2t 2t CO2 + KAlO2 + H2O → Al(OH)3 + KHCO3 (5) z + 2t z + 2t mol Ta có: 0,5x + 1,5z = 0,3 ⇒ x + 3z = 0,6 z + 2t = 0,3 ⇒ 3z + 6t = 0,9 (*) z + 2t = x + 2y = 0,3 (**) Cộng (*) với (**)⇒ x + 3z + 2y + 6t = 0,9 + 0,3 = 1,2 ⇒ y + 3t = 0,3 Mặt khác ta có: m = 39x + 94y + 27z + 102t = 39(x + 2y) + 27(z + 2t) + 16(y + 3t) = 39.0,3 + 27.0,3 + 16.0,3 = 24,6 gam. |
Câu 8: Hỗn hợp X gồm Al và Fe. Hòa tan hoàn toàn 3,28 gam X trong 500 mL dung dịch H2SO4 0,5M, thu được dung dịch Y. Thêm 300mL dung dịch KOH 2M vào Y, lọc kết tủa rồi nung trong không khí đến khối lượng không đổi, thu được 1,6 gam chất rắn. Tính % khối lượng các kim loại trong hỗn hợp X (biết các phản ứng xảy ra hoàn toàn). Trả lời: Các phương trình hóa học: Fe + H2SO4 → FeSO4 + H2 (1) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (2) 2KOH + H2SO4 → K2SO4 + 2H2O (3) FeSO4 + 2KOH → Fe(OH)2 + K2SO4 (4) Al2(SO4)3 + 6KOH → 2Al(OH)3 + 3K2SO4 (5) Al(OH)3 + KOH → KAlO2 + 2H2O (6) 4Fe(OH)2 + O2 2Al(OH)3 Ta có số Từ các phản ứng (1) đến (5) ta nhận thấy ⇒ Lượng KOH tham gia phản ứng (6) là 0,1 mol. Gọi x, y lần lượt là số mol Fe và Al ban đầu, TH1: Giả sử lượng Al(OH)3 còn dư sau phản ứng (6). Từ các phản ứng và giả thiết ta có hệ:
⇒ Không có nghiệm thích hợp. TH2: Lượng Al(OH)3 tan hết, kết tủa chỉ còn Fe(OH)2 ⇒ Vậy % khối lượng các kim loại trong hỗn hợp đầu là: % |
Câu 9: Cho hỗn hợp 2 kim loại Fe và Cu tác dụng với khí chlorine dư thu được 59,5 gam hỗn hợp muối. Cùng lượng hỗn hợp trên cho tác dụng với lượng dư dung dịch HCl 10% thu được 25,4 gam một muối. a. Tính khối lượng mỗi muối trong hỗn hợp thu được. b. Tính thể tích dung dịch HCl 10% (D = 1,0 g/ml) đã phản ứng. Trả lời: a) PTHH: 2Fe + 3Cl2 → 2FeCl3 0,2 0,2 mol Cu + Cl2 → CuCl2 Fe + 2HCl → FeCl2 + H2 0,2 0,4 0,2 mol
b) |
Câu 10: Nung hỗn hợp gồm Mg và Al trong bình kín chứa hỗn hợp khí A gồm Cl2 và O2, sau phản ứng chỉ thu được hỗn hợp B gồm các oxit và muối chloride (không còn khí dư). Hòa tan B cần vừa đủ 200 ml dung dịch HCl 0,2M thu được dung dịch D. Cho dung dịch AgNO3 dư vào D, kết thúc phản ứng thu được 11,48 gam kết tủa. Tính thành phần phần trăm theo thể tích các khí trong hỗn hợp A. Trả lời:
Bảo toàn Cl, ta có: ⇒ Vậy ⇒ |
Câu 11: Hòa tan hoàn toàn 12 gam hỗn hợp X gồm Fe và kim loại M có hóa trị (II) trong 175 gam dung dịch HCl 14,6%, thu được 7,437 lít khí H2 (đkc) và dung dịch Y. Mặt khác, khi cho 3,6 gam kim loại M vào 300 mL dung dịch H2SO4 1M thì sau khi phản ứng xảy ra hoàn toàn vẫn còn dư acid. a. Xác định kim loại M. b. Tính nồng độ phần trăm các chất tan trong Y. Trả lời
a. Gọi công thức chung của hai kim loại Fe và M là X ta có: X + 2HCl → XCl2 + H2 0,3 0,6 0,3 mol
Mặt khác: M + H2SO4 → MSO4 + H2
Từ (*) và (**) suy ra M là Mg (24) b. Gọi số mol Mg, Fe trong 12 gam X lần lượt là x và y Mg + 2HCl → MgCl2 + H2 x 2x x x (mol) Fe + 2HCl → FeCl2 + H2 y 2y y y (mol) Ta có:
|
Câu 12: Cho hỗn hợp X gồm Mg và Fe vào dung dịch Y gồm Cu(NO3)2 và AgNO3. Lắc đều cho phản ứng xong, thu được hỗn hợp chất rắn Z gồm 3 kim loại và dung dịch T gồm 2 muối. a. Viết phương trình hóa học của các phản ứng xảy ra. b. Trình bày phương pháp hóa học tách riêng từng kim loại ra khỏi hỗn hợp Z. c. Từ dung dịch T, hãy trình bày sơ đồ điều chế riêng từng kim loại mà không làm thay đổi khối lượng của mỗi kim loại so với trong T. Trả lời: a) Chất rắn Z gồm: Ag, Cu, Fe. Dung dịch T gồm: Mg(NO3)2 và Fe(NO3)2 PTHH: Mg + 2AgNO3 → Mg(NO3)2 + 2Ag Mg + Cu(NO3)2 → Mg(NO3)2 + Cu Fe + 2AgNO3 → Fe(NO3)2 + 2Ag Fe + Cu(NO3)2 → Fe(NO3)2 + Cu b) Hòa tan Z bằng dung dịch HCl dư, lọc chất rắn, cho nước lọc rồi cô cạn dung dịch sau đó hòa tan chất rắn đó vào nước, điện phân hoàn toàn dung dịch thu được Fe. PTHH: Fe + 2HCl → FeCl2 + H2 FeCl2 Nung chất rắn lọc được ở trên trong không khí đến khối lượng không đổi rồi hòa tan chất rắn thu được bằng dung dịch HCl dư, lọc chất rắn sấy khô thu được Ag. Cô cạn chất rắn rồi hòa tan vào nước sau đó điện phân hoàn toàn dung dịch thu được Cu. PTHH: 2Cu + O2 CuO + 2HCl → CuCl2 + H2O CuCl2 |
Câu 13: Nung 8,4 gam Fe trong không khí, sau phản ứng thu được m gam chất rắn X gồm Fe, Fe2O3, Fe3O4, FeO. Hoà tan m gam hỗn hợp X vào dung dịch HNO3 đặc nóng dư thu được 2,479 lít khí NO2 (đkc) là sản phẩm khử duy nhất. Giá trị m là bao nhiêu? Trả lời:
Bảo toàn Fe: Bảo toàn N: Bảo toàn H: Bảo toàn khối lượng: m + 63.0,55 = 0,15.242 + 0,1.46 + 18.0,275 ⇒ m = 11,2 gam. |
Câu 14: Lấy một ít bột Fe cho vào dung dịch HCl vừa đủ thu được dung dịch X. Nhỏ từ từ dung dịch NaOH đến dư vào dung dịch X có hiện tượng gì xảy ra? Trả lời: Fe + 2HCl → FeCl2 + H2↑ 2NaOH + FeCl2 → Fe(OH)2 (↓ trắng xanh) + 2NaCl 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 (↓ nâu đỏ). Như vậy khi nhỏ từ từ đến dư NaOH vào dung dịch X (FeCl2) sẽ thu được kết tủa trắng xanh Fe(OH)2, sau đó kết tủa dần chuyển sang màu nâu đỏ do trong không khí Fe(OH)2 bị oxi hóa thành Fe(OH)3. |
Câu 15: Hòa tan hoàn toàn m gam hỗn hợp X gồm Al và Al2O3 bằng 1,4 lít dung dịch HNO3 1M thu được dung dịch Y và 1,7353 lít (đkc) hỗn hợp khí Z gồm N2O và NO nặng 2,52 gam. Cô cạn dung dịch Y được chất rắn T. Nung T đến khối lượng không đổi thu được m + 4,8 gam chất rắn. Mặt khác để tác dụng với các chất trong Y cần tối đa 1,67 lít dung dịch KOH 1M (Các phản ứng xảy ra hoàn toàn). Xác định thành phần % khối lượng Al trong X. Trả lời:
Khi nhiệt phân T đến khối lượng không đổi được Al2O3 ⇒ ⇒ ⇒
Bảo toàn N: = 6x + 2y + 0,7. Bảo toàn H: Bảo toàn khối lượng: 48x + (6x + 2y + 0,7).63 = 3(0,2 + 2x)62 + 80y + 2,52 + ⇒ y = 0,03 (mol).
KOH + HNO3 → KNO3 + H2O 0,7 – 6x – 2.0,03 0,7 – 6x – 2.0,03 KOH + NH4NO3 → KNO3 + NH3 + H2O 0,03 0,03 Al(NO3)3 + 4KOH → 3KNO3 + KAlO2 + 2H2O 0,2 + 2x 4(0,2 + 2x) Ta có phương trình: 0,8 + 8x + 0,03 + 0,7 – 6x – 2.0,03 = 1,67 ⇒ x = 0,1
|

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu