Giáo án điện tử chuyên đề Hoá học 10 cánh diều Bài 1: Liên kết hoá học và hình học phân tử
Tải giáo án điện tử Chuyên đề học tập Hoá học 10 cánh diều Bài 1: Liên kết hoá học và hình học phân tử. Bộ giáo án chuyên đề được thiết kế sinh động, đẹp mắt. Thao tác tải về đơn giản, dễ dàng sử dụng và chỉnh sửa. Thầy, cô kéo xuống để xem chi tiết.
Xem: => Giáo án hóa học 10 cánh diều (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét








Xem toàn bộ: Giáo án điện tử chuyên đề Hoá học 10 cánh diều
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
CHUYÊN ĐỀ 1.
CƠ SỞ HÓA HỌC
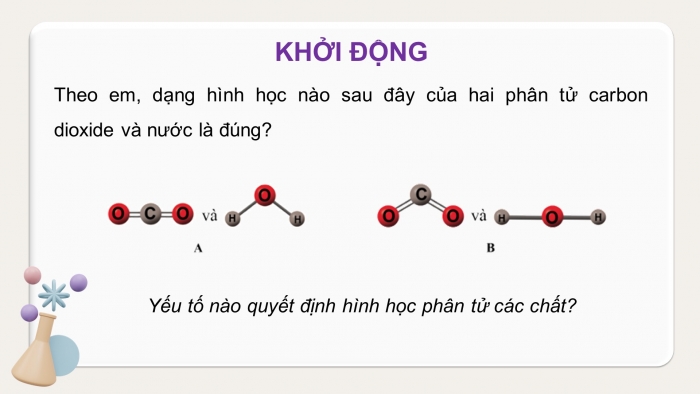
KHỞI ĐỘNG
Theo em, dạng hình học nào sau đây của hai phân tử carbon dioxide và nước là đúng?
Yếu tố nào quyết định hình học phân tử các chất?
BÀI 1. LIÊN KẾT HÓA HỌC VÀ HÌNH HỌC PHÂN TỬ
NỘI DUNG BÀI HỌC
I.
CÔNG THỨC LEWIS VÀ MÔ HÌNH VSEPR
1. Công thức Lewis
HS tìm hiểu nội dung SGK và kiến thức đã học trình bày:
Câu hỏi 1 (SGK-6):
Những electron như thế nào được gọi là:
- Electron hóa trị
- Electron chung
- Electron hóa trị riêng.
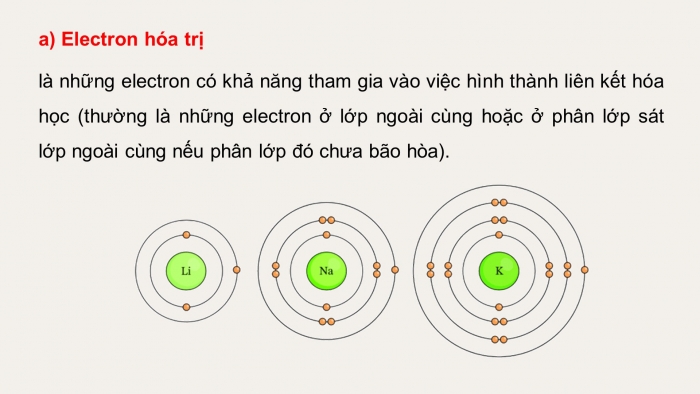
a) Electron hóa trị
là những electron có khả năng tham gia vào việc hình thành liên kết hóa học (thường là những electron ở lớp ngoài cùng hoặc ở phân lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hòa).
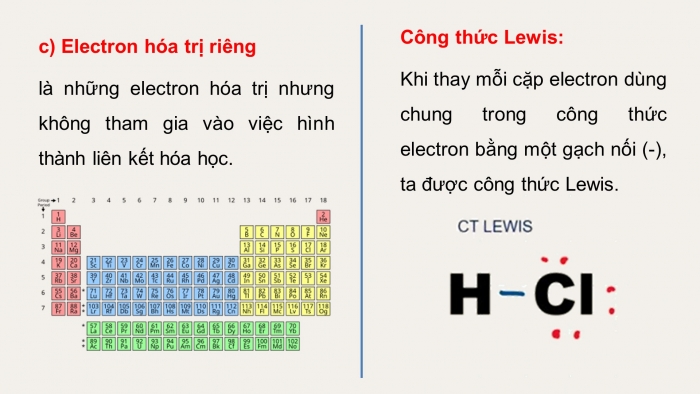
c) Electron hóa trị riêng
là những electron hóa trị nhưng không tham gia vào việc hình thành liên kết hóa học.
Công thức Lewis:
Khi thay mỗi cặp electron dùng chung trong công thức electron bằng một gạch nối (-), ta được công thức Lewis.
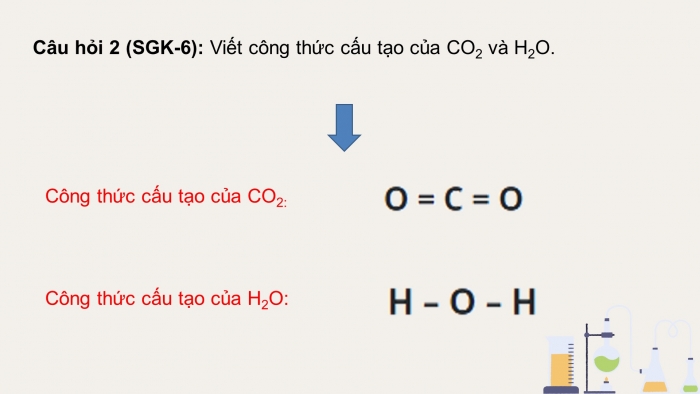
Câu hỏi 2 (SGK-6): Viết công thức cấu tạo của CO2 và H2O.
Công thức cấu tạo của CO2:
Công thức cấu tạo của H2O:
Học sinh đọc Ví dụ 1, cách biểu diễn công thức Lewis của CO2 và H2O.
Câu hỏi: Trình bày sự khác nhau giữa công thức electron và công thức Lewis.
Công thức Lewis thì mỗi cặp electron dùng chung Công thức electron được thay bằng một gạch nối
Các bước cơ bản để xác định công thức Lewis
- Bước 1: Tính tổng số electron hóa trị của phân tử hay ion cần biểu diễn.
- Bước 2: Xác định nguyên tử trung tâm và vẽ sơ đổ khung biểu diễn liên kết giữa nguyên tử trung tâm với các nguyên tử xung quanh qua các liên kết đơn. Nguyên tử trung tâm thường là nguyên tử có độ âm điện nhỏ hơn (ngoại trừ một số trường hợp như Cl2O, Br2O, H2O, NH3, CH4, …)
- Bước 3: Hoàn thiện octet cho các nguyên tử có độ âm điện lớn hơn (trừ hydrogen) trong sơ đồ.
Tính số electron hoá trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết. Nếu electron hoá trị còn dư, đặt số electron hoá trị dư trên nguyên tử trung tâm. Kiểm tra nguyên tử trung tâm đã đạt quy tắc octet chưa. Nếu nguyên tử trung tâm chưa đạt quy tắc octet, chuyển sang Bước 4.
- Bước 4: Chuyển cặp electron chưa liên kết trên nguyên tử xung quanh thành electron liên kết sao cho nguyên tử trung tâm thoả mãn quy tắc octet.
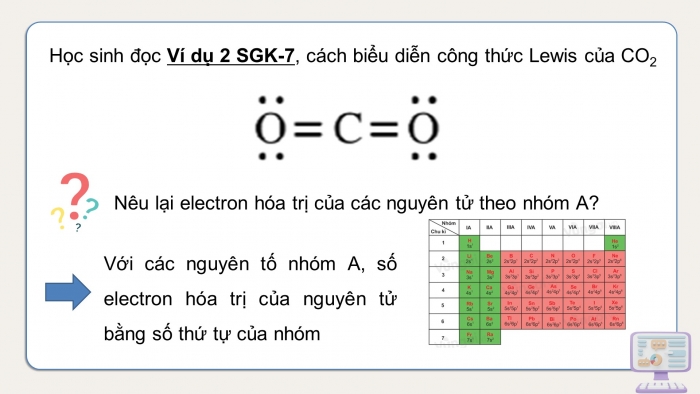
Học sinh đọc Ví dụ 2 SGK-7, cách biểu diễn công thức Lewis của CO2
Nêu lại electron hóa trị của các nguyên tử theo nhóm A?
Với các nguyên tố nhóm A, số electron hóa trị của nguyên tử bằng số thứ tự của nhóm
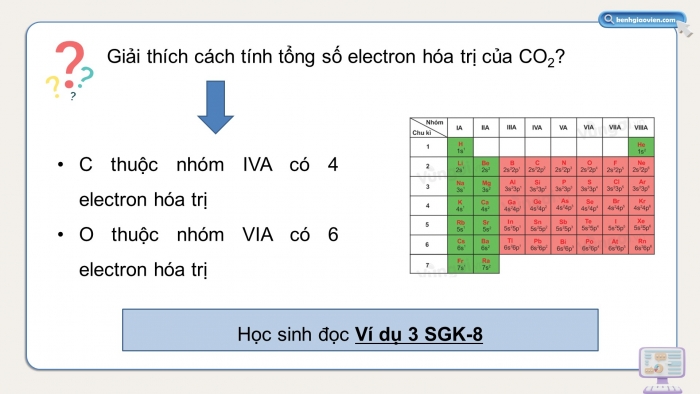
Giải thích cách tính tổng số electron hóa trị của CO2?
- C thuộc nhóm IVA có 4 electron hóa trị
- O thuộc nhóm VIA có 6 electron hóa trị
Học sinh đọc Ví dụ 3 SGK-8
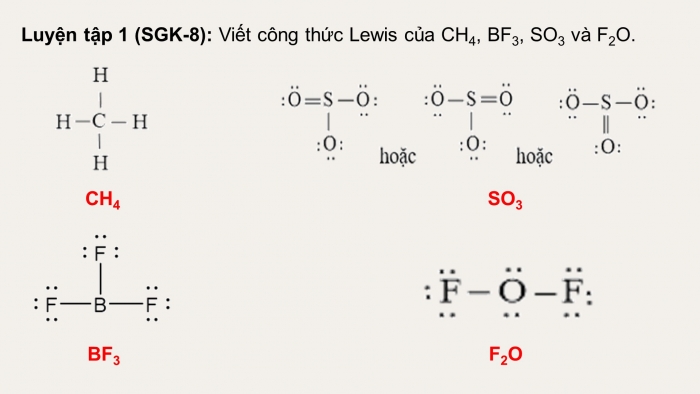
Luyện tập 1 (SGK-8):Viết công thức Lewis của CH4, BF3, SO3 và F2O.
Lưu ý:
Phương pháp xác định cộng thức Lewis nêu trên cũng có những ngoại lệ không phù hợp, chẳng hạn như BeCl2:
Công thức Lewis của BeCl2
2. Mô hình VSEPR
Câu hỏi 3 (SGK-9): Các điện tích cùng dấu thì đẩy nhau hay hút nhau?
Các điện tích cùng dấu thì đẩy nhau.
Mô hình VSEPR:
- Mô hình lực đẩy giữa các cặp electron vỏ hóa trị - VSEPR có thể giúp ta dự đoán hình học của phân tử (đặc trưng bởi cách sắp xếp của các nguyên tử trong không gian).
- Mô hình này dựa trên cơ sở các đám mây electron hóa trị của nguyên tử trung tâm sẽ đẩy nhau tới vị trí xa nhau nhất để lực đẩy giữa chúng nhỏ nhất.
Ví dụ: Nếu xung quanh nguyên tử trung tâm A có 2 đám mây electron hóa trị (kí hiệu là E) thì vị trí của A với 2 đám mây E có dạng thẳng mà không phải dạng góc.
Một đám mây electron hóa trị có thể là một liên kết (đơn, đôi, ba), một cặp electron hóa trị riêng hoặc một electron độc thân.
Bảng 1.1. Dạng hình học phân tử theo VSEPR.
Ví dụ ứng với công thức VSEPR có công thức chung là AE2, AE3, AE4.
- AE2: BeCl2, CO2,…
- AE3: BF3, SO3,…
- AE4: CH4,..
| Công thức VSEPR | Dạng hình học | Ví dụ |
| AX5 | Lưỡng tháp tam giác | PCl5, AsF5,… |
| AX6 | Bát diện | SF6, IF5O |
Luyện tập 2 (SGK-9): Giải thích vì sao khi xung quanh nguyên tử trung tâm có 3 đám mây electron hóa trị E thì 3 đám mây này có xu hướng nằm ở 3 đỉnh của một tam giác phẳng.
Trả lời:
- Xung quanh nguyên tử trung tâm (kí hiệu là A) có 3 đám mây electron hóa trị (kí hiệu là E), thì do lực đẩy giữa 3 đám mây electron (cùng mang điện tích âm) nên 3 đám mây này phải có vị trí sao cho góc hóa trị lớn nhất là 120o.
- Ba đám mây electron được phân bổ trên mặt phẳng hướng về ba đỉnh của tam giác, phân tử có cầu trúc tam giác phẳng.
Học sinh đọc Ví dụ 4, 5 SGK-10
Luyện tập 3 (SGK-10): Viết công thức Lewis, dự đoán dạng hình học của phân tử CH4.
Công thức Lewis của CH4:
--------------- Còn tiếp ---------------
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử chuyên đề Hoá học 10 cánh diều
