Giáo án và PPT đồng bộ Hoá học 10 cánh diều
Hoá học 10 cánh diều. Giáo án word chỉn chu. Giáo án ppt (powerpoint) hấp dẫn, hiện đại. Word và PPT được soạn đồng bộ, thống nhất với nhau. Bộ tài liệu sẽ giúp giáo viên nhẹ nhàng trong giảng dạy. Thầy/cô tham khảo trước để biết chất lượng.
Click vào ảnh dưới đây để xem giáo án rõ





























Một số tài liệu quan tâm khác
Phần trình bày nội dung giáo án
Trường:…………..
Giáo viên:
Bộ môn: Hóa học 10 cánh diều
PHẦN 1: SOẠN GIÁO ÁN WORD HÓA HỌC 10 CÁNH DIỀU
BÀI 6. CẤU TẠO CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
I. MỤC TIÊU:
- Kiến thức: Học xong bài này, HS đạt các yêu cầu sau:
- Nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học.
- Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hóa học và nêu được các khái niệm liên quan: ô, chu kì, nhóm.
- Nêu được nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố hóa học (dựa vào cấu hình electron)
- Phân loại được nguyên tố hóa học (dựa theo cấu hình electron; nguyên tố s, p, d, f; dựa theo tính chất hóa học: kim loại, phi kim, khí hiếm)
- Năng lực
- Năng lực chung:
- Năng lực tự chủ và tự học: Chủ động, tích cực tìm hiểu về cấu tạo bảng tuần hòa các nguyên tố hóa học.
- Năng lực giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học; Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
- Năng lực giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
- Năng lực riêng:
- Năng lực nhận thức hóa học: Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hóa học và nêu được các khái niệm liên quan (ô, chu kì, nhóm); Nêu được nguyên tắc sắp xếp của bảng tuần hoàn (dựa theo cấu hình electron: nguyên tố s, p, d, f; dựa theo tính chất hóa học: Kim loại, phi kim, khí hiếm).
- Tìm hiểu thế giới tự nhiên dưới góc độ hóa học: Nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học.
- Vận dụng kiến thức kĩ năng đã học: Phân loại được nguyên tố (dựa theo cấu hình electron: nguyên tố s, p, d, f; dựa theo tính chất hóa học: Kim loại, phi kim, khí hiếm); Xác định được vị trí của nguyên tố trong bảng tuần hoàn dựa vào cấu hình electron.
- Phẩm chất
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân
- Chăm chỉ tích cực xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo sự hướng dẫn của GV.
- Hình thành tư duy logic, lập luận chặt chẽ, và linh hoạt trong quá trình suy nghĩ.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Đối với GV: SGK, Tài liệu giảng dạy, giáo án PPT.
- Đối với HS: SGK, vở ghi, giấy nháp, đồ dùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm.
III. TIẾN TRÌNH DẠY HỌC
- HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
- a) Mục tiêu:
- HS nhận ra vấn đề và kết nối với bài mới
- Góp phần phát triển các biểu hiện của các năng lực và phẩm chất nhận thức hóa học và các phẩm chất.
- b) Nội dung: HS hoạt động cá nhân, trả lời câu hỏi mở đầu.
- c) Sản phẩm: Câu trả lời của HS cho các câu hỏi.
- d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ
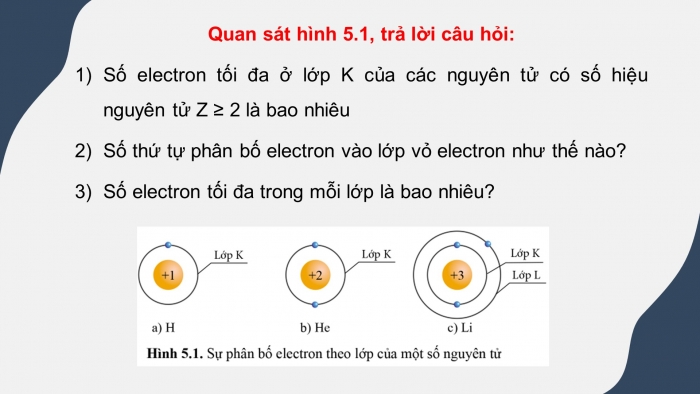
- GV yêu cầu HS trả lời câu hỏi mở đầu: Chi kì 2 gồm các nguyên tố có cùng hai lớp electron. Hỏi các nguyên tố nào sau đây thuộc về chu kì 2: Mg (Z= 12), Li (Z= 15), F (Z=9)?
Bước 2: Thực hiện nhiệm vụ
- HS quan sát và chú ý lắng yêu cầu và đưa ra đáp án.
Bước 3: Báo cáo, thảo luận:
- Các HS xung phong phát biểu trả lời.
Bước 4: Kết luận, nhận xét:
Đáp án: Cấu hình electron của các nguyên tử nguyên tố:
Mg (Z = 12): 1s22s22p63s2
Li (Z = 3): 1s22s1
P (Z = 15): 1s22s22p63s23p3
F (Z = 9): 1s22s22p5
Số thứ tự chu kì = số lớp electron
⇒ Các nguyên tố thuộc chu kì 2 là: Li (Z = 3), F (Z = 9).
- GV nhận xét, đánh giá và dẫn dắt vào bài: Bài 6: Lớp, phân lớp và cấu hình electron.
HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu về lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học.
a) Mục tiêu: Nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hóa học.
b) Nội dung: Học sinh thảo luận nhóm trả lời phiếu học tập và rút ra kiến thức mới.
c) Sản phẩm: Câu trả lời của HS cho những câu hỏi trong phiếu học tập số 1.
d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS | SẢN PHẨM DỰ KIẾN | |
Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS hoạt động nhóm 4, huy động kiến thức kĩ năng đã học và kết hợp thông tin trong sgk, yêu cầu HS thảo luận trả lời phiếu học tập số 1:
Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS thảo luận nhóm suy nghĩ trả lời câu hỏi. Bước 3: Báo cáo, thảo luận: - Đại diện nhóm HS giơ tay phát biểu hoặc lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định: - GV nhận xét kết quả thảo luận nhóm, thái độ làm việc. - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. | I. Lịch sử phát minh (1) D.I.Mendeleev được coi là cha đẻ của bảng tuần hoàn nguyên tố hóa học. Mặc dù trước đó có nhiều nhà khoa học đã nghiên cứu về nó nhưng không ưu việt bằng Mendeleev. (2) - Trả lời câu hỏi 1 sgk trang 32: Mendeleev sắp xếp các nguyên tố theo chiều tăng dần khối lượng nguyên tử và nhận thấy các nguyên tố trong một hàng có tính chất tương tự nhau: dãy halogen (Cl, Br và I), kim loại kiềm (K, Rb, Cs) và kim loại kiềm thổ (Ca, Sr, Ba). - Trả lời câu hỏi 2 sgk trang 32: · Các nguyên tố có tính chất hóa học tương tự nhau được sắp xếp vào cùng một hàng. · Theo hàng dọc, các nguyên tố được sắp xếp theo thứ tự tăng dần khối lượng nguyên tử. (3) Mendeleev đưa ra định luật tuần hoàn: Tính chất của các đơn chất, cấu tạo và tính chất các hợp chất của chúng có tính tuần hoàn theo khối lượng nguyên tử của các nguyên tố (4) Bảng tuần hoàn ngày nay được xây dựng trên cơ sở sử dụng mối liên hệ “số hiệu nguyên tử - tính chất” thay vì mối liên hệ “khối lượng – tính chất”. |
--------------- Còn tiếp ---------------
PHẦN 2: BÀI GIẢNG POWERPOINT HÓA HỌC 10 CÁNH DIỀU
Xin chào các em học sinh! Chào mừng các em đến với bài học mới hôm nay
BÀI 2: THÀNH PHẦN CỦA NGUYÊN TỬ
NỘI DUNG BÀI HỌC
Thành phần và cấu trúc của nguyên tử
Khối lượng và kích thước của nguyên tử
- Thành phần cấu tạo nguyên tử.
- Thành phần nguyên tử.
- Nguyên tử là gì?
- Ba loại hạt cơ bản là những loại hạt nào? Kí hiệu của các loại hạt là gì?
- Nêu đơn vị của khối lượng và điện tích hạt cơ bản.
- Nêu khối lượng và điện tích của các hạt cơ bản.
- Nguyên tử là hạt vô cùng nhỏ bé và trung hòa về điện.
- Ba loại hạt cơ bản là:
- Proton kí hiệu là p
- Neutron kí hiệu là n
- Electron kí hiệu là e.
- Đơn vị của khối lượng nguyên tử là amu
- 1amu = 1,6605.10-27Kg
- Đơn vị của điện tích các hạt cơ bản là e0 (điện tích nguyên tố).
- 1e0 = 1,602.10-19C
Câu 1: Dựa vào Bảng 2.1, em hãy lập luận để chứng minh rằng: Trong một nguyên tử, số proton và số electron luôn bằng nhau.
Câu trả lời:
Các nguyên tử trung hòa về điện.
Mà mỗi proton mang điện tích +1,
Mỗi electron mang điện tích – 1.
Nên số proton và số electron luôn bằng nhau.
Câu hỏi luyện tập 1:
Hạt proton, neutron nặng hơn hạt electron bao nhiêu lần?
Câu trả lời:
Hạt proton, neutron nặng hơn hạt electron số lần là 1 : 0,00055 = 1818 lần.
Câu hỏi luyện tập 2:
Hãy cho biết bao nhiêu hạt proton thì có tổng khối lượng bằng 1 gam.
Câu trả lời:
Số hạt proton để có tổng khối lượng bằng 1 gam là 0.001 : (1,6605.10-27) ≈ 6.1023 (hạt).
--------------- Còn tiếp ---------------
PHẦN 3: TÀI LIỆU THAM KHẢO ĐƯỢC TẶNG KÈM
1. TRỌN BỘ TRẮC NGHIỆM HÓA HỌC 10 CÁNH DIỀU
Bộ trắc nghiệm Hóa học 10 cánh diều tổng hợp câu hỏi 4 mức độ khác nhau: nhận biết, thông hiểu, vận dụng, vận dụng cao
CHỦ ĐỀ 1: CẤU TẠO NGUYÊN TỬ
BÀI 2: NGUYÊN TỐ HÓA HỌC
A. TRẮC NGHIỆM
1. NHẬN BIẾT
Câu 1: Nguyên tố hóa học là
A. tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân.
B. tập hợp những nguyên tử cùng loại, có cùng số nơtron trong hạt nhân.
C. tập hợp những nguyên tử khác loại, có cùng số nơtron trong hạt nhân.
D. tập hợp những nguyên tử khác loại, có số proton luôn nhiều hơn số nơtron trong hạt nhân.
Câu 2: Một nguyên tố hóa học được đặc trưng bởi
A. số nơtron.
B. số electron.
C. số proton.
D. số proton và nơtron.
Câu 3: Các nguyên tử thuộc cùng một nguyên tố hóa học đều có
A. tính chất hóa học giống nhau.
B. cùng số nơtron.
C. tính chất hóa học khác nhau.
D. cùng trọng lượng nguyên tử.
Câu 4: Kí hiệu hóa học của nguyên tố hiđro là
A. N
B. H.
C. C
D. O
Câu 5: Tên nguyên tố hóa học ứng với các kí hiệu O, Al, Fe lần lượt là:
A. oxi, sắt, nhôm.
B. oxi, nhôm, sắt.
C. sắt, kẽm, oxi.
D. kẽm, sắt, oxi.
Câu 6: Kí hiệu hóa học biểu diễn
A. nguyên tố và hai nguyên tử của nguyên tố đó.
B. nguyên tố và số nguyên tử của nguyên tố đó.
C. số hạt proton, nơtron và electron của nguyên tử.
D. nguyên tố và chỉ một nguyên tử của nguyên tố đó.
Câu 7: Phát biểu nào sau đây là đúng?
A. Một đơn vị cacbon bằng 1/10 khối lượng của nguyên tử C.
B. Một đơn vị cacbon bằng 1/15 khối lượng của nguyên tử C.
C. Một đơn vị cacbon bằng 1/12 khối lượng của nguyên tử C.
D. Một đơn vị cacbon bằng 1/20 khối lượng của nguyên tử C.
Câu 8: Nguyên tử khối của nguyên tố oxi là
A. 16.
B. 8.
C. 32.
D. 40.
Câu 9: Nguyên tử nguyên tố X nặng bằng bốn lần nguyên tử oxi. Tên và kí hiệu hóa học của nguyên tố X là
A. Kẽm. Zn.
B. Canxi, Ca.
C. Sắt, Fe.
D. Đồng, Cu.
--------------- Còn tiếp ---------------
2. TRỌN BỘ ĐỀ THI HÓA HỌC 10 CÁNH DIỀU
Bộ đề Hóa học 10 cánh diều biên soạn đầy đủ gồm: đề thi+ đáp án + bảng ma trận và bảng đặc tả
MA TRẬN ĐỀ THI HỌC KÌ 2
MÔN: HÓA HỌC 10 – CÁNH DIỀU
| Số TT | Nội dung kiến thức | Đơn vị kiến thức | Mức độ nhận thức | Tổng số câu | Tổng % điểm | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nhận biết | Thông hiểu | Vận dụng | Vận dụng cao | ||||||||||
| TN | TL | TN | TL | TN | TL | TN | TL | TN | TL | ||||
| 1 | Phản ứng oxi hóa khử | Số oxi hóa | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 1 | 20% |
| Phản ứng oxi hóa – khử | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 2 | ||||
| 2 | Năng lượng hóa học | Phản ứng hóa học và enthalpy | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 15% |
| Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 3 | ||||
| 3 | Tốc độ phản ứng hóa học | Tốc độ phản ứng hóa học | 4 | 0 | 4 | 0 | 0 | 0 | 0 | 0 | 8 | 0 | 20% |
| 4 | Nguyên tố nhóm VIIA | Nguyên tố và đơn chất halogen | 3 | 0 | 2 | 0 | 0 | 1 | 0 | 0 | 5 | 1 | 45% |
| Hydrogen halide và hydrohalic acid | 3 | 0 | 2 | 0 | 0 | 0 | 0 | 1 | 5 | 1 | |||
| Tổng số câu | 16 | 0 | 12 | 0 | 0 | 2 | 0 | 1 | 28 | 3 | |||
| Tỉ lệ % | 40% | 30% | 20% | 10% | |||||||||
| Tỉ lệ chung | 70% | 30% | |||||||||||
BẢNG ĐẶC TẢ KĨ THUẬT ĐỀ THI HỌC KÌ 2
MÔN: HÓA HỌC 10 – CÁNH DIỀU
| TT | Nội dung kiến thức | Đơn vị kiến thức | Mức độ kiến thức, kĩ năng cần kiểm tra, đánh giá | Số câu hỏi theo các mức độ nhận thức | Tổng | |||
| NB | TH | VD | VCD | |||||
| 1 | Phản ứng oxi hóa – khử | Số oxi hóa | Nhận biết: Số oxi hóa của nguyên tố trong đơn chất, hợp chất Thông hiểu: Xác định được số oxi hóa của nguyên tố trong một số hợp chất cụ thể |
1 |
1 |
2 | ||
| Phản ứng oxi hóa – khử | Nhận biết: Khái niệm chất oxi hóa, chất khử, sự oxi hóa, sự khử Thông hiểu: Xác định được chất oxi hóa, chất khử, quá trình oxi hóa, quá trình khử trong phản ứng oxi hóa khử Vận dụng: Lập được phương trình hóa học của một số phản ứng oxi hóa – khử |
1 |
1 |
1 |
3 | |||
| 2 | Năng lượng hóa học | Phản ứng hóa học và enthalpy | Nhận biết: - Dự đoán các phản ứng hóa học là phản ứng tỏa nhiệt hay thu nhiệt - Trình bày được khái niệm phản ứng tỏa nhiệt, thu nhiệt, điều kiện chuẩn Thông hiểu: Đếm số phát biểu đúng sai liên quan đến biến thiên enthalpy |
2 |
1 |
3 | ||
| Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học | Nhận biết: - Nêu được ý nghĩa của dấu và giá trị - Dựa vào nhiệt phản ứng xác định phản ứng là tỏa nhiệt hay thu nhiệt. Thông hiểu: Đếm số phát biểu đúng sai liên quan đến ý nghĩa biến thiên enthalpy |
2 |
1 |
3 | ||||
| 3 | Tốc độ phản ứng hóa học | Tốc độ phản ứng hóa học | Nhận biết: - Trình bày được khái niệm tốc độ phản ứng hóa học và cách tính tốc độ trung bình của phản ứng. - Viết được biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ. - Nêu được ý nghĩa của hệ số nhiệt đới Van’t Hoff ( Thông hiểu: - Giải thích được các yếu tố ảnh hưởng tới tốc độ phản ứng như: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. - Tính được tốc độ trung bình của một phản ứng hóa học - Vận dụng được kiến thức tốc độ phản ứng hóa học vào việc giải thích một số vấn đề trong cuộc sống và sản xuất. |
4 |
4 |
8 | ||
| 4 | Nguyên tố nhóm VIIA | Nguyên tố và đơn chất halogen | Nhận biết: - Phát biểu được trạng thái tự nhiên của các nguyên tố halogen - Chỉ ra được trạng thái, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen. - Chỉ ra được hiện tượng của các thí nghiệm so sánh tính oxi hóa của các halogen Thông hiểu - Viết sản phẩm phản ứng thể hiện tính chất của đơn chất halogen - Tính thể tích khí chlorine (ở đktc) tạo thành trong phản ứng đơn giản - So sánh được tính oxi hóa giữa các halogen Vận dụng: Bài tập liên quan đến tính chất hóa học của các đơn chất halogen |
3 |
2 |
1
|
6 | |
| Hydrogen halide và hydrohalic acid | Nhận biết: - Trình bày được xu hướng biến đổi tính acid của dãy hydrohalic acid. - Chỉ ra được hiện tượng của phản ứng khi cho dung dịch AgNO3 tác dụng với ion X- - Nêu được ứng dụng của một số hydrogen halide Thông hiểu: - Tính được khối lượng kim loại trong phản ứng đơn giản có HCl tham gia - Viết được PTHH thể hiện tính chất hóa học của các acid HX. Vận dụng cao: Vận dụng giải bài tập liên quan đến hydrohalic acid, ion halide X |
3 |
2 |
|
1 |
6 | ||
| Tổng | 16 | 12 | 2 | 1 | 31 | |||
| Tỉ lệ % từng mức độ nhận thức | 40% | 30% | 20% | 10% | 100% | |||
| Tỉ lệ chung | 70% | 30% | ||||||
ĐỀ KIỂM TRA HỌC KÌ 2
MÔN: HÓA HỌC 10 – CÁNH DIỀU
Phần I: Trắc nghiệm (7 điểm)
Câu 1. Số oxi hóa của carbon trong hợp chất CO là
A. +1
B. – 1
C. +2
D. – 2
Câu 2. Cho các chất và ion sau: NH3; NO; Ca(NO3)2; ![]() ; (NH4)2SO4; N2O3. Số trường hợp trong đó nitrogen có số oxi hóa – 3 là
; (NH4)2SO4; N2O3. Số trường hợp trong đó nitrogen có số oxi hóa – 3 là
A. 4
B. 3
C. 2
D. 1
Câu 3. Cho các phát biểu sau:
(s) Sự oxi hóa là sự nhường electron hay sự làm tăng số oxi hóa
(b) Trong quá trình oxi hóa, chất khử nhận electron
(c) Sự khử là sự nhận electron hay là sự làm giảm số oxi hóa
(d) Trong quá trình khử, chất oxi hóa nhường electron
Số phát biểu đúng là
A. 4
B. 1
C. 2
D. 3
Câu 4. Cho phản ứng sau: 2Fe + 6H2SO4 ![]() Fe2(SO4)3 + 3SO2 + 6H2O. Vai trò của H2SO4 trong phản ứng là
Fe2(SO4)3 + 3SO2 + 6H2O. Vai trò của H2SO4 trong phản ứng là
A. chất khử
B. chất oxi hóa
C. chất tạo môi trường
D. vừa là chất oxi hóa, vừa là chất tạo môi trường phản ứng
Câu 5. Cho các phản ứng hóa học sau:
(1) Phản ứng đốt cháy hydrogen: 2H2(g) + O2(g) ![]() 2H2O(l)
2H2O(l)
(2) Phản ứng nung vôi: CaCO3(s) ![]() CaO(s) + CO2(g)
CaO(s) + CO2(g)
Nhận xét nào sau đây là đúng?
A. Phản ứng (1) thu nhiệt, phản ứng (2) tỏa nhiệt
B. Cả hai phản ứng đều tỏa nhiệt
C. Phản ứng (1) tỏa nhiệt, phản ứng (2) thu nhiệt
D. Cả hai phản ứng đều thu nhiệt
Câu 6. Enthalpy tạo thành chuẩn của một chất hóa học được kí hiệu là
A. ![]()
B. ![]()
C. ![]()
D. ![]()
Câu 7. Cho các phát biểu sau:
(a) Biến thiên enthalpy chuẩn của một phản ứng hóa học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và 25oC
(b) Nhiệt (tỏa ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó
(c) Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên và phản ứng thu nhiệt
(d) Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường
Số phát biểu đúng là
A. 4
B. 1
C. 3
D. 2
--------------- Còn tiếp ---------------

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
=> Giáo án hóa học 10 cánh diều (bản word)
Từ khóa: Giáo án và PPT đồng bộ Hoá học 10 cánh diều, soạn giáo án word và powerpoint Hoá học 10 cánh diều, soạn Hoá học 10 cánh diềuTài liệu giảng dạy môn Hóa học THPT
