Đề kiểm tra 15 phút Hoá học 10 cánh diều (có đáp án)
Tổng hợp trọn bộ đề kiểm tra 15 phút Hoá học 10 bộ sách mới Cánh diều. Bộ đề kiểm tra 15 phút bao gồm: đề kiểm tra trắc nghiệm, đề kiểm tra tự luận, đề kiểm tra trắc nghiệm + tự luận. Tài liệu có đáp án kèm theo và file word tải về chỉnh sửa được. Hi vọng bộ đề kiểm tra Hoá học 10 cánh diều này giúp ích được cho thầy cô để ôn tập và đánh giá năng lực học sinh.
Click vào ảnh dưới đây để xem giáo án rõ







Một số tài liệu quan tâm khác
Phần trình bày nội dung giáo án
ĐỀ KIỂM TRA 15 PHÚT – BÀI 13: PHẢN ỨNG OXI HÓA – KHỬ
I. DẠNG 1 – ĐỀ KIỂM TRA TRẮC NGHIỆM
ĐỀ 1
(Chọn chữ cái trước câu trả lời đúng nhất.)
Câu 1: Phát biểu nào sau đây là đúng?
- Số oxi hoá của nguyên tử trong bất kì một đơn chất hoá học nào đều bằng 0.
- Tổng số oxi hoá của tất cả các nguyên tử trong một phân tử và trong một ion đa nguyên tử bằng 0.
- Trong tất cả các hợp chất, hydrogen luôn có số oxi hoá là +1.
- Trong tất cả các hợp chất, oxygen luôn có số oxi hoá là -2.
Câu 2: Phát biểu nào sau đây không đúng?
- Số oxi hoá của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử đó với giả thiết đó là hợp chất ion.
- Trong hợp chất, oxygen có số oxi hoá bằng -2, trừ một số trường hợp ngoại lệ.
- Số oxi hoá của hydrogen trong các hydride kim loại bằng +1.
- Các nguyên tố phi kim có số oxi hoá thay đổi tuỳ thuộc vào hợp chất chứa chúng.
Câu 3: Số oxi hoá của chromium (Cr) trong Na2CrO4 là
- -2.
- +2.
- +6.
- -6.
Câu 4: Số oxi hoá của carbon và oxygen trong C2O42- lần lượt là:
- +3, -2.
- +4, -2.
- +1, -3.
- +3, -6.
Câu 5: Ghép phân tử/ ion ở cột A với nhóm số oxi hoá của các nguyên tử trong phân tử/ ion ở cột B cho phù hợp.
|
Cột A |
Cột B |
|
Phân tử/ion
|
Số oxi hoá của các nguyên tử trong phân tử/ion (lần lượt theo thự tự như trong phân tử/ion |
|
a) SbCl5 |
1. (-3; +1) |
|
b) BrO3- |
2. (+5; -1) |
|
c) Na2O2 |
3. (+1; -2) |
|
d) Na2S |
4. (+1; -1) |
|
e) NH4+ |
5. (+5; -2) |
|
|
6. (-1; +2) |
- a - 5; b - 3; c - 4; d - 3; e - 1
- a - 3; b - 1; c - 5; d - 2; e - 4
- a - 2; b - 5; c - 4; d - 3; e - 1
- a - 1; b - 4; c - 5; d - 2; e - 3
Câu 6: Điền vào chỗ trống (1) trong đoạn thông tin sau:
Phản ứng Fe2O3 + CO → Fe + CO2 xảy ra trong quá trình luyện gang từ quặng hemantite là phản ứng …. (1) … vì có sự thay đổi … (2) … của các nguyên tố Fe và C. CO là … (3)…, trong đó C2+ nhường electron và Fe2O3 là … (4)…, trong đó mỗi Fe3+ nhận 3 electron.
- oxi hóa – khử
- Số oxi hóa
- Chất khử
- Chất oxi hóa
Câu 7: Điền vào chỗ trống (2) trong đoạn thông tin sau:
Phản ứng Fe2O3 + CO → Fe + CO2 xảy ra trong quá trình luyện gang từ quặng hemantite là phản ứng …. (1) … vì có sự thay đổi … (2) … của các nguyên tố Fe và C. CO là … (3)…, trong đó C2+ nhường electron và Fe2O3 là … (4)…, trong đó mỗi Fe3+ nhận 3 electron.
- oxi hóa – khử
- Số oxi hóa
- Chất khử
- Chất oxi hóa
Câu 8: Trong công nghiệp, sulfuric acid được sản xuất từ quặng pirite sắt có thành phần chính là FeS2, theo sơ đồ sau: FeS2 → SO2 → SO3 → H2SO4
Tính khối lượng H2SO4 98% điều chế được từ 1 tấn quặng chứa 60% FeS2. Biết hiệu suất cả quá trình là 80%.
- 0,8 tấn
- 0,23 tấn
- 0,6 tấn
- 0,78 tấn
Câu 9: Một số loại xe ô tô được trang bị một thiết bị an toàn là túi chứa một lượng nhất định hợp chất ion sodium azide (NaN3), được gọi là "túi khí". Khi có va chạm mạnh xảy ra, sodium azide bị phân huỷ rất nhanh, giải phóng khí N2 và nguyên tố Na, làm túi phồng lên, bảo vệ được người trong xe tránh khỏi thương tích. Xác định sự thay đổi số oxi hoá của nguyên tử Na trong trong phương trình hóa học của phản ứng.
- Giảm từ +1 xuống 0
- Tăng từ -1 lên 0
- Giảm từ +3 xuống 0
- Tăng từ 0 lên +1
Câu 10: Một số loại xe ô tô được trang bị một thiết bị an toàn là túi chứa một lượng nhất định hợp chất ion sodium azide (NaN3), được gọi là "túi khí". Khi có va chạm mạnh xảy ra, sodium azide bị phân huỷ rất nhanh, giải phóng khí N2 và nguyên tố Na, làm túi phồng lên, bảo vệ được người trong xe tránh khỏi thương tích. Xác định sự thay đổi số oxi hoá của nguyên tử N trong trong phương trình hóa học của phản ứng.
- Giảm từ +1 xuống 0
- Tăng từ - lên 0
- Tăng từ -3 lên 0
- Giảm từ +3 xuống 0
GỢI Ý ĐÁP ÁN
(Mỗi câu đúng tương ứng với 1 điểm)
|
Câu hỏi |
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
|
Đáp án |
C |
D |
D |
A |
C |
|
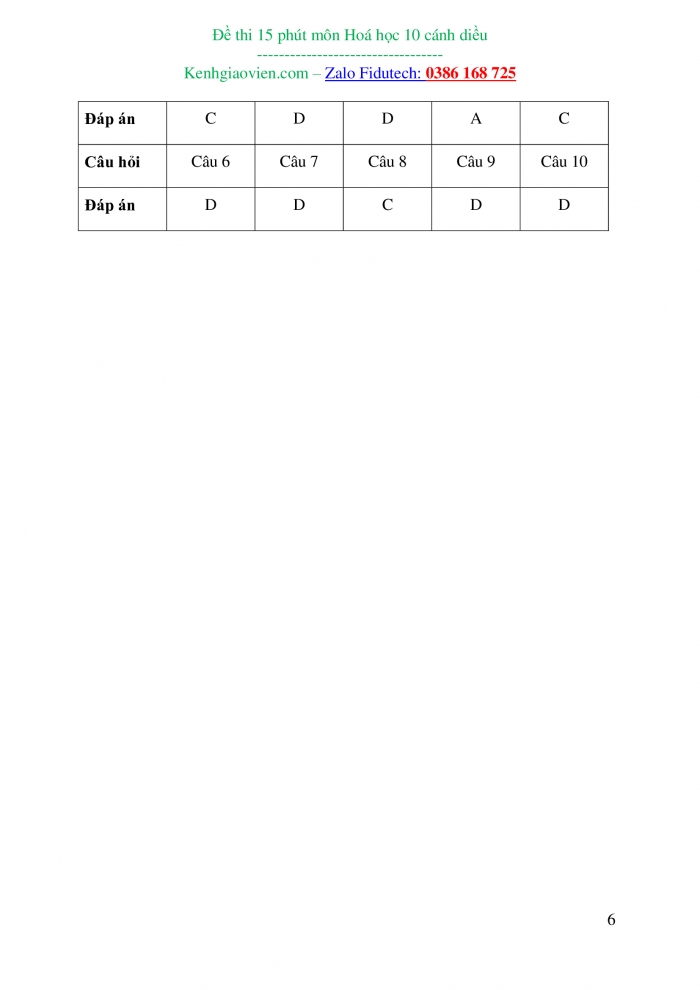
Câu hỏi |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
Đáp án |
D |
D |
C |
D |
D |
ĐỀ 2
(Chọn chữ cái trước câu trả lời đúng nhất.)
Câu 1: Số oxi hoá của Cl trong các chất NaOCl, NaClO2, NaClO3, NaClO4 lần lượt là:
- -1, +3, +5, +7.
- +1, -3, +5, -2.
- +1, +3, +5, +7.
- +1, +3, -5, +7.
Câu 2: Số oxi hoá của nitrogen và oxygen trong NO3- lần lượt là:
- +5, -2.
- +4, -2.
- -3, -3.
- +3, -6.
Câu 3: Những phát biểu nào sau đây sai?
- Sự oxi hoá là sự nhường electron hay sự làm tăng số oxi hoá.
- Trong quá trình oxi hoá, chất khử nhận electron.
- Trong quá trình khử, chất oxi hoá nhận electron và bị khử xuống số oxi hoá thấp hơn.
- Trong quá trình oxi hoá, chất khử nhường electron và bị oxi hoá lên số oxi hoá cao hơn.
Câu 4: Những phát biểu nào sau đây đúng?
- Chất khử (chất bị oxi hoá) là chất nhường electron và chất oxi hoá (chất bị khử) là chất nhận electron.
- Quá trình nhường electron là quá trình khử và quá trình nhận electron là quá trình oxi hoá.
- Trong quá trình oxi hoá, chất oxi hoá bị oxi hoá lên số oxi hoá cao hơn.
- Trong quá trình khử, chất khử bị khử xuống số oxi hoá thấp hơn.
Câu 5: Điền vào chỗ trống (3) trong đoạn thông tin sau:
Phản ứng Fe2O3 + CO → Fe + CO2 xảy ra trong quá trình luyện gang từ quặng hemantite là phản ứng …. (1) … vì có sự thay đổi … (2) … của các nguyên tố Fe và C. CO là … (3)…, trong đó C2+ nhường electron và Fe2O3 là … (4)…, trong đó mỗi Fe3+ nhận 3 electron.
- oxi hóa – khử
- Số oxi hóa
- Chất khử
- Chất oxi hóa
Câu 6: Điền vào chỗ trống (4) trong đoạn thông tin sau:
Phản ứng Fe2O3 + CO → Fe + CO2 xảy ra trong quá trình luyện gang từ quặng hemantite là phản ứng …. (1) … vì có sự thay đổi … (2) … của các nguyên tố Fe và C. CO là … (3)…, trong đó C2+ nhường electron và Fe2O3 là … (4)…, trong đó mỗi Fe3+ nhận 3 electron.
- oxi hóa – khử
- Số oxi hóa
- Chất khử
- Chất oxi hóa
Câu 7: Trong công nghiệp, sulfuric acid được sản xuất từ quặng pirite sắt có thành phần chính là FeS2, theo sơ đồ sau: FeS2 SO2 SO3 H2SO4
Trong sơ đồ trên, những phản ứng nào là phản ứng oxi hoá - khử?
- Phản ứng (1)
- Phản ứng (2)
- Phản ứng (3)
- Phản ứng (1) và (2)
Câu 8: Phản ứng oxi hóa - tự khử là phản ứng oxi hoá - khử trong đó nguyên tử nhường và nhận electron thuộc cùng một nguyên tố, có cùng số oxi hóa ban đầu và thuộc cùng một chất. Trong các phản ứng sau đây, phản ứng nào là phản ứng oxi hóa - tự khử?
- 3Cl + 3Fe2 3FeCl2
- CH4+ 2O2 CO2 + 2H2O
- NH4NO3 N2 + 2H2O
- Cl2+ 6KOH KClO3 + 5KCl + 3H2O
Câu 9: Cần bao nhiêu gam Cu tác dụng vừa đủ với 100ml dung dịch AgNO3 0,2M theo phương trình hóa học sau đây?
2AgNO= + Cu 2Ag + Cu(NO3)2
- 1,28 g
- 0,64 g
- 0,32 g
- 2,56 g
Câu 10: Cho phản ứng sau: Na2SO3 + KMnO4 + X → Na2SO4 + MnO2 + KOH.
Chất X là
- H2SO4
- HCl
- NaOH
- H2O
GỢI Ý ĐÁP ÁN
(Mỗi câu đúng tương ứng với 1 điểm)
|
Câu hỏi |
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
|
Đáp án |
C |
A |
B |
A |
C |
|
Câu hỏi |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
Đáp án |
D |
D |
D |
B |
D |
II. DẠNG 2 – ĐỀ KIỂM TRA TỰ LUẬN
ĐỀ 1
Câu 1 (4 điểm). Xác định số oxi hóa của các nguyên tố trong phân tử và ion sau:
- Fe(NO3)3, NH4NO3, NxOy
- H2S, S, SO2, SO3, H2SO4, Na2SO4, H2S2O7, FeS, FeS2
Câu 2 (6 điểm). Để m gam phôi bào ion (A) ngoài không khí sau một thời gian biến thành hỗn hợp( B) có khối lượng 30 gam gồm Fe và các oxide FeO, Fe3O4, Fe2O3. Cho b tác dụng hoàn toàn nitric acid dư thấy giải phóng ra 5,6 lít khí NO duy nhất (đktc). Tính m.
GỢI Ý ĐÁP ÁN:
|
Câu |
Nội dung |
Biểu điểm |
|
Câu 1 (4 điểm) |
|
2 điểm 2 điểm |
|
Câu 2 (6 điểm) |
Quy đổi hỗn hợp B thành Fe ( x mol) và O (y mol) Số mol NO :
|
1 điểm 1 điểm
1 điểm
1 điểm 1 điểm 1 điểm |
ĐỀ 2
Câu 1 (6 điểm). Lập phương trình phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử trong mỗi trường hợp:
- FeO + HNO3→ Fe(NO3) + NO2+ H2O
- MnO2+ HCl → MnCl2+ Cl2+ H2O
- Al+ Fe3O4→ Al2O3+ Fe
Câu 2 (4 điểm). Xác định số oxi hóa của các ion sau: CO32−, ClO4−, MNO4−, Cr2O72−
GỢI Ý ĐÁP ÁN:
|
Câu |
Nội dung |
Biểu điểm |
|
Câu 1 (6 điểm) |
|
2 điểm
2 điểm
2 điểm |
|
Câu 2 (4 điểm) |
|
1 điểm 1 điểm 1 điểm 1 điểm |
III. DẠNG 3 – ĐỀ TRẮC NGHIỆM VÀ TỰ LUẬN
ĐỀ 1
- Phần trắc nghiệm (4 điểm)
(Chọn chữ cái trước câu trả lời đúng nhất.)
Câu 1: Hãy xác định chất bị khử, chất bị oxi hóa trong các phản ứng hóa học sau 2HNO3 + 3H3AsO3 → 2NO + 3H3AsO4 + H2O
- Chất bị oxi hóa: H3AsO3; chất bị khử: HNO3.
- Chất bị oxi hóa: HNO3; chất bị khử: H3AsO3.
- Chất bị oxi hóa: NO; chất bị khử: H3AsO4.
- Chất bị oxi hóa: H3AsO4; chất bị khử: NO.
Câu 2: Hãy xác định chất bị khử, chất bị oxi hóa trong các phản ứng hóa học sau
NaI + 3HOCl → NaIO3 + 3HCl
- Chất bị oxi hóa: HOCl; chất bị khử: NaI
- Chất bị oxi hóa: NaI; chất bị khử: HOCl
- Chất bị oxi hóa: NaIO3; chất bị khử: HCl
- Chất bị oxi hóa: HCl; chất bị khử: NaIO3
Câu 3: Hãy xác định chất bị khử, chất bị oxi hóa trong các phản ứng hóa học sau
2KMnO4 + 5H2C2O4 + 3H2SO4 → 10CO2 + K2SO4 + 2MnSO4 + 8H2O
- Chất bị oxi hóa: H2C2O4; chất bị khử: K2SO4.
- Chất bị oxi hóa: H2SO4; chất bị khử: KMnO4.
- Chất bị oxi hóa: KMnO4; chất bị khử: H2C2O4.
- Chất bị oxi hóa: H2C2O4; chất bị khử: KMnO4.
Câu 4: Nước oxy già có tính oxi hóa mạnh, do khả năng oxi hóa của hydrogen peroxide (H2O2). Nguyên tử nguyên tố nào gây nên tính oxi hóa của H2O2.
- O
- H
- Cả H và O
- Không do nguyên tử nguyên tố nào
- Phần tự luận (6 điểm)
Câu 1 (2 điểm). Trong phản ứng oxi hóa - khử, chất khử là gì?
Câu 2 (4 điểm). Trong phản ứng hóa hóa học: Fe + H2SO4 →FeSO4 + H2, Fe đóng vai trò là chất khử hay oxi hóa.
GỢI Ý ĐÁP ÁN:
Trắc nghiệm: (Mỗi câu đúng tương ứng với 1 điểm)
|
Câu hỏi |
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
|
Đáp án |
A |
B |
D |
A |
Tự luận:
|
Câu |
Nội dung |
Biểu điểm |
|
Câu 1 (2 điểm) |
Chất khử là chất nhận electron. |
2 điểm |
|
Câu 2 (4 điểm) |
Fe có vai trò là chất khử vì số oxi hóa giảm. |
2 điểm 2 điểm |
ĐỀ 2
- Phần trắc nghiệm (4 điểm)
(Chọn chữ cái trước câu trả lời đúng nhất.)
Câu 1: Cho các hợp chất sau: NH3, NH4Cl, HNO3, NO2. Số hợp chất chứa nguyên tử nitrogen có số oxi hoá - 3 là
A.1.
B.3.
C.2.
D.4.
Câu 2: Nguyên tử sulfur chỉ thể hiện tính khử trong chất nào sau đây?
- S.
- SO2.
- H2SO4.
- H2S.
Câu 3: Nguyên tử carbon vừa có khả năng thể hiện tính oxi hoá, vừa có khả năng thể hiện tính khử trong chất nào sau đây?
- C.
- CO2.
- CaCO3.
- CH4.
Câu 4: Hợp chất nào sau đây chứa hai loại nguyên tử iron với số oxi hoá +2 và +3?
- FeO.
- Fe3O4.
- Fe(OH)3.
- Fe2O3.
- Phần tự luận (6 điểm)
Câu 1 (2 điểm). Tổng số oxi hóa trong một phân tử bằng bao nhiêu?
Câu 2 (4 điểm). Trong phản ứng Cl2 (r) +2 KBr (dd) → Br2 (1) + 2 KCl (dd), Cl đóng vai trò là chất oxi hóa hay chất khử? Giải thích.
GỢI Ý ĐÁP ÁN:
Trắc nghiệm: (Mỗi câu đúng tương ứng với 1 điểm)
|
Câu hỏi |
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
|
Đáp án |
C |
D |
A |
D |
Tự luận:
|
Câu |
Nội dung |
Biểu điểm |
|
Câu 1 (2 điểm) |
Tổng số oxi hóa trong một phân tử bằng 0. |
2 điểm |
|
Câu 2 (4 điểm) |
- Trong phản ứng trên Cl đóng vai trò là chất khử. - Vì Cl có số oxi hóa giảm nên nó là chất khử (từ 0 xuống -1) |
2 điểm
2 điểm |

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
=> Giáo án hóa học 10 cánh diều (bản word)
Từ khóa: Đề kiểm tra hoá học 10 cánh diều, đề kiểm tra 15 phút bộ hoá học 10 cánh diều, bộ đề trắc nghiệm tự luận hoá học 10 cánh diềuGIÁO ÁN WORD LỚP 10 - SÁCH CÁNH DIỀU
GIÁO ÁN POWERPOINT LỚP 10 - SÁCH CÁNH DIỀU
GIÁO ÁN CHUYÊN ĐỀ LỚP 10 - SÁCH CÁNH DIỀU
GIÁO ÁN LỚP 10 CÁC BỘ SÁCH KHÁC
Giáo án lớp 10 sách chân trời sáng tạo (bản word)
Giáo án lớp 10 sách chân trời sáng tạo (bản powrerpoint)
Giáo án lớp 10 sách kết nối tri thức (bản word)
Giáo án lớp 10 sách kết nối tri thức (bản powrerpoint)
Cách đặt mua:
Liên hệ Zalo: Fidutech - Nhấn vào đây
