Giáo án điện tử chuyên đề Hoá học 10 chân trời Bài 1: Liên kết hoá học
Tải giáo án điện tử Chuyên đề học tập Hoá học 10 chân trời sáng tạo Bài 1: Liên kết hoá học. Bộ giáo án chuyên đề được thiết kế sinh động, đẹp mắt. Thao tác tải về đơn giản, dễ dàng sử dụng và chỉnh sửa. Thầy, cô kéo xuống để xem chi tiết.
Xem: => Giáo án hóa học 10 chân trời sáng tạo (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét








Xem toàn bộ: Giáo án điện tử chuyên đề Hoá học 10 chân trời sáng tạo
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
CHUYÊN ĐỀ 1.
CƠ SỞ HÓA HỌC
KHỞI ĐỘNG
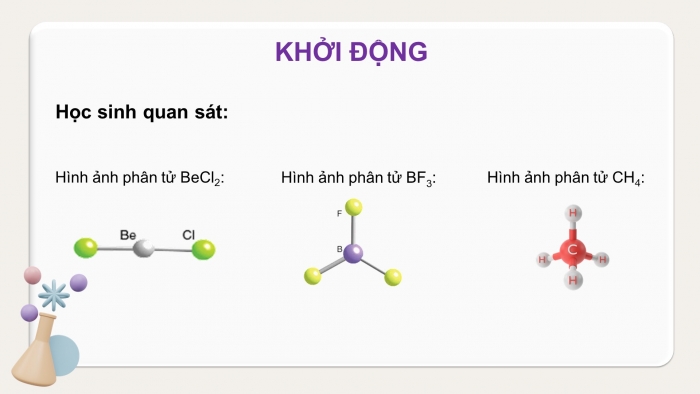
Hình ảnh phân tử BeCl2:
Hình ảnh phân tử BF3:
Hình ảnh phân tử CH4:
Học sinh quan sát:
- Hình học phân tử (hình dạng phân tử) của một chất rất quan trọng trong việc xác định cách thức phân tử chất đó tương tác và phản ứng với các phân tử chất khác.
- Hình học phân tử cũng ảnh hưởng đến nhiệt độ sôi và nhiệt độ nóng chảy của chất. Nhiều đặc tính của chất được giải thích từ dữ liệu hình học phân tử của nó.
Yếu tố nào quyết định hình học phân tử các chất?
BÀI 1. LIÊN KẾT
HÓA HỌC
I. Công thức Lewis
NỘI DUNG BÀI HỌC
II. Hình học một số phân tử
III. Sự lai hóa orbital nguyên tử
I.
CÔNG THỨC LEWIS
a) Tìm hiểu công thức electron và công thức theo Lewis
HS tìm hiểu nội dung SGK và kiến thức đã học trình bày:
- Thế nào là công thức Lewis?
- Trình bày sự khác nhau giữa công thức electron và công thức Lewis?
Công thức electron
Khi biểu diễn liên kết giữa các nguyên tử bằng một hay nhiều cặp electron dùng chung, ta được công thức electron.
Công thức Lewis:
Khi thay mỗi cặp electron dùng chung trong công thức electron bằng một gạch nối (-), ta được công thức Lewis.
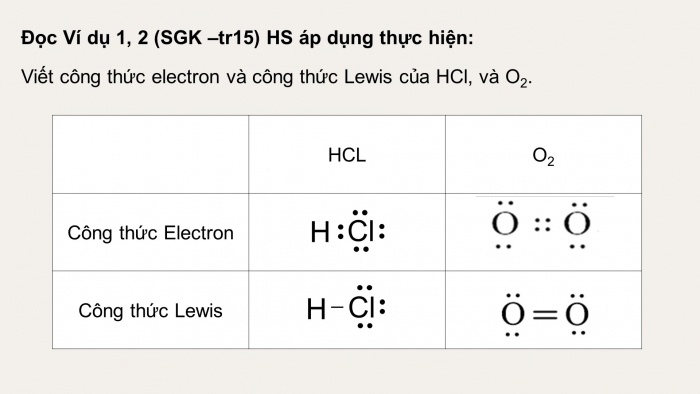
Đọc Ví dụ 1, 2 (SGK –tr15) HS áp dụng thực hiện:
Viết công thức electron và công thức Lewis của HCl, và O2.
| HCL | O2 | |
| Công thức Electron | ||
| Công thức Lewis |
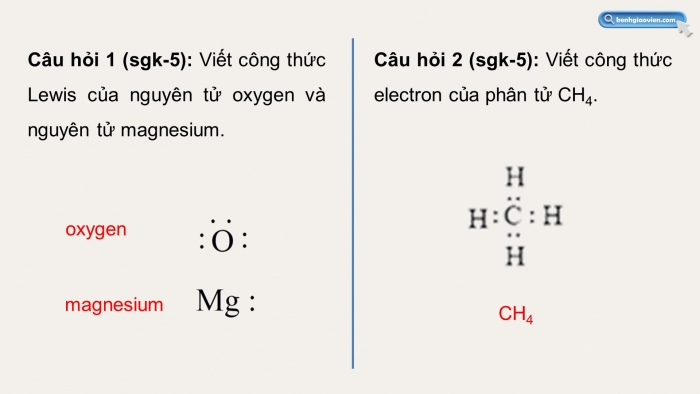
Câu hỏi 1 (sgk-5): Viết công thức Lewis của nguyên tử oxygen và nguyên tử magnesium.
oxygen
magnesium
Câu hỏi 2 (sgk-5): Viết công thức electron của phân tử CH4.
CH4
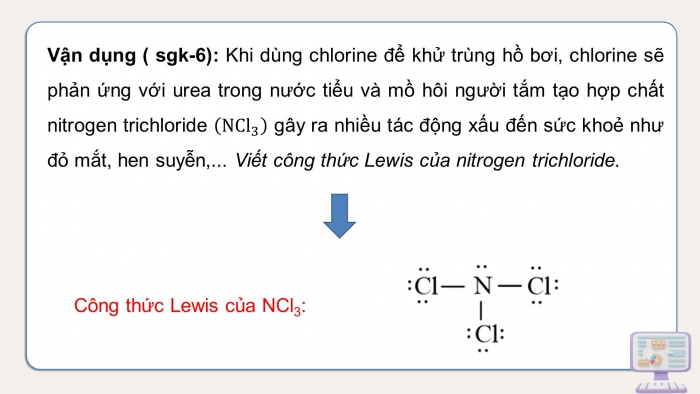
Công thức Lewis của NCl3:
b) Tìm hiểu quy tắc viết công thức Lewis của một phân tử hay ion
Học sinh đọc các để viết công thức Lewis SGK-6
Bước 1: Tính tổng số electron hóa trị của phân tử hay ion cần biểu diễn.
Bước 2: Xác định nguyên tử trung tâm và vẽ sơ đổ khung biểu diễn liên kết giữa nguyên tử trung tâm với các nguyên tử xung quanh qua các liên kết đơn. Nguyên tử trung tâm thường là nguyên tử có độ âm điện nhỏ hơn (ngoại trừ một số trường hợp như Cl2O, Br2O, H2O, NH3, CH4, …)
Bước 3: Hoàn thiện octet cho các nguyên tử có độ âm điện lớn hơn (trừ hydrogen) trong sơ đồ.
Tính số electron hoá trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết. Nếu electron hoá trị còn dư, đặt số electron hoá trị dư trên nguyên tử trung tâm. Kiểm tra nguyên tử trung tâm đã đạt quy tắc octet chưa. Nếu nguyên tử trung tâm chưa đạt quy tắc octet, chuyển sang Bước 4.
Bước 4: Chuyển cặp electron chưa liên kết trên nguyên tử xung quanh thành electron liên kết sao cho nguyên tử trung tâm thoả mãn quy tắc octet.
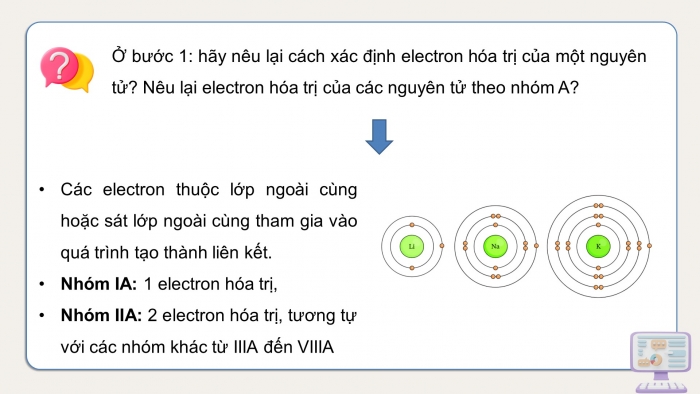
Ở bước 1: hãy nêu lại cách xác định electron hóa trị của một nguyên tử? Nêu lại electron hóa trị của các nguyên tử theo nhóm A?
- Các electron thuộc lớp ngoài cùng hoặc sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết.
- Nhóm IA: 1 electron hóa trị,
- Nhóm IIA: 2 electron hóa trị, tương tự với các nhóm khác từ IIIA đến VIIIA
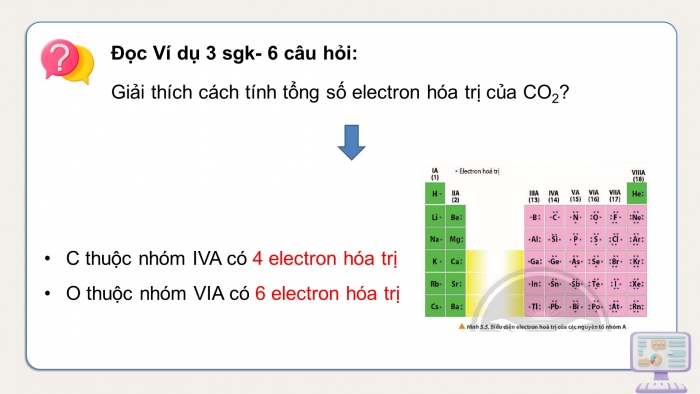
Đọc Ví dụ 3 sgk- 6 câu hỏi:
Giải thích cách tính tổng số electron hóa trị của CO2?
- C thuộc nhóm IVA có 4 electron hóa trị
- O thuộc nhóm VIA có 6 electron hóa trị
Câu hỏi 3 (sgk-6): Hãy tính tổng số electron hoá trị của phân tử BF3
Câu hỏi 4 (sgk-6):
- Xác định nguyên tử trung tâm trong BF3
- Lập sơ đồ khung của phân tử BF3.
Câu hỏi 5 (sgk-6): Thực hiện Bước 3 cho phân tử BF3 và cho biết có cần tiếp tục bước 4 ?
Hoàn thiện octet cho nguyên tử có độ âm điện lớn hơn:
Luyện tập (sgk-7): Viết công thức Lewis của phân tử CCl4
II.
HÌNH HỌC MỘT SỐ PHÂN TỬ
a) Tìm hiểu mô hình VSEPR
- Liên kết cộng hóa trị là liên kết có tính định hướng trong không gian, làm phân tử có những hình dạng nhất định, đó là hình học phân tử.
- Mô hình VSEPR dựa vào sự đẩy nhau giữa các cặp electron riêng của nguyên tử trung tâm trong công thức Lewis để dự đoán hình dạng phân tử hoặc ion.
AXnEm
A: nguyên tử trung tâm;
X: nguyên tử liên kết với nguyên tử A;
n là số nguyên tử;
E: cặp electron hóa trị chưa liên kết của nguyên tử A;
m là số cặp electron.
Công thức các chất viết dưới dạng
Giá trị (n + m) quyết định hình học phân tử AXnEm.
Ví dụ: Xác định cặp electron chung và riêng của nguyên tử trung tâm của CO2, NO2
- CO2: Không có electron riêng
- NO2: có 1 electron riêng vì công thức Lewis là:
Ví dụ 4 sgk-7: Với phân tử NH3, ta có:
Từ đó ta có công thức của NH3 theo mô hình VSEPR là: NH3E.
Câu hỏi 6 (sgk-7): Theo công thức Lewis của nước, phân tử nước có bao nhiêu cặp electron chung và bao nhiêu cặp electron riêng ở nguyên tử trung tâm?
Công thức Lewis của H2O là:
Câu hỏi 7 (sgk-7): Xác định giá trị n, m trong công thức VSEPR của phân tử SO2. Cho biết công thức Lewis của SO2 là:
- Phân tử SO2 có n = 2, m = 1.
- Công thức VSEPR của SO2 là AX2 E.
Câu hỏi 8 (sgk-7): Viết công thức VSEPR của H2O1NH3 và SO2.
PHIẾU HỌC TẬP
| Phân tử/ ion | Công thức electron | Công thức Lewis | Công thức Lewis. Tổng (n+m) | Dự đoán hình học các phân tử và ion |
Trường hợp nào góc liên kết không đúng với lí thuyết? Theo em đâu là nguyên nhân gây ra sự khác biệt?
Nội dung mô hình VSEPR bao gồm:
- Hình học phân tử phụ thuộc vào tổng số các cặp electron hóa trị của nguyên tử trung tâm (n + m).
- Các cặp electron hóa trị được phân bố xùng quanh nguyên tử trung tâm sao cho lực đẩy giữa chúng là nhỏ nhất.
- Lực đẩy của các cặp electrong chung (X) và cặp electron riêng (E) giảm theo thứ tự:
E – E > E – X > X – X.
b) Mô tả hình học một số phân tử
Bảng 1.2 (SGK- tr8)
Hình học một số phân tử chỉ phụ thuộc vào tổng số các cặp electron hóa trị (liên kết và chưa liên kết) của nguyên tử trung tâm.
Luyện tập (sgk-8): Sử dụng mô hình VSEPR để dự đoán hình học của phân tử CS2.
Công thức Lewis của phân tử CS2 là:
Như vậy công thức VSEPR của phân tử CS2 là AX2 nên phân tử CS2 có dạng đường thẳng.
một số hình ảnh minh họa trực quan hơn:
III.
SỰ LAI HÓA ORBITAL NGUYÊN TỬ
a) Tìm hiểu khái niệm lai hóa orbital
- Lai hóa orbital là sự tổ hợp các orbital của cùng một nguyên tử để tạo thành các orbital mới có năng lượng bằng nhau, hình dạng và kích thước giống nhau, nhưng định hướng khác nhau trong không gian.
- Điều kiện để các orbital nguyên tử (AO) có thể lai hóa với nhau là chúng có năng lượng gần bằng nhau.
- Số AO lai hóa bằng tổng số AO tham gia lai hóa.
Ví dụ: mô hình mô phỏng cấu trúc phân tử methane
--------------- Còn tiếp ---------------
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử chuyên đề Hoá học 10 chân trời sáng tạo
