Giáo án điện tử chuyên đề Hoá học 10 chân trời Bài 4: Entropy và biến thiên năng lượng tự do Gibbs
Tải giáo án điện tử Chuyên đề học tập Hoá học 10 chân trời sáng tạo Bài 4: Entropy và biến thiên năng lượng tự do Gibbs. Bộ giáo án chuyên đề được thiết kế sinh động, đẹp mắt. Thao tác tải về đơn giản, dễ dàng sử dụng và chỉnh sửa. Thầy, cô kéo xuống để xem chi tiết.
Xem: => Giáo án hóa học 10 chân trời sáng tạo (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét








Xem toàn bộ: Giáo án điện tử chuyên đề Hoá học 10 chân trời sáng tạo
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI GIẢNG HÔM NAY!
12
Mg
Magnesium
30
Zn
Zinc
O₂
Mg
BÀI 4: ENTROPY VÀ BIẾN THIÊN NĂNG LƯỢNG TỰ DO GIBBS
KHỞI ĐỘNG
Nếu một lọ nước hoa được mở, chúng ta sẽ ngửi được mùi thơm từ xa, do các phân tử của thành phần nước hoa khuếch tán vào không khí, đó là quá trình tự xảy ra. Ngược lại, để thu hồi các phân tử nước hoa đó vào trong lọ như trạng thái ban đầu thì không thể thực hiện được, đó là quá trình không tự xảy ra. Các phản ứng hóa học cũng tương tự như vậy, có phản ứng tự xảy ra và có phản ứng không tự xảy ra. Các quá trình trong tự nhiên có xu hướng xảy ra theo chiều tăng độ mất trật tự (hỗn loạn) của các tiểu phân trong hệ, người ta gọi đó là quá trình tăng entropy.
KHỞI ĐỘNG
- Entropy là gì?
- Entropy ảnh hưởng như thế nào đến chiều hướng diễn biến của phản ứng hóa học?
1
Entropy
2
Năng lượng tự do Gibbs
NỘI DUNG BÀI HỌC
1
ENTROPY
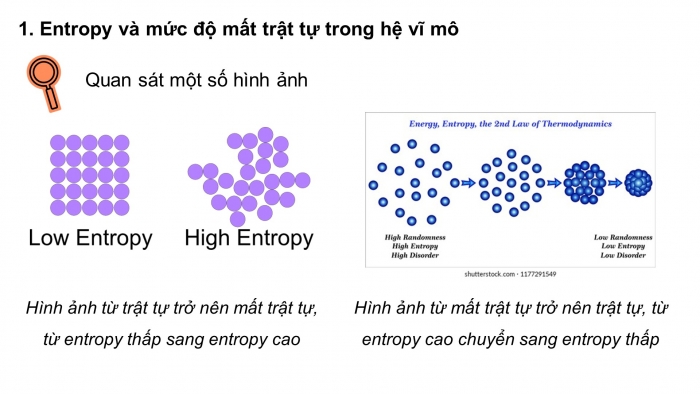
1. Entropy và mức độ mất trật tự trong hệ vĩ mô
Quan sát một số hình ảnh
Hình ảnh từ trật tự trở nên mất trật tự, từ entropy thấp sang entropy cao
Hình ảnh từ mất trật tự trở nên trật tự, từ entropy cao chuyển sang entropy thấp
Học sinh tìm hiểu nội dung SGK và trả lời câu hỏi:
Khái quát khái niệm entropy, entropy phụ thuộc các yếu tố nào?
- Entropy là đại lượng đặc trưng cho độ mất trật tự của một hệ ở một trạng thái và điều kiện xác định. Entropy càng lớn hệ càng mất trật tự.
- Entropy phụ thuộc vào các yếu tố như nhiệt độ, thể của hệ,…
Đối với cùng một chất, khi chuyển từ thể rắn, lỏng sang khí hoặc tăng nhiệt độ thì entropy của chất sẽ tăng.
Đơn vị của entropy thường là gì?
Câu 1 (tr-27): Tại sao khi tăng nhiệt độ lại làm tăng entropy của hệ?
Khi tăng nhiệt độ thì các phân tử chuyển động hỗn loạn hơn, mức độ mất trật tự của hệ tăng lên làm tăng entropy của hệ.
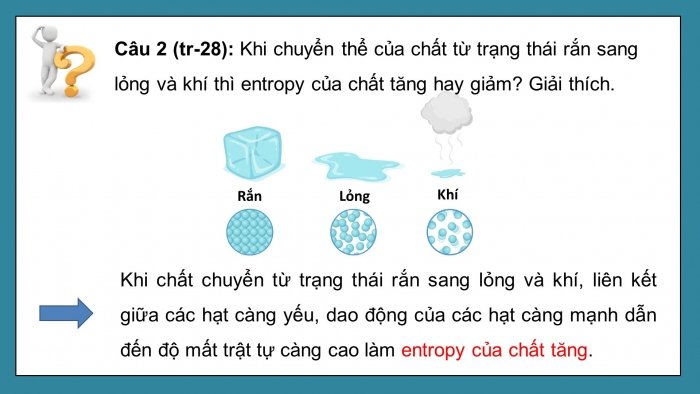
Câu 2 (tr-28): Khi chuyển thể của chất từ trạng thái rắn sang lỏng và khí thì entropy của chất tăng hay giảm? Giải thích.
Khi chất chuyển từ trạng thái rắn sang lỏng và khí, liên kết giữa các hạt càng yếu, dao động của các hạt càng mạnh dẫn đến độ mất trật tự càng cao làm entropy của chất tăng.
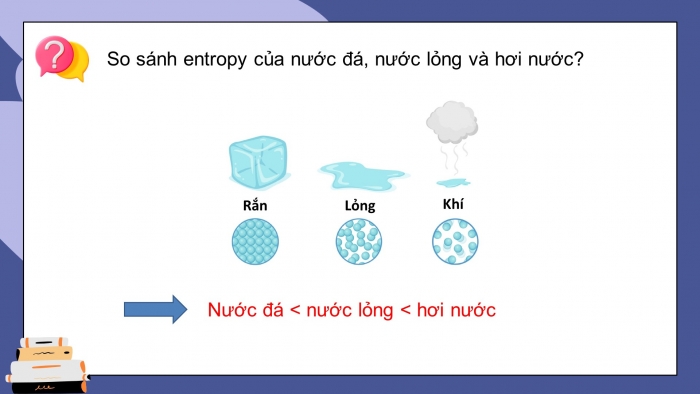
So sánh entropy của nước đá, nước lỏng và hơi nước?
Nước đá < nước lỏng < hơi nước
Các quá trình trong hình làm tăng entropy
Trả lời:
Vì quá trình bay hơi của bromine hay quá trình thăng hoa của iodine làm các phân tử chất chuyển động hỗn loạn hơn, mức độ mất trật tự của hệ tăng nên entropy tăng.
2. Biến thiên entropy trong phản ứng hóa học
Học sinh đọc Ví dụ 1(SGK-tr29)
KẾT LUẬN
Trả lời:
Giải thích: phản ứng này xảy ra làm số phân tử khí tăng lên, chuyển động các phân tử hỗn loạn hơn, nên entropy của hệ tăng.
Nhận xét: Biến thiên entropy chuẩn của phản ứng này bằng biến thiên entropy chuẩn của ví dụ 1 nhưng ngược dấu.
Trả lời:
2
NĂNG LƯỢNG TỰ DO GIBBS
- Thế nào là biến thiên enthalpy?
- Khi nào biến thiên enthalpy dương, khi nào âm?
- Biến thiên enthalpy của phản ứng là nhiệt lượng tỏa ra hay thu vào của phản ứng ở một điều kiện xác định.
- Phản ứng toả nhiệt có ΔH<0 và phản ứng thu nhiệt có ΔH>0
Các yếu tố quyết định một quá trình hóa học có tự xảy ra hay không.
Công thức tính biến thiên năng lượng Gibbs
Học sinh đọc Ví dụ 2 (SGK -tr30)
| 52,28 | -241,82 | -235,3 | |
| 219,6 | 188,72 | 282 |
Lời giải:
KẾT LUẬN
Vận dụng: Khi cho mẩu nhỏ sodium ( Na ) vào chậu thuỷ tinh chứa nước, mẩu sodium tan, có bọt khí xuất hiện, làm tăng nhiệt độ của nước trong chậu. Giải thích tại sao phản ứng này lại tự xảy ra một cách dễ dàng.
Lời giải:
- Phản ứng làm tăng nhiệt độ của nước trong chậu, do đó ΔH<0 (toả nhiệt) (1)
- Sodium tan, bọt khí xuất hiện, do đó ΔS>0 (mức độ hỗn loạn của hệ tăng) (2)
nên phản ứng tự xảy ra một cách dễ dàng.
Bài 1 (tr-32): Quan sát hình dưới: Khi trộn nước và propanol (bên trái) thu được dung dịch (bên phải). Hãy cho biết quá trình đó sẽ làm tăng hay giảm entropy.
LUYỆN TẬP
--------------- Còn tiếp ---------------
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử chuyên đề Hoá học 10 chân trời sáng tạo
