Đề kiểm tra 15 phút Hoá học 10 chân trời sáng tạo (có đáp án)
Tổng hợp trọn bộ đề kiểm tra 15 phút Hoá học 10 bộ sách mới Chân trời sáng tạo. Bộ đề kiểm tra 15 phút bao gồm: đề kiểm tra trắc nghiệm, đề kiểm tra tự luận, đề kiểm tra trắc nghiệm + tự luận. Tài liệu có đáp án kèm theo và file word tải về chỉnh sửa được. Hi vọng bộ đề kiểm tra Hoá học 10 chân trời này giúp ích được cho thầy cô để ôn tập và đánh giá năng lực học sinh.
Click vào ảnh dưới đây để xem giáo án rõ







Một số tài liệu quan tâm khác
Phần trình bày nội dung giáo án
ĐỀ KIỂM TRA 15 PHÚT – BÀI 10: LIÊN KẾT CỘNG HÓA TRỊ
I. DẠNG 1 – ĐỀ KIỂM TRA TRẮC NGHIỆM
ĐỀ 1
(Chọn chữ cái trước câu trả lời đúng nhất.)
Câu 1: Liên kết cộng hóa trị là liên kết hình thành giữa hai nguyên tử bằng
- một cặp electron chung
- các electron hóa trị riêng
- một hay nhiều cặp electron chung
- lực hút tĩnh điện giữa các ion mang điện tích trái dấu
Câu 2: Liên kết giữa hai nguyên tử được hình thành bởi một cặp electron chung được gọi là
- liên kết ba
- liên kết đôi
- liên kết bội
- liên kết đơn
Câu 3: Dựa vào số cặp electron chung, liên kết cộng hóa trị được chia thành mấy loại?
- 2 loại: liên kết σ và liên kết π
- 2 loại: liên kết cộng hóa trị không phân cực và liên kết cộng hóa trị phân cực
- 2 loại: liên kết đơn và liên kết đôi
- 3 loại: liên kết đơn, liên kết đôi và liên kết ba
Câu 4: Liên kết cộng hóa trị được chia thành liên kết cộng hóa trị không phân cực và phân cực dựa vào
- vị trí của các cặp electron chung
- vị trí của các electron hóa trị riêng
- sự xen phủ các orbital
- số cặp electron chung
Câu 5: Trong phân tử N2, mỗi nguyên tử N đã góp 3 electron để tạo cặp electron chung. Nhờ đó mỗi nguyên tử N đã đạt cấu hình electron bền vững của khí hiếm
- Xe
- Ar
- Ne
- Kr
Câu 6: Cho công thức Lewis của phân tử NH3 dưới đây. Số electron dùng chung của N là
- 2 electron dùng chung
- 3 electron dùng chung
- 5 electron dùng chung
- 6 electron dùng chung
Câu 7: Trong một phân tử CO2 có số cặp electron chung là
- 1
- 2
- 3
- 4
Câu 8: Cho các phân tử HF, HBr, HI, HCl. Sắp xếp theo chiều tăng dần độ bền liên kết là
- HF, HCl, HBr, HI
- HF, HBr, HI, HCl
- HI, HBr, HCl, HF
- HBr, HI, HF, HCl
Câu 9: Nguyên tử A và B có độ âm điện lần lượt là χ(A) , χ(B) (χ(B) ≥ χ(A) ). Hiệu độ âm điện giữa hai nguyên tử A, B là Δχ = χ(B) - χ (A). Nếu liên kết giữa hai nguyên tử A và B là liên kết cộng hóa trị có cực thì
- 1,7 ≤ Δχ < 4,0.
- 0 ≤ Δχ < 0,4.
- Δχ ≥ 1,7.
- 0,4 ≤ Δχ < 1,7.
Câu 10: Cho biết năng lượng liên kết của H–F là 565 KJ mol-1; H–Cl là 431 KJ mol-1; H–Br là 364 KJ mol-1; H–I là 297 KJ mol-1. Trong các liên kết trên, liên kết nào bền nhất?
- H–I.
- H–Br.
- H–Cl.
- H–F
GỢI Ý ĐÁP ÁN
(Mỗi câu đúng tương ứng với 1 điểm)
|
Câu hỏi |
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
|
Đáp án |
C |
D |
D |
A |
C |
|
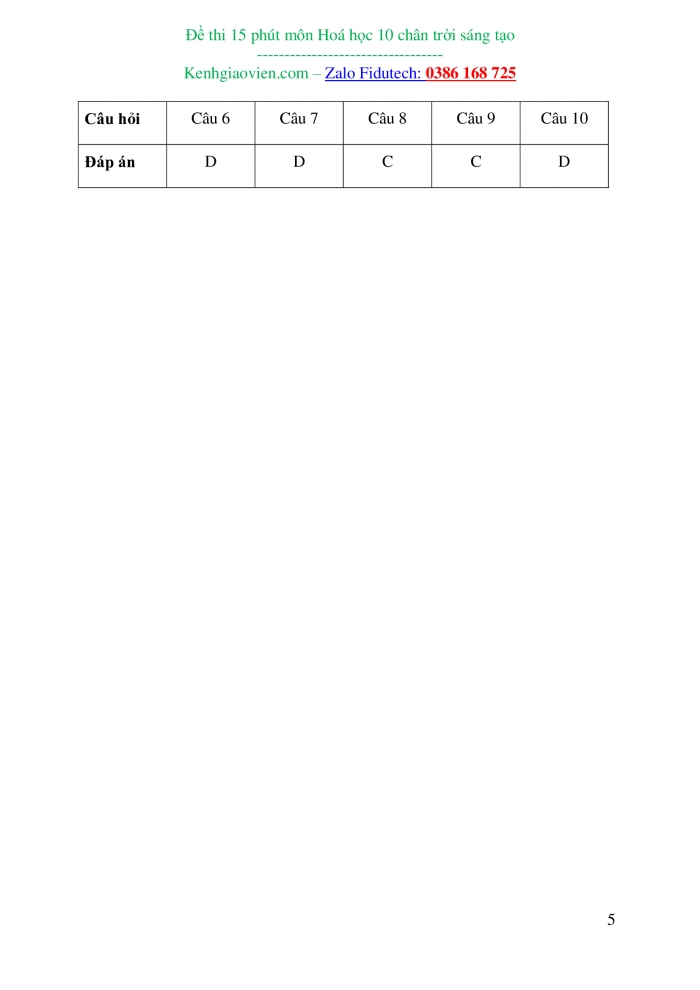
Câu hỏi |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
Đáp án |
D |
D |
C |
C |
D |
ĐỀ 2
(Chọn chữ cái trước câu trả lời đúng nhất.)
Câu 1: Công thức biểu diễn cấu tạo nguyên tử qua các liên kết và các electron hóa trị riêng là
- công thức Lewis
- công thức đơn giản nhất
- công thức electron
- công thức phân tử
Câu 2: Khẳng định sai là
- Liên kết đôi gồm một liên kết σ và một liên kết π, liên kết ba gồm một liên kết σ và hai liên kết π
- Liên kết đơn còn gọi là liên kết π
- Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi π
- Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết σ
Câu 3: Các AO xen phủ tạo liên kết đơn trong phân tử Cl2 là
- 1 AO s và 1 AO p xen phủ trục tạo liên kết đơn
- 2 AO ps xen phủ bên tạo liên kết đơn
- 2 AO p xen phủ trục tạo liên kết đơn
- 2 AO s xen phủ trục tạo liên kết đơn
Câu 4: Liên kết cộng hóa trị là liên kết được hình thành bởi
- lực hút tĩnh điện giữa các ion cùng dấu
- lực hút tĩnh điện giữa các ion trái dấu.
- một hay nhiều cặp electron chung giữa hai nguyên tử
- sự cho và nhận electron giữa hai nguyên tử.
Câu 5: Công thức electron của phân tử H2O là
Câu 6: Liên kết trong phân tử nào dưới đây là liên kết đôi?
- O2
- NH3
- HCl
- N2
Câu 7: Dựa vào giá trị độ âm điện, liên kết giữa nguyên tử H và Cl thuộc loại
- liên kết ion
- liên kết cộng hóa trị có cực
- liên kết cộng hóa trị không cực
- liên kết đơn
Câu 8: Cho các hợp chất sau: Cl2, NaCl, HCl, CO2, NaF. Số hợp chất chứa liên kết cộng hóa trị là?
- 3
- 2
- 4
- 5
Câu 9: Phát biểu nào sau đây không đúng về sự tạo thành phân tử carbon dioxide?
- Phân tử CO2có 1 liên kết đôi;
- Nguyên tử carbon có 4 electron hóa trị, nguyên tử oxygen có 6 electron hóa trị;
- Hai nguyên tử oxygen liên kết một nguyên tử carbon bằng cách mỗi nguyên tử oxygen đóng góp 2 electron và nguyên tử carbon đóng góp 4 electron;
- Giữa nguyên tử C và một nguyên tử O có 2 cặp electron dùng chung.
Câu 10: Liên kết giữa hai nguyên tử N trong phân tử N2 có số cặp electron chung là
- 4
- 3
- 2
- 1
GỢI Ý ĐÁP ÁN
(Mỗi câu đúng tương ứng với 1 điểm)
|
Câu hỏi |
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
|
Đáp án |
A |
B |
C |
C |
A |
|
Câu hỏi |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
Đáp án |
A |
B |
A |
A |
B |
II. DẠNG 2 – ĐỀ KIỂM TRA TỰ LUẬN
ĐỀ 1
Câu 1 (4 điểm). Cho các nguyên tử và giá trị độ âm điện tương ứng như sau: Cl(3,16), O(3,44), N(3,04), P (2,19), H(2,2). Phân tử nào có liên kết phân cực nhất?
Câu 2 (6 điểm). Viết công thức electron và công thức cấu tạo và công thức Lewis phân tử sau: NO2, HClO, PH3
GỢI Ý ĐÁP ÁN:
|
Câu |
Nội dung |
Biểu điểm |
|
Câu 1 (4 điểm) |
NH3 vì
|
2 điểm
0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm |
|
Câu 2 (6 điểm) |
|
2 điểm 2 điểm 2 điểm |
ĐỀ 2
Câu 1 (6 điểm). Viết công thức electron và công thức cấu tạo và công thức Lewis phân tử sau: PCl5, H3PO3, N2O5.
Câu 2 (4 điểm). Trong các hợp chất sau hợp chất nào có liên kết cộng hóa trị: NaCl, KF, CaF2 , CCl4
GỢI Ý ĐÁP ÁN:
|
Câu |
Nội dung |
Biểu điểm |
|
Câu 1 (6 điểm) |
CTPT CT electron CT Lewis CTCT
|
2 điểm
2 điểm
2 điểm |
|
Câu 2 (4 điểm) |
CCl4 , vì ta có
|
2 điểm 2 điểm |
III. DẠNG 3 – ĐỀ TRẮC NGHIỆM VÀ TỰ LUẬN
ĐỀ 1
- Phần trắc nghiệm (4 điểm)
(Chọn chữ cái trước câu trả lời đúng nhất.)
Câu 1: Dựa vào độ âm điện, liên kết trong phân tử nào dưới đây là liên kết cộng hóa trị không cực?
- H2O
- NaCl
- CH4
- HCl
Câu 2: Công thức cấu tạo của CO2 là
- O-C-O.
- C-O-O.
- O=C=O.
- O=C-O.
Câu 3: Liên kết giữa 2 nguyên tử N trong phân tử N2 là
- liên kết đôi
- liên kết ba.
- liên kết đơn
- liên kết ion
Câu 4: Liên kết mà cặp electron chung được đóng góp từ một nguyên tử được gọi là
- liên kết ion.
- liên kết hiđro.
- liên kết cộng hóa trị có cực.
- liên kết cho – nhận.
- Phần tự luận (6 điểm)
Câu 1 (2 điểm). Thế nào là liên kết cộng hóa trị phân cực?
Câu 2 (4 điểm). Trình bày liên kết cho - nhận trong phân tử sulfur dioxide.
GỢI Ý ĐÁP ÁN:
Trắc nghiệm: (Mỗi câu đúng tương ứng với 1 điểm)
|
Câu hỏi |
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
|
Đáp án |
C |
C |
B |
D |
Tự luận:
|
Câu |
Nội dung |
Biểu điểm |
|
Câu 1 (2 điểm) |
Là liên kết cộng hóa trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn. |
2 điểm |
|
Câu 2 (4 điểm) |
|
2 điểm
2 điểm |
ĐỀ 2
- Phần trắc nghiệm (4 điểm)
(Chọn chữ cái trước câu trả lời đúng nhất.)
Câu 1: Trong phân tử nào đây có chứa liên kết cho nhận?
- O2.
- NaCl.
- SO2.
- HCl.
Câu 2: Liên kết giữa hai nguyên tử Cl trong phân tử Cl2 là
- liên kết cộng hóa trị không cực
- liên kết cộng hóa trị có cực.
- liên kết ion.
- liên kết cho – nhận.
Câu 3: Cho biết độ âm điện của nguyên tử H và Cl lần lượt là 2,2 và 3,2. Liên kết giữa nguyên tử H và Cl trong phân tử HCl là
- liên kết ion.
- liên kết cộng hóa trị không cực.
- liên kết cho – nhận.
- liên kết cộng hóa trị có cực.
Câu 4: Liên kết ba gồm
- 3 liên kết s.
- 2 liên kết s và 1 liên kết p.
- 1 liên kết s và 1 liên kết p.
- 1 liên kết s và 2 liên kết p.
- Phần tự luận (6 điểm)
Câu 1 (2 điểm). Liên kết được hình thành như thế nào?
Câu 2 (4 điểm). Liên kết KF là liên kết gì? Giải thích.
GỢI Ý ĐÁP ÁN:
Trắc nghiệm: (Mỗi câu đúng tương ứng với 1 điểm)
|
Câu hỏi |
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
|
Đáp án |
C |
A |
D |
D |
Tự luận:
|
Câu |
Nội dung |
Biểu điểm |
|
Câu 1 (2 điểm) |
Được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ nằm hai bên đường nối tâm hai nguyên tử. |
2 điểm |
|
Câu 2 (4 điểm) |
Là liên kết ion vì:
|
2điểm 2 điểm |

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
=> Giáo án hóa học 10 chân trời sáng tạo (bản word)
Từ khóa: Đề kiểm tra hoá học 10 chân trời sáng tạo, đề kiểm tra 15 phút bộ hoá học 10 chân trời sáng tạo, bộ đề trắc nghiệm tự luận hoá học 10 chân trời sáng tạo