Giáo án điện tử chuyên đề Hoá học 10 kết nối Bài 3: Năng lượng hoạt hoá của phản ứng hoá học
Tải giáo án điện tử Chuyên đề học tập Hoá học 10 kết nối tri thức Bài 3: Năng lượng hoạt hoá của phản ứng hoá học. Bộ giáo án chuyên đề được thiết kế sinh động, đẹp mắt. Thao tác tải về đơn giản, dễ dàng sử dụng và chỉnh sửa. Thầy, cô kéo xuống để xem chi tiết.
Xem: => Giáo án hóa học 10 kết nối tri thức (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét










Xem toàn bộ: Giáo án điện tử chuyên đề Hoá học 10 kết nối tri thức
NHIỆT LIỆT CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI!
BÀI 3: NĂNG LƯỢNG HOẠT HÓA CỦA PHẢN ỨNG HÓA HỌC
KHỞI ĐỘNG
Yếu tố nào quyết định sự thay đổi đó?
Hydrogen và oxygen không phản ứng với nhau ở nhiệt độ thường, nhưng khi đưa một ít bột platinium (Pt) vào hỗn hợp hai khí đó, phản ứng xảy ra ngay tức khắc, tạo thành nước.
NỘI DUNG BÀI HỌC
I. Năng lượng hoạt hóa
II. Chất xúc tác
I.
Năng lượng hoạt hóa
Nhiệm vụ 1: Tìm hiểu khái niệm năng lượng hoạt hóa
Năng lượng hoạt hóa là gì.
Năng lượng hoạt hóa (Ea) là năng lượng tối thiểu mà các chất phản ứng cần có để phản ứng hóa học có thể xảy ra.
- Để xảy ra phản ứng hóa học, các chất phản ứng phải va chạm với nhau.
- Va chạm có hiệu quả là những va chạm đúng hướng và đủ năng lượng để tạo ra sản phẩm.
Không xảy ra phản ứng
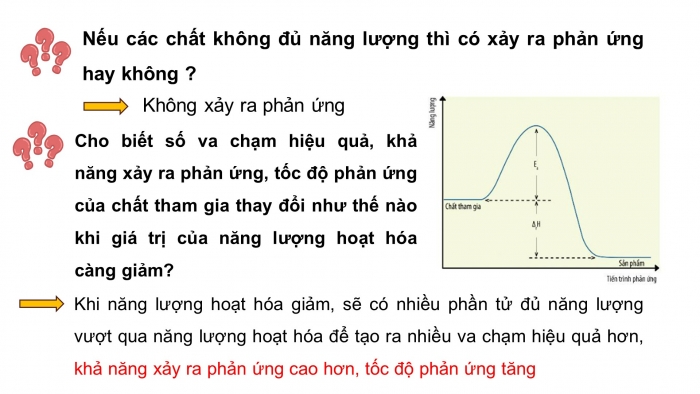
Nếu các chất không đủ năng lượng thì có xảy ra phản ứng hay không ?
Cho biết số va chạm hiệu quả, khả năng xảy ra phản ứng, tốc độ phản ứng của chất tham gia thay đổi như thế nào khi giá trị của năng lượng hoạt hóa càng giảm?
Khi năng lượng hoạt hóa giảm, sẽ có nhiều phần tử đủ năng lượng vượt qua năng lượng hoạt hóa để tạo ra nhiều va chạm hiệu quả hơn, khả năng xảy ra phản ứng cao hơn, tốc độ phản ứng tăng
KẾT LUẬN
- Năng lượng hoạt hóa càng thấp phản ứng càng dễ xảy ra.
- Năng lượng hoạt hóa càng lớn thì tốc độ phản ứng càng nhỏ và năng lượng hoạt hóa càng nhỏ, thì tốc độ phản ứng càng lớn.
Nhiệm vụ 2: Tìm hiểu ảnh hưởng của năng lượng hoạt hóa và nhiệt độ tới tốc độ phản ứng
Mối liên hệ giữa nhiệt độ, năng lượng hoạt hóa với hằng số tốc độ phản ứng được biểu thi trong phương trình Arrhenius:
Trong đó:
- A: hằng số đặc trưng cho mỗi phản ứng.
- e = 2,7183;
- R là hằng số lí tưởng (R =8,324 J/(mol.K));
- T: nhiệt độ (theo thang Kelvin);
- Ea: năng lượng hoạt hóa (J/mol).
Hoặc:
Dựa vào phương trình Arrhenius, tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ của phản ứng?
Theo phương trình, trong cùng một phản ứng Ea không đổi, hằng số A và R không đổi, khi tăng nhiệt độ, dẫn đến hằng số tốc độ k của phản ứng tăng, nên tốc độ phản ứng tăng.
Phương trình Arrhenius:
Ví dụ: Một phản ứng đơn giản xảy ra ở nhiệt độ 100oC, trong điều kiện có xúc tác và không có xúc tác, năng lượng hoạt hóa của phản ứng lần lượt là: Ea1=25 kJ/mol, Ea2=50 kJ/mol. So sánh tốc độ phản ứng trong 2 điều kiện.
Ở nhiệt độ không đổi, năng lượng hoạt hóa của phản ứng trong 2 điều kiện là: Ea1=25 kJ/mol, Ea2=50 kJ/mol.
Phương trình Arrhenius viết cho phản ứng trên trong 2 điều kiện:
Vậy khi năng lượng hoạt hóa giảm từ 50 kJ/mol về 25 kJ/mol, tốc độ phản ứng tăng 3170,4 lần.
Đọc ví dụ (SGK -tr20)
Với phản ứng có năng lượng hoạt hóa Ea= 70 kJ/mol, khi tăng nhiệt độ từ 300 K đến 400 K, tốc độ phản ứng sẽ thay đổi như thế nào?
Như vậy khi nhiệt độ tăng từ 300K đến 400K thì tốc độ phản ứng tăng 1115 lần
Lời giải:
Trả lời:
II.
CHẤT XÚC TÁC
Nhiệm vụ 1: Tìm hiểu khái niệm chất xúc tác
- Phương trình phản ứng của chất xúc tác:
Thế nào là chất xúc tác. Cho ví dụ về chất xúc tác?
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị biến đổi về chất và lượng sau phản ứng.
Ví dụ 1 (SGK -tr20)
Ví dụ 2 (SGK -tr20)
Nhiệm vụ 2: Tìm hiểu đặc điểm của chất xúc tác
Xem hình 3.1, quan sát và so sánh năng lượng hoạt hóa của phản ứng sẽ thay đổi như thế nào so với khi không có chất xúc tác và khi có chất xúc tác.
Năng lượng hoạt hóa khi có chất xúc tác sẽ thấp hơn
Nếu năng lượng hoạt hóa giảm thì tốc độ phản ứng sẽ như thế nào?
Năng lượng hoạt hóa giảm thì tốc độ tăng
Có phải mỗi chất xúc tác đều có thể sử dụng cho nhiều phản ứng khác nhau hay không?
Không
Hãy lấy ví dụ chứng minh tính chọn lọc của chất xúc tác.
Ví dụ (SGK -tr21).
Nhiệm vụ 3: Tìm hiểu vai trò của chất xúc tác
Tìm hiểu SGK hãy nêu các vai trò của chất xúc tác và ví dụ.
- Chất xúc tác được sử dụng làm tăng tốc độ các phản ứng hóa học trong sản xuất công nghiệp
Ví dụ: Pt, V2O5 được sử dụng trong quá trình oxi hóa SO2 thành SO3.
- Quy trình sản xuất có thể được cải tiến bằng cách lựa chọn các chất xúc tác thích hợp.
Ví dụ: Tùy thuộc vào chất xúc tác được chọn và điều kiện phản ứng sẽ thu được sản phẩm khác nhau.
Nếu có chất xúc tác thì phương trình Arrhenius như thế nào?
Kí hiệu:
- Hằng số tốc độ của phản ứng không có xúc tác là ko .
- Phản ứng có xúc tác là kx.
Phương trình Arrhenius:
LUYỆN TẬP
Câu 2 (tr-20): Tính năng lượng hoạt hóa của một phản ứng biết rằng khi nhiệt độ tăng từ 300 K lên 310 K thì tốc độ phản ứng tăng 3 lần
Trả lời:
Trả lời:
Câu 5 (tr-22): Một phản ứng xảy ra ở 500oC, năng lượng hoạt hóa của phản ứng khi không có xúc tác và khi có xúc tác lần lượt là 55,4 kJ/mol. Chứng minh rằng chất xúc tác có ảnh hưởng đến ốc độ phản ứng.
Trả lời:
Chất xúc tác làm tăng tốc độ phản ứng lên 678,58 lần.
VẬN DỤNG
--------------- Còn tiếp ---------------
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử chuyên đề Hoá học 10 kết nối tri thức
