Giáo án powerpoint chuyên đề Hoá học 10 kết nối tri thức
Giáo án điện tử hay còn gọi là giáo án PowerPoint Chuyên đề học tập Hoá học 10 kết nối tri thức. Bộ giáo án được thiết kế đẹp mắt, chỉn chu, tổng hợp nhiều câu hỏi và dạng bài tập hay trong bộ sách chuyên đề. Bộ giáo án trình chiếu tải về và chỉnh sửa được. Mời thầy cô kéo xuống tham khảo.
Click vào ảnh dưới đây để xem giáo án rõ










Một số tài liệu quan tâm khác
Phần trình bày nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
CHUYÊN ĐỀ 1.
CƠ SỞ HÓA HỌC
KHỞI ĐỘNG
Hình ảnh phân tử BeCl2:
Hình ảnh phân tử BF3:
Hình ảnh phân tử CH4:
Dạng hình học phân tử ảnh hưởng đến khả năng phản ứng, hoạt tính sinh học, tính phân cực,... của phân tử. Dựa trên cở sở nào để dự đoán hình học của một phân tử?
BÀI 1. LIÊN KẾT
HÓA HỌC
NỘI DUNG BÀI HỌC
I. Công thức Lewis
II. Cấu trúc hình học của một số phân tử
III. Sự lai hóa orbital nguyên tử
I. CÔNG THỨC LEWIS
1. Công thức electron, công thức Lewis
Công thức electron
Khi biểu diễn liên kết giữa các nguyên tử bằng một hay nhiều cặp electron dùng chung, ta được công thức electron.
Công thức Lewis:
Khi thay mỗi cặp electron dùng chung trong công thức electron bằng một gạch nối (-), ta được công thức Lewis.
2. Các bước viết công thức Lewis
Trình bày các bước để viết công thức Lewis.
Bước 1: Xác định tổng số electron hóa trị trong phân tử.
Bước 2: Vẽ khung phân tử với các liên kết đơn.
Nguyên tử trung tâm của một phân tử hay ion là nguyên tử cần nhiều nhất số electron để tạo octet cho vỏ hóa trị của nó (hay nguyên tử có số oxi hóa cao nhất về giá trị tuyệt đối), các nguyên tử khác của phân tử hay ion đó là phối tử.
Bước 3: Điền các electron hóa trị chưa tham gia liên kết vào các nguyên tử xung quanh để đạt octet.
Bước 4: Tính số electron hóa trị còn lại.
- Nếu còn electron hóa trị: sử dụng để hoàn thành octet của nguyên tử trung tâm.
- Nếu electron hóa trị hết: nguyên tử trung tâm chưa đạt octet thì chuyển các cặp electron hóa trị từ nguyên tử xung quanh để tạo liên kết đôi hoặc liên kết ba với nguyên tử trung tâm.
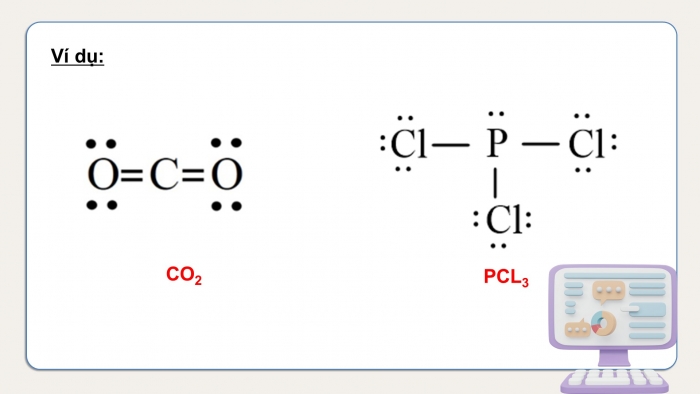
Ví dụ:
CO2
PCL3
Câu 1: Công thức Lewis của CS2 là
Câu 2: Trình bày các bước để viết công thức Lewis của phân tử NH3
Trả lời:
Bước 1: Xác định tổng số electron hóa trị trong phân tử:
(1.5)=(3.1) = 8.
Bước 2: Vẽ khung phân tử với các liên kết đơn:
Bước 3: Hoàn thiện octet cho nguyên tử N:
Bước 4: Tính số electron hóa trị còn lại = 8 – [(1.5)+(3.1)] = 0.
Câu 3: Viết các công thức Lewis cho mỗi phần tử sau:
- Cl2 ; N2.
- SO2 ; SO3
II. CẤU TRÚC HÌNH HỌC CỦA MỘT SỐ PHÂN TỬ
1. Mô hình VSEPR (mô hình lực đẩy giữa các cặp electron hóa trị)
- Liên kết cộng hóa trị có tính định hướng không gian nên phân tử có hình dạng nhất định.
- Các cặp electron hóa trị được phân bố xung quanh nguyên tử trung tâm sao cho lực đẩy giữa chúng là nhỏ nhất.
- Công thức các chất viết dưới dạng
AXnEm
A: nguyên tử trung tâm;
X: nguyên tử liên kết với nguyên tử A; n là số nguyên tử;
E: cặp electron hóa trị chưa liên kết của nguyên tử A; m là số cặp electron.
Nếu nguyên tử trung tâm lẻ một electron thì electron đó vẫn được tính tương đương một cặp electron.
CH4
NH3E
OH2E2
Quy tắc thuyết sức đẩy:
- Cấu hình các liên kết của nguyên tử hay ion trung tâm đa hoá trị chỉ phụ thuộc vào tổng số cặp electron hoá trị
 bao quanh nó.
bao quanh nó. - Kích thước các orbital của cặp electron hoá trị được phân bố sao cho sức đẩy giữa các cặp electron đó là tối thiểu.
- Sức đẩy của các cặp electron giảm theo thứ tự:
E – E > E – X > X - X.
- Nguyên tử trung tâm A có độ âm điện lớn sẽ kéo mây electron của cặp electron liên kết về phía nó nhiều hơn làm cho góc liên kết tăng.
- Phối tử X có độ âm điện lớn sẽ kéo mây electron của cặp electron liên kết về phía nó nhiều hơn làm cho góc liên kết giảm.
Ví dụ: phân tử ![]() có công thức VSEPR là
có công thức VSEPR là ![]() với cấu tạo Lewis:
với cấu tạo Lewis:
- Sức đầy của cặp electron chưa liên kết (E) là lớn nhất
- Tiếp theo là sức đẩy giữa các cặp electron của
 và
và  ,
, - Cuối cùng là sức đẩy giữa các cặp electron của
 .
.
2. Hình dạng một số phân tử và ion
Sử dụng mô hình VSEPR để dự đoán dạng hình học của một số phần tử AXn (n = 2, 3, 4...) và AXnEm (n = 2, 4 và m = 1, 2)
a) Trường hợp AXn (n = 2, 3, 4...)
b) Dự đoán dạng hình học của một số trường hợp AXnEm (n = 2, 4 và m = 1, 2)
Quan sát ví dụ minh họa về phân tử CO2
- Nguyên tử trung tâm là C.
- Xung quanh nguyên tử trung tâm C không có cặp electron chưa liên kết, chỉ có hai cặp electron liên kết đẩy nhau.
Góc hóa trị lớn nhất là 180o.
Ví dụ SO3, n= 3
Xung quanh nguyên tử trung tâm S có ba cặp electron hóa trị liên kết đẩy nhau.
Góc hóa trị lớn nhất là 120o.
Nếu n = 2 thì mô hình phân tử có dạng gì, nêu một số phân tử và ion làm ví dụ? Tương tự với n = 3, n = 4.
- n = 2, mô hình là đường thẳng.
- n = 3, mô hình là tam giác phẳng.
- n = 4, mô hình là tứ diện
Sơ đồ H2O để minh họa:
- Phân tử có ba nguyên tử, bình thường hay viết dưới dạng đường thẳng nhưng theo mô hình Sức đẩy giữa các cặp electron hóa trị,
- Hai cặp e chưa liên kết đẩy mạnh hơn cặp e liên kết nên phân tử có cấu trúc dạng góc.
Tìm hiểu về dự đoán hình học một số trường hợp: SO2, NH3, H2O.
TỔNG QUÁT
Tổng ![]() quyết định dạng hình học của phân tử.
quyết định dạng hình học của phân tử.
 phân tử có dạng đoạn thẳng;
phân tử có dạng đoạn thẳng; và
và  phân tử có dạng tam giác phẳng;
phân tử có dạng tam giác phẳng;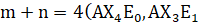 và
và  phân tử có dạng tứ diện;
phân tử có dạng tứ diện; và
và 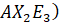 phân tử có dạng lưỡng tháp tam giác;
phân tử có dạng lưỡng tháp tam giác;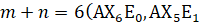 và
và  phân tử có dạng lưỡng tháp tứ giác (bát diện).
phân tử có dạng lưỡng tháp tứ giác (bát diện).
...........................................
...........................................
...........................................

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
=> Giáo án hóa học 10 kết nối tri thức (bản word)
Từ khóa: Giáo án powerpoint chuyên đề Hoá học 10 kết nối tri thức, ppt chuyên đề Hoá học 10, giáo án điện tử chuyên đề Hoá học 10 kết nối