Giáo án và PPT đồng bộ Hoá học 10 kết nối tri thức
Hoá học 10 kết nối tri thức. Giáo án word chỉn chu. Giáo án ppt (powerpoint) hấp dẫn, hiện đại. Word và PPT được soạn đồng bộ, thống nhất với nhau. Bộ tài liệu sẽ giúp giáo viên nhẹ nhàng trong giảng dạy. Thầy/cô tham khảo trước để biết chất lượng.
Click vào ảnh dưới đây để xem giáo án rõ



























Một số tài liệu quan tâm khác
Phần trình bày nội dung giáo án
Trường:…………..
Giáo viên:
Bộ môn: Hóa học 10 kết nối
PHẦN 1: SOẠN GIÁO ÁN WORD HÓA HỌC 10 KẾT NỐI TRI THỨC
BÀI 1: THÀNH PHẦN CỦA NGUYÊN TỬ
I. MỤC TIÊU
Kiến thức: Học xong bài này, HS đạt các yêu cầu sau:
Trình bày được thành phần của nguyên tử (nguyên tử gồm 2 phần: hạt nhân và lớp vỏ nguyên tử; hạt nhân tạo nên bở các hạt proton, neutron, lớp vỏ tạo nên bởi các electron; điện tích, khối lượng mỗi loại hạt).
Nêu được khái niệm số khối, kí hiệu số khối
Năng lực
Năng lực chung:
Năng lực tự chủ và tự học trong tìm tòi khám phá.
Năng lực giao tiếp và hợp tác trong trình bày, thảo luận và làm việc nhóm.
Năng lực giải quyết vấn đề và sáng tạo trong thực hành, vận dụng.
Năng lực riêng:
Năng lực sử dụng ngôn ngữ hóa học: sử dụng các thuật ngữ hóa học, tên các nguyên tố hóa học trong bài học.
Năng lực nghiên cứu và thực hành hóa học: so sánh được khối lượng của electron với proton và neutron, kích thước của hạt nhân với nguyên tử.
Năng lực tính toán hóa học: vận dụng kiến thức bài học tính được thể tích, khối lượng nguyên tử, số khối.
Phẩm chất
Có ý thức học tập, ý thức tìm tòi, khám phá và sáng tạo, có ý thức làm việc nhóm, tôn trọng ý kiến các thành viên khi hợp tác.
Chăm chỉ tích cực xây dựng bài, có trách nhiệm, chủ động chiếm lĩnh kiến thức theo sự hướng dẫn của GV.
Hình thành tư duy logic, lập luận chặt chẽ, và linh hoạt trong quá trình suy nghĩ.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
Đối với GV: SGK, Tài liệu giảng dạy, giáo án PPT, hình ảnh hoặc video giới thiệu về nguyên tử.
Đối với HS: SGK, vở ghi, giấy nháp, đồ dùng học tập (bút, thước...), bảng nhóm, bút viết bảng nhóm.
III. TIẾN TRÌNH DẠY HỌC
HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
a) Mục tiêu: HS nhớ lại kiến thức cũ và tạo hứng thú khi vào bài mới.
b) Nội dung: GV đưa ra câu hỏi mở đầu yêu cầu học sinh nhớ lại kiến thức môn KHTN đã học ở THCS trả lời.
c) Sản phẩm: HS trả lời được câu hỏi mở đầu.
d) Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
-GV đưa ra câu hỏi mở đầu: “Chương trình KHTN em đã được học về nguyên tử, Vậy nguyên tử gồm các loại hạt cơ bản nào? Các nhà khoa học đã phát hiện ra các loại hạt cơ bản đó như thế nào?”
Bước 2: Thực hiện nhiệm vụ
- HS quan sát và chú ý lắng câu hỏi và đưa ra câu trả lời.
Bước 3: Báo cáo, thảo luận:
- Các HS xung phong phát biểu trả lời.
Bước 4: Kết luận, nhận xét:
- GV nhận xét, đánh giá, đưa ra đáp án đúng.
Đáp án: Nguyên tử gồm 3 loại hạt cơ bản: Proton, electron và neutron
- Năm 1897: J.J. Thomson phát hiện ra electron bằng thí nghiệm phóng điện qua không khí loãng.
-Năm 1911: E. Rutherford phát hiện ra hạt nhân bằng thí nghiệm bắn phá lá vàng mỏng bằng hạt chùm alpha và năm 1918, phát hiện ra proton qua thí nghiệm bắn phá nitrogen.
- Năm 1932, J. Chadwwid phát hiện ra neutron khi bắn phá beryllium bằng các hạt alpha.
HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Các loại hạt cấu tạo nên nguyên tử.
a) Mục tiêu:
- Trình bày được thành phần của nguyên tử (nguyên tử gồm 2 phần: hạt nhân và lớp vỏ nguyên tử; hạt nhân tạo nên bởi các hạt proton, neutron, lớp vỏ tạo nên bởi các electron; điện tích, khối lượng mỗi loại hạt).b) Nội dung: HS đọc SGK, nhớ lại kiến thức môn KHTN để trả lời câu hỏi, tìm hiểu nội dung kiến thức theo yêu cầu của GV.
c) Sản phẩm: HS trình bày về cấu tạo của nguyên tử và trả lời câu hỏi ?1,2,3 sgk trang 14.
d) Tổ chức thực hiện:
HĐ CỦA GV VÀ HS | SẢN PHẨM DỰ KIẾN |
Bước 1: Chuyển giao nhiệm vụ: -GV yêu cầu HS nêu thành phần của nguyên tử và trả lời câu hỏi ?1 sgk trang 14: + Nguyên tử gồm mấy phần? +Mỗi phần của nguyên tử chứa loại hạt nào?
-GV yêu cầu HS hoàn thành bảng khối lượng, điện tích của các loại hạt cấu tạo nên nguyên tử và so sánh khối lượng của electron với proton, neutron. Đưa ra các nhận xét về khối lượng, điện tích nguyên tử: + Hoàn thành bảng sau : + Hãy so sánh khối lượng của electron với proton, neutron. + Đưa ra nhận xét khối lượng của nguyên tử sẽ nằm tập trung ở lớp vỏ nguyên tử hay hạt nhân? Vì sao? + Hãy giải thích tại sao nguyên tử trung hòa về điện? -GV yêu cầu HS hoạt động cá nhân làm câu hỏi ?2,3 sgk trang 14. Bước 2: Thực hiện nhiệm vụ: - HS theo dõi SGK, chú ý nghe, tiếp nhận kiến thức. - HS suy nghĩ trả lời câu hỏi. Bước 3: Báo cáo, thảo luận: - HS giơ tay phát biểu, lên bảng trình bày. - Một số HS khác nhận xét, bổ sung cho bạn. Bước 4: Kết luận, nhận định: - GV tổng quát lưu ý lại kiến thức trọng tâm và yêu cầu HS ghi chép đầy đủ vào vở. | I. Các loại hạt cấu tạo nên nguyên tử. -Thành phần của nguyên tử gồm 2 phần: + Hạt nhân: chứa các proton mang điện tích dương và các neutron không mang điện tích. + Vỏ nguyên tử: chứa các hạt electron mang điện tích âm. + Trả lời câu hỏi ?1 sgk trang 14: Mô hình biểu diễn thành phần cấu tạo của nguyên tử Bảng khối lượng, điện tích của các loại hạt cấu tạo nên nguyên tử + Electron có khối lượng nhỏ hơn proton và neutron khoảng 2000 lần. =>Nhận xét: Khối lượng của nguyên tử tập trung ở hạt nhân vì khối lượng lớp vỏ chứa electron là không đáng kể so với khối lượng hạt nhân. + Nguyên tử trung hòa về điện là do có số hạt proton mang điện tích dương bằng số hạt electron mang điện tích âm: p = e. - Trả lời câu hỏi ?2 sgk trang 14: C - Trả lời câu hỏi ?3 sgk trang 14: Đa số hạt alpha bay xuyên qua lá vàng mỏng với hướng di chuyển không đổi. Một số hạt alpha bị lệch hướng, chứng tỏ có va chạm trước khi bay ra khỏi lá vàng.
|
--------------- Còn tiếp ---------------
PHẦN 2: BÀI GIẢNG POWERPOINT HÓA HỌC 10 KẾT NỐI TRI THỨC
Xin chào các em học sinh! Chào mừng các em đến với bài học mới hôm nay
BÀI 16:
ÔN TẬP CHƯƠNG 4
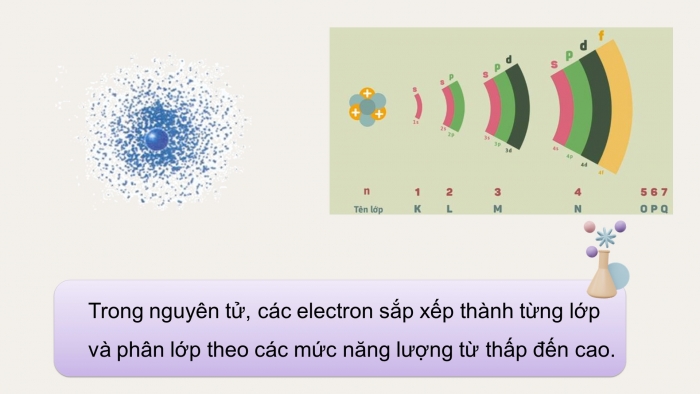
Hệ thống kiến thức
Hoàn thành sơ đồ phản ứng oxi hóa - khử
Phản ứng oxi hóa khử
Chất .............. electron là chất khử
Quá trình oxi hóa là quá trình ................. nhường electron
Chất .............. electron là chất oxi hóa
Quá trình khử là quá trình ................. nhường electron
Lập phương trình hóa học của phản ứng oxi hóa - khử
Nguyên tắc:
Tổng số electron chất khử nhường …….. tổng số electron chất oxi hóa nhận.
Nêu các bước lập phương trình hóa học và cho ví dụ.
Các bước lập phương trình hóa học
Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
Biểu diễn quá trình oxi hóa, quá trình khử.
Các bước lập phương trình hóa học
Tìm hệ số thích hợp cho chất khử, chất oxi hóa dựa trên nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Từ đó, tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Câu 2 (SGK - tr78): Trong phản ứng hóa học: → , mỗi nguyên tử Fe đã
nhường 2 electron
nhận 2 electron
nhường 1 electron
nhận 2 electron
Câu 3 (SGK - tr78): Trong phản ứng hóa học, , chất oxi hóa là
B. C. D.
Câu 4 (SGK - tr78): Cho nước vào dung dịch NaBr xảy ra phản ứng hóa học
Trong phản ứng hóa học trên, xảy ra quá trình oxi hóa chất nào?
B. C. D.
Câu 5 (SGK - tr79): Xét các phản ứng hóa học xảy ra trong các quá trình sau:
Tất cả các phản ứng trong các quá trình a), b), c), d) đều là phản ứng oxi hóa – khử.
Câu 6 (SGK - tr79): Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
Trong công nghiệp, cần trộn thể tích một khối ammonia với bao nhiêu thể tích không khí để thực hiện phản ứng trên? Biết không khí chứa 21% thể tích oxygen và các thể tích khí đo ở cùng điều kiện về nhiệt độ và áp suất.
Câu 7 (SGK - tr79)
a) Lập phương trình hóa học theo các bước như trong SGK:
(1)
Chất oxi hóa là , chất khử là Cu.
b) Nếu cho đồng phế liệu tác dụng với sulfuric acid đặc, nóng theo phản ứng:
(2)
Phương pháp | Tỉ lệ mol | Nhiệt độ | Phát sinh khí gây ô nhiễm |
(1) | 1 : 1 | Thường |
|
(2) | 2 : 1 | Đun nóng | SO2 |
--------------- Còn tiếp ---------------
PHẦN 3: TÀI LIỆU THAM KHẢO ĐƯỢC TẶNG KÈM
1. TRỌN BỘ TRẮC NGHIỆM HÓA HỌC 10 KẾT NỐI
Bộ trắc nghiệm Hóa học 10 kết nối tri thức tổng hợp câu hỏi 4 mức độ khác nhau: nhận biết, thông hiểu, vận dụng, vận dụng cao
CHƯƠNG I: CẤU TẠO NGUYÊN TỬ
Bài 2: Nguyên tố hóa học
A. TRẮC NGHIỆM
1. NHẬN BIẾT (15 câu)
Câu 1: Nguyên tố hóa học là
A. Tập hợp các nguyên tử có cùng số neutron trong hạt nhân.
B. Tập hợp các nguyên tử có cùng số khối.
C. Tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân.
D. Tập hợp các nguyên tử có cùng tổng số hạt trong nguyên tử.
Câu 2: Số hiệu nguyên tử cho biết thông tin nào sau đây
A. Nguyên tử khối.
B. Số khối.
C. Số proton.
D. Số neutron.
Câu 3: Phát biểu nào sau đây không đúng
A. Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số proton và bằng số neutron.
B. Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân.
C. Số khối của hạt nhân bằng tổng số proton và neutron.
D. Nguyên tố hóa học là những nguyên tử có cùng số đơn vị điện tích hạt nhân.
Câu 4: Đặc trưng cơ bản của một nguyên tử là
A. Số neutron trong hạt nhân nguyên tử.
B. Số đơn vị điện tích hạt nhân và số khối.
C. Số đơn vị điện tích hạt nhân và số electron trong vỏ nguyên tử.
D. Số proton và số electron trong vỏ nguyên tử.
Câu 5: Điền từ còn thiếu vào chỗ trống
“Khi viết kí hiệu nguyên tử, đặt hai chỉ số đặc trưng ở (1)…….. bên trái kí hiệu nguyên tố, trong đó số hiệu nguyên tử Z ở (2)…….. và số khối A ở (3)……..”
A. (1) bên trái; (2) phía dưới; (3) phía trên.
B. (1) bên trái; (2) phía trên; (3) phía dưới.
C. (1) bên phải; (2) phía trên; (3) phía dưới.
D. (1) bên phải; (2) phía dưới; (3) phía trên.
Câu 6: Kí hiệu nguyên tử nào sau đây viết đúng
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Câu 7: Thông tin nào sau đây không đúng về ![]()
A. Số khối là 64.
B. Tổng số proton và neuton là 64.
C. Số neuton là 30.
D. Số đơn vị điện tích hạt nhân là 29.
Câu 8: Đồng vi là
A. Những nguyên tử có cùng số khối, cùng số proton nhưng có số neutron khác nhau.
B. Những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số electron khác nhau.
C. Những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số neuton) nhưng có số proton khác nhau.
D. Những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau.
Câu 9: Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hóa học
A. ![]() ,
, ![]() ,
, ![]() .
.
B. ![]() ,
, ![]() ,
, ![]() .
.
C. ![]() ,
, ![]() ,
, ![]() .
.
D. ![]() ,
, ![]() ,
, ![]() .
.
Câu 10: Điền từ còn thiếu vào chỗ trống
“Nguyên tử khối là khối lượng (1)…….. của nguyên tử. Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần (2)……..”
A. (1) tương đối; (2) đơn vị khối lượng nguyên tử.
B. (1) tuyệt đối; (2) nguyên tử hydrogen.
C. (1) tuyệt đối; (2) nguyên tử carbon.
D. (1) tương đối; (2) nguyên tử carbon.
Câu 11: Nguyên tử khối của một nguyên tố là
A. Nguyên tử khối trung bình của hỗn hợp các đồng vị của nguyên tố đó.
B. Nguyên tử khối trung bình của hỗn hợp các đồng đẳng của nguyên tố đó.
C. Nguyên tử khối trung bình của hỗn hợp các đồng phân của nguyên tố đó.
D. Nguyên tử khối trung bình của hỗn hợp các dạng thù hình của nguyên tố đó.
Câu 12: Chọn đáp án sai
A. Có thể coi nguyên tử khối xấp xỉ số khối.
B. Nguyên tử khối trung bình kí hiệu là Å.
C. Hầu hết các nguyên tố trong tự nhiên là hỗn hợp của nhiều đồng vị.
D. Mỗi đồng vị của các nguyên tố có tỉ lệ phần trăm số nguyên tử không cố định.
Câu 13: Chọn đáp án đúng
A. Nguyên tử của nguyên tố hydrogen luôn có 2 proton.
B. Nguyên tử của nguyên tố hydrogen có thể không có neutron.
C. Nguyên tử của nguyên tố hydrogen luôn có số khối bằng 1.
D. Nguyên tố hydrogen luôn có số khối bằng 2.
Câu 14: Biết X và Y,… lần lượt là nguyên tử khối của các đồng vi X và Y,…; a và b,… lần lượt là % số nguyên tử của các đồng vị X và Y,… Biểu thức tổng quát tính nguyên tử khối trung bình
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Câu 15: Nguyên tử của nguyên tố potassium có số proton = 19; số neutron = 20. Nguyên tử khối của potassium là
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. 58.
--------------- Còn tiếp ---------------
2. TRỌN BỘ ĐỀ THI HÓA HỌC 10 KẾT NỐI
Bộ đề Hóa học 10 kết nối biên soạn đầy đủ gồm: đề thi+ đáp án + bảng ma trận và bảng đặc tả
MA TRẬN ĐỀ THI HỌC KÌ 2
MÔN: HÓA HỌC 10 – KẾT NỐI TRI THỨC
Số TT | Nội dung kiến thức | Đơn vị kiến thức | Mức độ nhận thức | Tổng số câu | Tổng % điểm | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Nhận biết | Thông hiểu | Vận dụng | Vận dụng cao | ||||||||||
TN | TL | TN | TL | TN | TL | TN | TL | TN | TL | ||||
1 | Phản ứng oxi hóa khử | Số oxi hóa | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 1 | 20% |
Phản ứng oxi hóa – khử | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 2 | ||||
2 | Năng lượng hóa học | Phản ứng hóa học và enthalpy | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 15% |
Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 3 | ||||
3 | Tốc độ phản ứng hóa học | Tốc độ phản ứng hóa học | 4 | 0 | 4 | 0 | 0 | 0 | 0 | 0 | 8 | 0 | 20% |
4 | Nguyên tố nhóm VIIA | Nguyên tố và đơn chất halogen | 3 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 5 | 0 | 45% |
Hydrogen halide và hydrohalic acid | 3 | 0 | 2 | 0 | 0 | 0 | 0 | 1 | 5 | 1 | |||
Tổng số câu | 16 | 0 | 12 | 0 | 0 | 1 | 0 | 1 | 28 | 2 |
| ||
Tỉ lệ % | 40% | 30% | 15% | 15% |
|
|
| ||||||
Tỉ lệ chung | 70% | 30% |
|
|
| ||||||||
BẢNG ĐẶC TẢ KĨ THUẬT ĐỀ THI HỌC KÌ 2
MÔN: HÓA HỌC 10 – KẾT NỐI TRI THỨC
TT | Nội dung kiến thức | Đơn vị kiến thức | Mức độ kiến thức, kĩ năng cần kiểm tra, đánh giá | Số câu hỏi theo các mức độ nhận thức | Tổng | |||
NB | TH | VD | VCD | |||||
1 | Phản ứng oxi hóa – khử | Số oxi hóa | Nhận biết: Số oxi hóa của nguyên tố trong đơn chất, hợp chất Thông hiểu: Xác định được số oxi hóa của nguyên tố trong một số hợp chất cụ thể |
1 |
1 |
|
|
2 |
Phản ứng oxi hóa – khử | Nhận biết: Khái niệm chất oxi hóa, chất khử, sự oxi hóa, sự khử Thông hiểu: Xác định được chất oxi hóa, chất khử, quá trình oxi hóa, quá trình khử trong phản ứng oxi hóa khử Vận dụng: Lập được phương trình hóa học của một số phản ứng oxi hóa – khử |
1 |
1 |
1 |
|
3 | ||
2 | Năng lượng hóa học | Phản ứng hóa học và enthalpy | Nhận biết: - Dự đoán các phản ứng hóa học là phản ứng tỏa nhiệt hay thu nhiệt - Trình bày được khái niệm phản ứng tỏa nhiệt, thu nhiệt, điều kiện chuẩn Thông hiểu: Đếm số phát biểu đúng sai liên quan đến biến thiên enthalpy |
2 |
1 |
|
|
3 |
Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học | Nhận biết: - Nêu được ý nghĩa của dấu và giá trị - Dựa vào nhiệt phản ứng xác định phản ứng là tỏa nhiệt hay thu nhiệt. Thông hiểu: Đếm số phát biểu đúng sai liên quan đến ý nghĩa biến thiên enthalpy |
2 |
1 |
|
|
3 | ||
3 | Tốc độ phản ứng hóa học | Tốc độ phản ứng hóa học | Nhận biết: - Trình bày được khái niệm tốc độ phản ứng hóa học và cách tính tốc độ trung bình của phản ứng. - Viết được biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ. - Nêu được ý nghĩa của hệ số nhiệt đới Van’t Hoff ( Thông hiểu: - Giải thích được các yếu tố ảnh hưởng tới tốc độ phản ứng như: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. - Tính được tốc độ trung bình của một phản ứng hóa học - Vận dụng được kiến thức tốc độ phản ứng hóa học vào việc giải thích một số vấn đề trong cuộc sống và sản xuất. |
4 |
4 |
|
|
8 |
4 | Nguyên tố nhóm VIIA | Nguyên tố và đơn chất halogen | Nhận biết: - Phát biểu được trạng thái tự nhiên của các nguyên tố halogen - Chỉ ra được trạng thái, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen. - Chỉ ra được hiện tượng của các thí nghiệm so sánh tính oxi hóa của các halogen Thông hiểu - Viết sản phẩm phản ứng thể hiện tính chất của đơn chất halogen - Tính thể tích khí chlorine (ở đktc) tạo thành trong phản ứng đơn giản - So sánh được tính oxi hóa giữa các halogen Vận dụng: Bài tập liên quan đến tính chất hóa học của các đơn chất halogen |
3 |
2 |
1
|
|
6 |
Hydrogen halide và hydrohalic acid | Nhận biết: - Trình bày được xu hướng biến đổi tính acid của dãy hydrohalic acid. - Chỉ ra được hiện tượng của phản ứng khi cho dung dịch AgNO3 tác dụng với ion X- - Nêu được ứng dụng của một số hydrogen halide Thông hiểu: - Tính được khối lượng kim loại trong phản ứng đơn giản có HCl tham gia - Viết được PTHH thể hiện tính chất hóa học của các acid HX. Vận dụng cao: Vận dụng giải bài tập liên quan đến hydrohalic acid, ion halide X |
3 |
2 |
|
1 |
6 | ||
Tổng |
| 16 | 12 | 2 | 1 | 31 | ||
Tỉ lệ % từng mức độ nhận thức |
| 40% | 30% | 20% | 10% | 100% | ||
Tỉ lệ chung |
| 70% | 30% |
| ||||
ĐỀ KIỂM TRA HỌC KÌ 2
MÔN: HÓA HỌC 10 – KẾT NỐI TRI THỨC
Phần I: Trắc nghiệm (7 điểm)
Câu 1. Số oxi hóa của carbon trong hợp chất CH4 là:
A. +1
B. – 1
C. + 4
D. – 4
Câu 2. Cho các hợp chất sau: SO2; H2SO4; Na2SO4; Na2S; CaSO3. Số hợp chất trong đó sulfur có số oxi hóa +4 là
A. 1
B. 2
C. 3
D. 4
Câu 3. Cho các phản ứng hóa học sau, phản ứng oxi hóa – khử là
A. NaOH + HCl ![]() NaCl + H2O
NaCl + H2O
B. CuO + H2SO4 ![]() CuSO4 + H2O
CuSO4 + H2O
C. K2CO3 + 2HCl ![]() 2KCl + CO2 + H2O
2KCl + CO2 + H2O
D. 2KClO3 ![]() 2KCl + 3O2
2KCl + 3O2
Câu 4. Cho phản ứng hóa học sau: Fe + 2HCl ![]() FeCl2 + H2. Chất bị oxi hóa là
FeCl2 + H2. Chất bị oxi hóa là
A. Fe
B. HCl
C. FeCl2
D. H2
Câu 5. Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:
CO (g) + ![]() (g)
(g) ![]() CO2(g)
CO2(g) ![]()
Ở điều kiện chuẩn, nếu đốt cháy 12,395 L khí CO thì nhiệt lượng tỏa ra là
A. – 852,5 kJ
B. – 426, 25 kJ
C. 852,5 kJ
D. 426,25 kJ
Câu 6. Cho các phương trình nhiệt hóa học sau:
(1) C2H4(g) + H2(g) ![]() C2H6(g)
C2H6(g) ![]()
(2) Fe2O3(s) + 2Al(s) ![]() Al2O3(s) + 2Fe(s)
Al2O3(s) + 2Fe(s) ![]()
Nhận xét nào sau đây là đúng?
A. Cả hai phản ứng đều tỏa nhiệt
B. Cả hai phản ứng đều thu nhiệt
C. Phản ứng (1) tỏa nhiệt, phản ứng (2) thu nhiệt
D. Phản ứng (1) thu nhiệt, phản ứng (2) tỏa nhiệt
Câu 7. Cho phương trình nhiệt hóa học sau:
N2(g) + O2(g) ![]() 2NO(g)
2NO(g) ![]()
Nhiệt tạo thành chuẩn của NO(g) là
A. +180,6 kJ/mol
B. -180,6 kJ/mol
C. +90,3 kJ/mol
D. -90,3 kJ/mol
Câu 8. Nhiệt lượng tỏa ra hay thu vào của phản ứng ở một điều kiện xác định được gọi là
A. biến thiên nhiệt lượng của phản ứng
B. biến thiên enthalpy của phản ứng
C. enthalpy của phản ứng
D. biến thiên năng lượng của phản ứng
Câu 9. Công thức tính biến thiên enthalpy chuẩn của phản ứng theo năng lượng liên kết là
A. ![]()
![]()
B. ![]()
![]()
C. ![]()
![]()
D. ![]()
![]()
Câu 10. Cho phản ứng: 2NaCl(s) ![]() 2Na(s) + Cl2(g). Biết
2Na(s) + Cl2(g). Biết ![]() (NaCl) = - 411,2 kJmol-1. Biến thiên enthalpy chuẩn của phản ứng này là
(NaCl) = - 411,2 kJmol-1. Biến thiên enthalpy chuẩn của phản ứng này là
A. -822,4 kJ
B. +822,4 kJ
C. -411,2 kJ
D. +411,2 kJ
Câu 11. Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
A. Tốc độ phản ứng
B. Cân bằng hóa học
C. Phản ứng một chiều
D. Phản ứng thuận nghịch
Câu 12. Cho phản ứng phân hủy N2O5 như sau: 2N2O5(g) ![]() 4NO2(g) + O2(g)
4NO2(g) + O2(g)
Tại thời điểm ban đầu, nồng độ của N2O5 là 0,02M; Sau 100s, nồng độ N2O5 còn 0,0169M. Tốc độ trung bình của phản ứng phân hủy N2O5 trong 100s đầu tiên là
A. 1,55.10-5 (mol/(L.s))
B. 1,55.10-5 (mol/(L.min))
C. 1,35.10-5 (mol/(L.s))
D. 1,35.10-5 (mol/(L.min))
Câu 13. Cho phản ứng đơn giản như sau: 2NO + O2 ![]() 2NO2. Mối liên hệ giữa tốc độ phản ứng và nồng độ các chất tham gia phản ứng là:
2NO2. Mối liên hệ giữa tốc độ phản ứng và nồng độ các chất tham gia phản ứng là:
A. 1,55.10-5 (mol/(L.s))
B. 1,55.10-5 (mol/(L.min))
C. 1,35.10-5 (mol/(L.s))
D. 1,35.10-5 (mol/(L.min))
Câu 14. Việc làm nào dưới đây thể hiện sự ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng: CaCO3(s) + 2HCl(aq) ![]() CaCl2(aq) + CO2(aq) + H2O(l)
CaCl2(aq) + CO2(aq) + H2O(l)
A. Pha loãng dung dịch HCl
B. Nghiền nhỏ đá vôi CaCO3
C. Sử dụng chất xúc tác
D. Tăng nhiệt độ của phản ứng
--------------- Còn tiếp ---------------

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
=> Giáo án hóa học 10 kết nối tri thức (bản word)
Từ khóa: Giáo án và PPT đồng bộ Hoá học 10 kết nối tri thức, soạn giáo án word và powerpoint Hoá học 10 kết nối tri thức, soạn Hoá học 10 kết nối tri thứcTài liệu giảng dạy môn Hóa học THPT
