Giáo án điện tử KHTN 8 kết nối Bài 11: Muối
Bài giảng điện tử Khoa học tự nhiên 8 (Hoá học) kết nối tri thức. Giáo án powerpoint Bài 11: Muối. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt, tạo hứng thú học tập cho học sinh. Thầy, cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 8 kết nối tri thức
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét









Xem toàn bộ: Giáo án điện tử hoá học 8 kết nối tri thức
CHÀO MỪNG CÁC EM ĐẾN VỚI TIẾT HÓA HỌC!
KHỞI ĐỘNG
Muối ăn (NaCl)
> Đóng vai trò vô cùng quan trọng đối với hoạt động trao đổi chất của con người.
Đá vôi (CaCO3)
> Dùng để sản xuất vôi sống, làm đường, làm bê tông, chất độn trong sản xuất cao su, xà phòng,…
Diêm tiêu (KNO3)
> Sử dụng để chế tạo thuốc nổ đen, bảo quản thực phẩm, điều chế oxygen trong phòng thí nghiệm.
Muối ăn, đá vôi hay diêm tiêu đều là muối. Vậy muối là gì, chúng có tính chất hóa học như thế nào?
BÀI 11. MUỐI
NỘI DUNG BÀI HỌC
Khái niệm
Tính tan của muối
Tính chất hoá học
Điều chế
Mối quan hệ giữa các hợp chất vô cơ
- KHÁI NIỆM
THẢO LUẬN NHÓM
BẢNG 11.1. PHẢN ỨNG TẠO THÀNH MUỐI, TÊN GỌI VÀ THÀNH PHẦN PHÂN TỬ CỦA MỘT SỐ MUỐI | |||
Phản ứng | Công thức phân tử của muối tạo thành và tên gọi | Thành phần phân tử của muối tạo thành | |
Cation kim loại | Anion gốc acid | ||
Kim loại + Acid → Muối + Hydrogen Zn + 2HCl → ZnCl2 + H2 | ZnCl2 Zinc chloride | Zn2+ | Cl- |
Acid + Base → Muối + Nước H2SO4 + Cu(OH)2 → CuSO4 + 2H2O | CuSO4 Copper(II) sulfate | Cu2+ | |
Acid + Oxide base → Muối + Nước H2SO4 + FeO → FeSO4 + H2O | FeSO4 Iron(II) sulfate | Fe2+ | |
Em hãy quan sát Bảng 11.1 và thực hiện các yêu cầu sau:
- Nhận xét về sự khác nhau giữa thành phần phân tử của acid (chất phản ứng) và muối (chất sản phẩm). Đặc điểm chung của các phản ứng ở Bảng 11.1 là gì?
- Nhận xét về cách gọi tên muối.
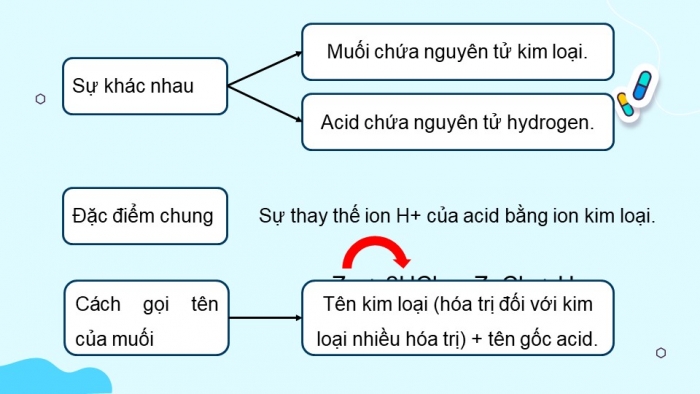
Sự khác nhau
- Muối chứa nguyên tử kim loại.
- Acid chứa nguyên tử hydrogen.
Đặc điểm chung
- Sự thay thế ion H+ của acid bằng ion kim loại.
Cách gọi tên của muối
Zn + 2HCl → ZnCl2 + H2
Tên kim loại (hóa trị đối với kim loại nhiều hóa trị) + tên gốc acid.
Thành phần phân tử của acid và muối khác nhau ở chỗ muối chứa nguyên tử kim loại và acid chứa nguyên tử hydrogen.
Đặc điểm chung của các phản ứng ở bảng 11.1 là sự thay thế ion H+ của acid bằng ion kim loại.
Cách gọi tên của muối: tên kim loại (hóa trị đối với kim loại nhiều hóa trị) + tên gốc acid.
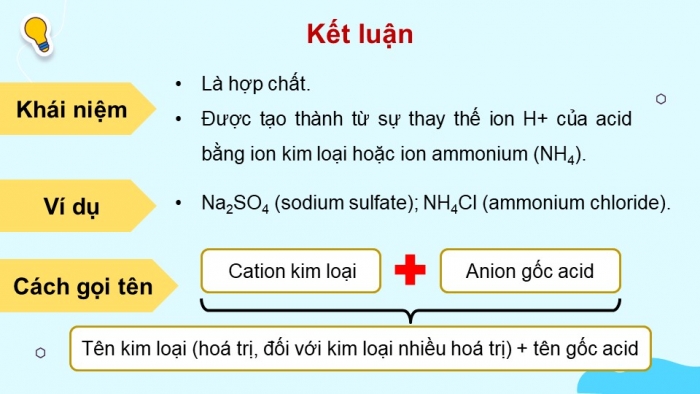
Kết luận
Khái niệm
- Là hợp chất.
- Được tạo thành từ sự thay thế ion H+ của acid bằng ion kim loại hoặc ion ammonium (NH4).
Ví dụ
- Na2SO4 (sodium sulfate); NH4Cl (ammonium chloride).
Cách gọi tên
Cation kim loại
Anion gốc acid
Tên kim loại (hoá trị, đối với kim loại nhiều hoá trị) + tên gốc acid
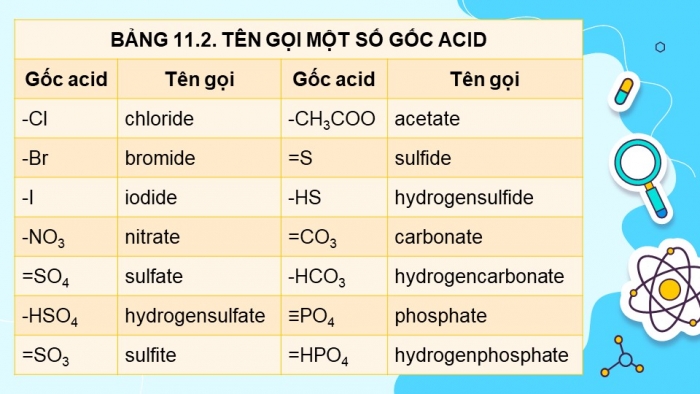
BẢNG 11.2. TÊN GỌI MỘT SỐ GỐC ACID | |||
Gốc acid | Tên gọi | Gốc acid | Tên gọi |
-Cl | chloride | -CH3COO | acetate |
-Br | bromide | =S | sulfide |
-I | iodide | -HS | hydrogensulfide |
-NO3 | nitrate | =CO3 | carbonate |
=SO4 | sulfate | -HCO3 | hydrogencarbonate |
-HSO4 | hydrogensulfate | ≡PO4 | phosphate |
=SO3 | sulfite | =HPO4 | hydrogenphosphate |
Em hãy hoàn thành câu hỏi mục I – SGK tr.49 và Phiếu học tập số 1:
- Viết công thức của các muối sau: potassium sulfate, sodium hydrogensulfate, sodium hydrogencarbonate, sodium chloride, sodium nitrate, calcium hydrogenphosphate, magnesium sulfate, copper(II) sulfate.
- Gọi tên các muối sau: AlCl3, KCl, Al2(SO4)3, MgSO4, NH4NO3, NaHCO3.
- Viết phương trình hoá học của phản ứng tạo thành muối KCl và MgSO4.
Câu 1
Tên gọi muối | Công thức |
potassium sulfate | K2SO4 |
sodium hydrogensulfate | NaHSO4 |
sodium hydrogencarbonate | NaHCO3 |
sodium chloride | NaCl |
sodium nitrate | NaNO3 |
calcium hydrogenphosphate | CaHPO4 |
magnesium sulfate | MgSO4 |
copper(II) sulfate | CuSO4 |
Câu 2
Muối | Tên các muối |
AlCl3 | aluminium chloride |
KCl | potassium chloride |
Al2(SO4)3 | aluminium sulfate |
MgSO4 | magnesium sulfate |
NH4NO3 | ammonium nitrate |
NaHCO3 | sodium hydrocarbonate |
Câu 3
Phản ứng tạo muối KCl:
KOH + HCl -> KCl + H2O
Phản ứng tạo muối MgSO4:
Mg + H2SO4 -> MgSO4 + H2
PHIẾU HỌC TẬP SỐ 1
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 8 kết nối tri thức
ĐẦY ĐỦ GIÁO ÁN CÁC BỘ SÁCH KHÁC
GIÁO ÁN WORD LỚP 8 KẾT NỐI TRI THỨC
Giáo án ngữ văn 8 kết nối tri thức đủ cả năm
Giáo án địa lí 8 kết nối tri thức đủ cả năm
Giáo án lịch sử 8 kết nối tri thức đủ cả năm
Giáo án khoa học tự nhiên 8 kết nối tri thức đủ cả năm
Giáo án vật lí 8 kết nối tri thức đủ cả năm
Giáo án sinh học 8 kết nối tri thức đủ cả năm
Giáo án hóa học 8 kết nối tri thức đủ cả năm
Giáo án tin học 8 kết nối tri thức đủ cả năm
Giáo án công dân 8 kết nối tri thức đủ cả năm
Giáo án công nghệ 8 kết nối tri thức đủ cả năm
Giáo án âm nhạc 8 kết nối tri thức đủ cả năm
Giáo án thể dục 8 kết nối tri thức đủ cả năm
Giáo án mĩ thuật 8 kết nối tri thức đủ cả năm
Giáo án hoạt động trải nghiệm 8 kết nối tri thức đủ cả năm
GIÁO ÁN POWERPOINT LỚP 8 KẾT NỐI TRI THỨC
GIÁO ÁN DẠY THÊM LỚP 8 KẾT NỐI TRI THỨC
Giáo án dạy thêm toán 8 kết nối tri thức đủ cả năm
CÁCH ĐẶT MUA:
Liên hệ Zalo: Fidutech - nhấn vào đây
