Giáo án kì 1 hoá học 8 kết nối tri thức
Đồng bộ giáo án Word + PPT kì 1 Khoa học tự nhiên 8 (Hoá học) kết nối tri thức. Giáo án word chi tiết, trình bày rõ ràng, khoa học theo CV 5512. Giáo án powerpoint nhiều hình ảnh, sinh động. Nhất định tiết học sẽ hứng thú, sáng tạo cho học sinh. Cách tải về dễ dàng. Giáo án có đủ kì 1 + kì 2 môn Hoá học 8 KNTT.
Click vào ảnh dưới đây để xem giáo án rõ







Một số tài liệu quan tâm khác
Phần trình bày nội dung giáo án
I. GIÁO ÁN KÌ 1 HOÁ HỌC 8 KẾT NỐI TRI THỨC
CHƯƠNG I. PHẢN ỨNG HÓA HỌC
- Giáo án Hoá học 8 kết nối bài 2 Phản ứng hóa học
- Giáo án Hoá học 8 kết nối bài 3 Mol và tỉ khối chất khí
- Giáo án Hoá học 8 kết nối bài 4 Dung dịch và nồng độ
- Giáo án Hoá học 8 kết nối bài 5 Định luật bảo toàn khối lượng và phương trình hóa học
- Giáo án Hoá học 8 kết nối bài 6 Tính theo phương trình hóa học
- Giáo án Hoá học 8 kết nối bài 7 Tốc độ phản ứng và chất xúc tác
CHƯƠNG II. MỘT SỐ HỢP CHẤT THÔNG DỤNG
- Giáo án Hoá học 8 kết nối bài 8 Acid
- Giáo án Hoá học 8 kết nối bài 9 Base. Thang pH
- Giáo án Hoá học 8 kết nối bài 10 Oxide
- Giáo án Hoá học 8 kết nối bài 11 Muối
- Giáo án Hoá học 8 kết nối bài 12 Phân bón hóa học
=> Xem nhiều hơn: Giáo án hoá học 8 kết nối tri thức đủ cả năm
II. GIÁO ÁN WORD HOÁ HỌC 8 KÌ 1 KẾT NỐI TRI THỨC
Giáo án Word bài: Định luật bảo toàn khối lượng và phương trình hóa học
Ngày soạn:…/…/…
Ngày dạy:…/…/…
BÀI 5: ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG VÀ PHƯƠNG TRÌNH HÓA HỌC
- MỤC TIÊU
- Kiến thức
Sau bài học này, HS sẽ:
- Tiến hành được thí nghiệm chứng minh: trong phản ứng hóa học, khối lượng được bảo toàn.
- Phát biểu được định luật bảo toàn khối lượng.
- Nêu được khái niệm phương trình hóa học và các bước lập phương trình hóa học.
- Trình bày được ý nghĩa của phương trình hóa học.
- Lập được sơ đồ phản ứng hóa hoc dạng chữ và phương trình hóa học (dùng công thức hóa học) của một số phản ứng hóa học cụ thể
- Năng lực
Năng lực chung:
- Năng lực tự chủ và tự học: Chủ động, tích cực tìm hiểu về phương trình hóa học, định luật bảo toàn khối lượng .
- Năng lực giao tiếp và hợp tác: Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV, tích cực tham gia các hoạt động trong lớp.
- Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
Năng lực khoa học tự nhiên:
- Nhận thức khoa học tự nhiên: phát biểu được định luật bảo toàn khối lượng và nêu được khái niệm, ý nghĩa của phương trình hóa học.
- Tìm hiểu tự nhiên: Tiến hành hành được thí nghiệm chứng minh: trong phản ứng hóa học, khối lượng được bảo toàn
- Vận dụng kiến thức, kĩ năng đã học: Giải thích được các hiện tượng thực tế, vận dụng kiến thức PTHH và định luật bào toàn khối lượng để tính toán lượng chất trong quá trình sản xuất và trong đời sống như tính dược khối lượng đá vôi cần thiết để sannr xuất vôi sống..
- Phẩm chất
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Cẩn thận, trung thực và thực hiện các yêu cầu trong bài học.
- Có niềm say mê, hứng thú với việc khám phá và học tập khoa học tự nhiên.
- THIẾT BỊ DẠY HỌC
- Đối với giáo viên
- SGK, SGV, SBT KHTN 8 phần Hóa học.
- Tranh ảnh, video liên quan đến bài học, phiếu học tập, phiếu bài tập.
- Các đồ dùng thí nghiệm.
- Máy chiếu, bảng nhóm.
- Đối với học sinh
- SGK, SBT KHTN 8 phần Hóa học.
- Tranh ảnh, tư liệu sưu tầm liên quan đến bài học và dụng cụ học tập (nếu cần) theo yêu cầu của GV.
III. TIẾN TRÌNH DẠY HỌC
- HOẠT ĐỘNG KHỞI ĐỘNG
- Mục tiêu: GV hướng dẫn HS hình thành tư duy tỏng quan cho bài học. Từ đó khám phá, tìm tòi và chủ động việc tìm kiếm kiến thức mới về định luật bảo toàn khối lượng.
- Nội dung: GV đặt vấn đề “Khi các phản ứng hóa học xảy ra, lượng các chất phản ứng giảm dần. Lượng các chất sản phẩm tăng dần. Vậy tổng khối lượng các chất trước và sau phản ứng có thay đổi hay không?”
- Sản phẩm học tập: HS trả lời được câu hỏi theo ý kiến cá nhân.
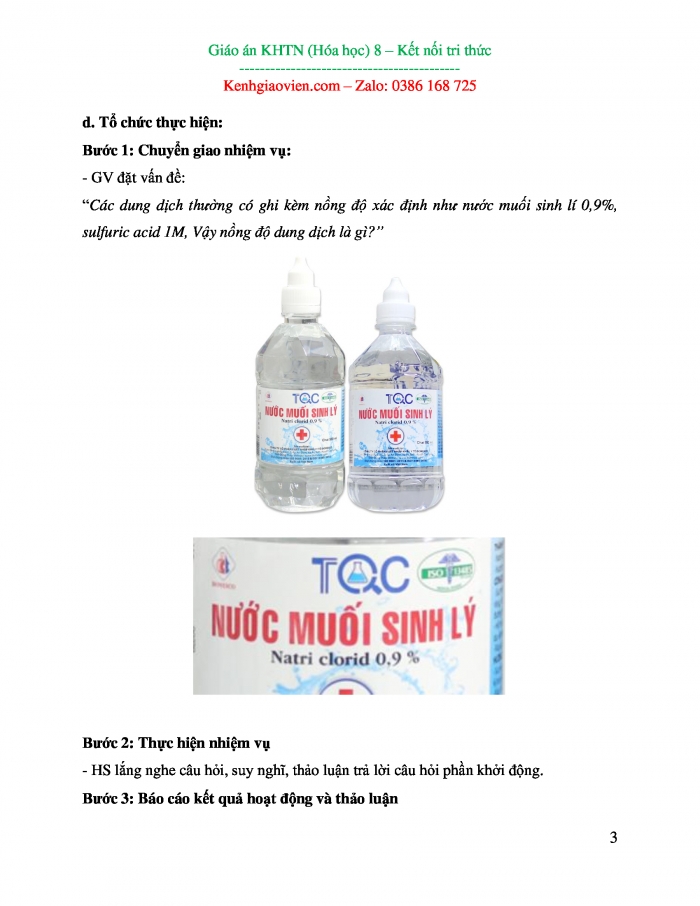
- Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV đặt vấn đề:
“Khi các phản ứng hóa học xảy ra, lượng các chất phản ứng giảm dần. Lượng các chất sản phẩm tăng dần. Vậy tổng khối lượng các chất trước và sau phản ứng có thay đổi hay không?”
Bước 2: Thực hiện nhiệm vụ
- HS lắng nghe câu hỏi, suy nghĩ, thảo luận trả lời câu hỏi phần khởi động.
Bước 3: Báo cáo kết quả hoạt động và thảo luận
- HS đưa ra những nhận định ban đầu.
Bước 4: Kết luận, nhận định
- GV đánh giá câu trả lời của HS, trên cơ sở đó dẫn dắt HS vào bài học: Để biết chính xác tổng khối lượng các chất trước và sau phản ứng có thay đổi hay không, chúng ta cùng đi vào bài học ngày hôm nay – Bài 5 - Định luật bảo toàn khối lượng và phương trình hóa học.
- HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
- ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG
Hoạt động 1: Tìm hiểu về định luật bảo toàn khối lượng.
- Mục tiêu: HS chứng minh được sự bảo toàn khối lượng của các chất trước và sau phản ứng thông qua các thí nghiệm.
- Nội dung: Các nhóm HS thực hành thí nghiệm trong sgk từ đó rút ra nhận xét về sự bảo toàn khối lượng, nêu được lịch sử ra đời của định luật bảo toàn khối lượng.
- Sản phẩm học tập: Kết quả cho thí nghiệm trong sgk và lịch sử ra đời của định luật bảo toàn khối lượng.
- Tổ chức hoạt động:
|
HOẠT ĐỘNG CỦA GV - HS |
DỰ KIẾN SẢN PHẨM |
||||||||||||
|
Bước 1: Chuyển giao nhiệm vụ: - GV chia lớp thành 4-6 nhóm tiến hành thực hành thí nghiệm sgk trang 24: - Thí nghiệm BaCl2 + Na2SO4. Chuẩn bị: Dung dịch barium chloride, sodium sulfate, cân điện, cốc thủy tinh. Tiến hành: + Trên mặt cân đặt 2 cốc: cốc (1) đựng dung dịch barium cloride, cốc (2) đựng dung dịch sodium sulfate. Ghi tổng khối lượng 2 cốc (m1). + Đổ cốc (1) vào cốc (2), lắc nhẹ để hai dung dịch trộn lẫn với nhau. Quan sát thấy có một chất rắn xuất hiện ở cốc (2). Phản ứng xảy ra như sau: Barium chloride + Sodium sulfate → Barium sulfate + Sodium chloride. Đặt hai cốc trở lại mặt cân. Ghi khối lượng (m2). Thực hiện yêu cầu: So sánh tổng khối lượng các chất trước phản ứng với tổng khối lượng các chất sau phản ứng.
- GV yêu cầu 1 nhóm HS giới thiệu lịch sử ra đời của định luật bào toàn khối lượng đã tìm hiểu trước ở nhà.
- GV yêu cầu nhóm đôi HS quan sát hình ảnh sau kết hợp đọc thông tin trong sgk, hãy giải thích cơ sở của định luật bảo toàn khối lượng và trả lời câu hỏi mục I.1 sgk trang 25 Carbon tác dụng với oxygen theo sơ đồ Hình 5.1: Giải thích tại sao khối lượng carbon dioxide bằng tổng khối lượng carbon và oxygen.
- GV hướng dẫn HS áp dụng định luật bảo toàn khối lượng để tính khối lượng chất tham gia hoặc chất tạo thành trong một phản ứng kgi biết khối lượng chất còn lại.
- GV yêu cầu HS hoạt động nhóm 4, thảo luận và hoàn thành phiếu học tập số 1 ( đính kèm dưới hoạt động 1) Bước 2: Thực hiện nhiệm vụ - Nhóm HS thực hành thí nghiệm (hoặc quan sát GV làm thí nghiệm) và trả lời câu hỏi. - GV hướng dẫn, theo dõi, hỗ trợ HS nếu cần thiết. Bước 3: Báo cáo kết quả hoạt động và thảo luận - Đại diện HS trả lời câu hỏi - GV mời HS khác nhận xét, bổ sung. Bước 4: Kết luận, nhận định - GV đánh giá, nhận xét, chuẩn kiến thức |
I. Định luật bảo toàn khối lượng. 1. Nội dung định luật bảo toàn khối lượng.
- Lịch sử ra đời của định luật bảo toàn khối lượng: Khi cân bình nút kin đựng bột kim loại trước và sau khi nung, M.V. Lomonosov nhận thấy rằng khối lượng của chúng không thai đổi, mặc dù những chuyển hóa hóa học đã xảy ra với kim loại trong bình. Khi áp dụng các phương pháp định lượng nghiên cứu phản ứng hóa học, năm 1748, M.V. Lomonosov đã tìm ra được một trong những định luật quan trong nhất của tự nhiên, mang tên định luật bảo toàn khối lượng. Ông trình bày định luật đó như sau: “Tất cả những biến đổi xảy ra trong tự nhiên thực chất là nếu lấy đi bao nhiêu ở vật thể này, thì có bấy nhiêu được thêm vào ở vật thể khác. Như vậy, nếu ở đây giảm đi bao nhiêu vật chất, thì sẽ có từng đấy vật chất tăng lên ở chỗ khác”. Cùng thời điểm đó A.L. Lavoisier cũng tiến hành được thí nghiệm độc lập chứng minh được sự bảo toàn khối lượng trong các phản ứng hóa học. Hiện nay định luật bảo toàn khối lượng của các chất được phát biểu như sau: “Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng”.
- Giải thích cơ sở của định luật bảo toàn khối lượng: Trong các phản ứng hóa học, chỉ có liên kết giữa các nguyên tử thay đổi, còn số nguyên tử của mỗi nguyên tố hóa học vẫn giữ nguyên, vì vậy tổng khối lượng của các chất tham gia phản ứng bằng tổng khối lượng của các sản phẩm. - Đáp án câu hỏi mục I.1 sgk trang 25: Trong sơ đồ phản ứng, số nguyên tử C trước và sau phản ứng đều là 1, số nguyên tử O trước và sau phản ứng đều là 2, do đó khối lượn chúng khống thay đổi, nghĩa là khối lượng carbon di oxide bằng tổng khối lượng của carbon và oxygen.
2. Áp dụng định luật bảo toàn khối lượng. VD: Biết khối lượng barium chloride và sodium sulfate đã phản ứng lần lượt lad 20,8 gam và 14,2 gam, khối lượng của bari sulfate tạo thành là 23,3 gam. Khối lượng sodium chloride tạo thành là bao nhiêu? Bài giải Theo định luật bảo toàn khối lượng ta có: mBari chloride + mSodium sulfate = mBari sulfate + mSodium chloride 20,8 + 14,2 -23,3 = 11,7 (g) Tổng quát: Nếu trong phản ứng có n chất, khi biết khối lượng đã tham gia và tạo thành của (n-1) chất, ta sẽ xác định được khối lượng của chất còn lại.
- Đáp án phiếu học tập số 1 (đính kèm dưới hoạt động 1)
|
|
PHIẾU HỌC TẬP SỐ 1 Câu 1: Sau khi đốt cháy than tổ ong ( thành phần chính là carbon) thì thu được xỉ than. Xỉ than nặng hơn hay nhẹ hơn than tổ ong? Giải thích. Câu 2: Vôi sống (calcium oxide) phản ứng với một số chất có mặt trong không khí như sau: Calcium oxide + Carbon dioxide → Calcium carbonate Calcium oxide + nước → Calcium hydroxide Khi làm thí nghiệm, một học sinh quên đậy nắp lọ đựng vôi sống, sau một thời gian khối lượng của lọ sẽ thay đổi như thế nào? Câu 3: Cho 5,6 gam sắt (iron) tác dụng vừa đủ với 7,3g hydrochloric acid, thu được 12,7 gam iron (II) chloride và khí hydrogen. Tính khối lượng hydrogen tạo thành. Câu 4: Đốt cháy hoàn toàn 12 gam carcon trong không khí thu được 44g khí carbon dioxide. Tính khối lượng khí oxygen đã tham gia phản ứng. |
|
ĐÁP ÁN PHIẾU HỌC TẬP SỐ 1 Câu 1: Xỉ than nhẹ hơn than tổ ong vì phần carbon trong than tổ ong đã phản ứng với khí oxygen trong không khí thành chất khí carbon dioxide và đi vào không khí. Câu 2: Khối lượng lọ đựng vô sống tăng lên vì vôi sống đã pản ứng với hơi nước và carbon dioxide có trong không khí tạo thành các chất rắn trong lọ. Khối lượng lọ tăng lên bằng khối lượng carbon dioxide và hơi nước. Câu 3: Theo định luật bảo toàn khối lượng ta có: miron + mHydrochloric acid = mirone (II) chloride + mHydrogen mHydrogen = 5,6 + 7,3 - 12,7 = 0,2 (g) Câu 4: Theo định luật bảo toàn khối lượng ta có: mcarbon + moxygen = mcarbon dioxide moxygen = 44 - 12 = 32 (g) |
- PHƯƠNG TRÌNH HÓA HỌC
Hoạt động 2: Tìm hiểu về phương trình hóa học.
- Mục tiêu: HS làm quen với cách lập PTHH, biết được ý nghĩa của PTHH.
- Nội dung: GV giới thiệu về PTHH và cách lập PTHH thông qua các ví dụ, HS hoạt động nhóm trả lời các câu hỏi GV đề ra.
- Sản phẩm học tập: Đáp án câu hỏi sgk trang 26 và đưa ra kết luận thế nào là phương trình hóa học.
- Tổ chức hoạt động:
|
HOẠT ĐỘNG CỦA GV - HS |
DỰ KIẾN SẢN PHẨM |
|
Bước 1: Chuyển giao nhiệm vụ: - GV giới thiệu về PTHH và hướng dẫn HS cách lập PTHH theo từng bước qua các ví dụ 1 và 2.
|
II. Phương trình hóa học 1. Lập phương trình hóa học. VD1: Phản ứng giữa oxygen và hydrogen: Khí hydrogen + Khó oxygen → Nước Thay thế tên chất bằng công thức hóa học, ta có: H2 + O2 → H2O Vì số nguyên tử của mỗi nguyên tố ở hai vế của sơ đồ phản ứng bằng nhau, nên ta thêm các hệ số đứng trước chất, ta được phương trình hóa học: 2H2 + O2 → 2H2O Phương trình hóa học biểu diễn ngắn gọn phản ứng hóa học.
|
..............
=> Xem nhiều hơn:
- Giáo án hoá học 6 sách kết nối tri thức và cuộc sống
- Soạn giáo án hoá học 7 kết nối tri thức theo công văn mới nhất
- Giáo án hoá học 8 kết nối tri thức đủ cả năm
- Giáo án hoá học 9 soạn theo công văn 5512
III. GIÁO ÁN ĐIỆN TỬ HOÁ HỌC 8 KÌ 1 KẾT NỐI TRI THỨC
Giáo án Powerpoint bài: Tính theo phương trình hoá học
NHIỆT LIỆT CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
KHỞI ĐỘNG
Bằng cách nào có thể tính được lượng chất tham gia và lượng chất sản phẩm trong một phản ứng hóa học
VD: Khi cho Fe tác dụng với dung dịch HCl thì xảy ra phản ứng hóa học sau:
Fe + 2HCl → FeCl2 + H2
Cần dùng bao nhiêu mol Fe để thu được 1,5 mol H2?
BÀI 6. TÍNH THEO PHƯƠNG TRÌNH HOÁ HỌC
NỘI DUNG BÀI HỌC
Tính lượng chất trong phương trình hóa học
Hiệu suất phản ứng
01 TÍNH LƯỢNG CHẤT TRONG PHƯƠNG TRÌNH HÓA HỌC
- Tính lượng chất tham gia trong phản ứng
Ví dụ 1
Khi cho Fe tác dụng với dung dịch HCl thì xảy ra phản ứng hóa học sau:
Fe + 2HCl → FeCl2 + H2
Cần dùng bao nhiêu mol Fe để thu được 1,5 mol H2?
BÀI GIẢI
Theo phương trình hóa học:
1 mol Fe tham gia phản ứng sẽ thu được 1 mol H2.
Vậy: 1,5 mol Fe ………………………………
1,5 mol H2.
Số mol Fe cần dùng để thu được 1,5 mol H2 là 1,5 mol.
- Tính lượng chất sinh ra trong phản ứng
Ví dụ 2
Hòa tan hết 0,65 gam Zn trong dung dịch HCl 1M, phản ứng xảy ra như sau:
Zn + 2HCl → ZnCl2 + H2
Tính khối lượng muối zinc chloride (ZnCl2) tạo thành sau phản ứng.
BÀI GIẢI
Theo phương trình hóa học:
1 mol Zn tham gia phản ứng sẽ thu được 1 mol ZnCl2.
Vậy 0,01 mol Zn……………………………
0,01 mol ZnCl2.
Khối lượng zinc chloride tạo thành sau phản ứng là:
m = n.M = 0,01. (65,0+35,5.2) = 1,36 (g)
Câu 1: Tính thể tích khí hydrogen thu được trong ví dụ trên 25oC, 1 bar
Câu 2: Khi cho Mg tác dụng với dung dịch H2SO4 loãng thì xảy ra phản ứng hóa học như sau:
Mg + H2SO4 → MgSO4 + H2
Sau phản ứng thu được 0,02 mol MgSO4 . Tính thể tích khí H2 thu được ở 25oC, 1 bar
Câu trả lời 1
PTHH: Zn + 2HCl → ZnCl2 + H2
PTHH: 1 mol 1 mol
Phản ứng: 0,01 mol 0,01 mol
Thể tích khí H2 thu được ( ở 25oC, 1 bar) là:
V= 0,01.24,79 = 0,2479 (L)
Câu trả lời 2
PTHH: Mg + H2SO4 → MgSO4 + H2
PTHH: 1mol 1 mol
Phản ứng: 0,02 mol 0,02 mol
Thể tích khí H2 thu được là:
V= 0,02. 24,79= 0,4958 (L)
Kết luận: Dựa vào phương trình hóa học, khi biết lượng một chất đã phản ứng hoặc lượng chất tạo thành, tính được lượng các chất còn lại.
02 HIỆU SUẤT PHẢN ỨNG
- Khái niệm hiệu suất phản ứng
Ví dụ 1
Xét phản ứng khi đốt cháy 1 mol Carbon:
C + O2 CO2
Theo phương trình hóa học:
Nếu 1 mol C cháy hết, thu được 1 mol CO2 thì hiệu suất phản ứng đạt 100%. Tuy nhiên, trong thực tế số mol CO2 thu được thường nhỏ hơn 1 mol. Xét phản ứng trong trường hợp tổng quát:
Chất phản ứng → Sản phẩm
Ví dụ 2
- Khi nung 1 mol đá vôi ( có thành phần CaCO3):
CaCO3 CaO + CO2
Lượng CaO thu được là một số nhỏ hơn 1 mol vì thực tế trong đá vôi còn chứa tạp chất, thời gian phản ứng chưa đủ lâu,..
- Phản ứng của một số hợp chất hữu cơ thường không xảy ra hoàn toàn, nhiều phản ứng phụ,…
Với hiệu suất phản ứng nhỏ hơn 100%, khi đó
Lượng chất phản ứng dùng trên thực tế sẽ lớn lơn lượng tính theo phương trình hóa học (theo lý thuyết)
Lượng sản phẩm thu được trên thực tế sẽ nhỏ hơn lượng tính theo phương trình hóa học
Câu hỏi: Khi nung nóng xảy ra phản ứng hóa học sau (phản ứng nhiệt phân):
Biết rằng hiệu suất phản ứng nhỏ hơn 100%.
- Khi nhiệt phân 1 mol thì thu được số mol lớn hơn/nhỏ hơn/ bằng 1,5 mol?
- Để thu được 0,3 mol thì cần số mol lớn hơn/ nhỏ hơn/ bằng 0,2 mol?
- Tính hiệu suất của phản ứng
m’ : khối lượng chất sản phẩm thực tế
m: khối lượng chất theo sản phẩm lý thuyết
n’ : số mol chất sản phẩm thực tế
n: số mol chất sản phẩm lý thuyết
Câu hỏi: Nung 10 gam calcium carbonate (thành phần chính của đá vôi), thu được khí carbon dioxide và m gam vôi sống. Giả thiết hiệu suất phản ứng là 80%, xác định m.
Cách 1
Số mol CaCO3 là 0,1 mol
PTHH: CaCO3 CaO + CO2
Tỉ lệ: 1mol 1mol
Phản ứng: 0,1mol 0,1mol
Khối lượng CaO thu được theo phương trình phản ứng là: 0,1 . 56 = 5,6 (g)
Thực tế, khối lượng CaO thu được là:
Cách 2
Thực tế khối lượng CaCO3 phản ứng là :
Số mol CaCO3 phản ứng là 0,08 mol.
PTHH: CaCO3 CaO + CO2
Tỉ lệ: 1mol 1mol
Phản ứng: 0,08mol 0,08mol
Theo phương trình phản ứng, khối lượng CaO tạo thành là: 0,08.56 = 4,48 (g).
HÁI HOA DÂN CHỦ
=> Xem nhiều hơn:
- Giáo án điện tử hoá học 6 kết nối tri thức
- Giáo án điện tử hoá học 7 kết nối tri thức
- Giáo án điện tử hoá học 8 kết nối tri thức
- Giáo án điện tử hoá học 9

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
=> Giáo án hóa học 8 kết nối tri thức
Từ khóa: giáo án hoá học 8 kết nối tri thức, tải giáo án khoa học tự nhiên 8 hoá học KNTT đầy đủ, tải trọn bộ giáo án kì 1 hoá học 8 kết nối, tải giáo án word và điện tử hoá học 8 kì 1 KNTTĐẦY ĐỦ GIÁO ÁN CÁC BỘ SÁCH KHÁC
GIÁO ÁN WORD LỚP 8 KẾT NỐI TRI THỨC
Giáo án ngữ văn 8 kết nối tri thức đủ cả năm
Giáo án địa lí 8 kết nối tri thức đủ cả năm
Giáo án lịch sử 8 kết nối tri thức đủ cả năm
Giáo án khoa học tự nhiên 8 kết nối tri thức đủ cả năm
Giáo án vật lí 8 kết nối tri thức đủ cả năm
Giáo án sinh học 8 kết nối tri thức đủ cả năm
Giáo án hóa học 8 kết nối tri thức đủ cả năm
Giáo án tin học 8 kết nối tri thức đủ cả năm
Giáo án công dân 8 kết nối tri thức đủ cả năm
Giáo án công nghệ 8 kết nối tri thức đủ cả năm
Giáo án âm nhạc 8 kết nối tri thức đủ cả năm
Giáo án thể dục 8 kết nối tri thức đủ cả năm
Giáo án mĩ thuật 8 kết nối tri thức đủ cả năm
Giáo án hoạt động trải nghiệm 8 kết nối tri thức đủ cả năm
GIÁO ÁN POWERPOINT LỚP 8 KẾT NỐI TRI THỨC
GIÁO ÁN DẠY THÊM LỚP 8 KẾT NỐI TRI THỨC
Giáo án dạy thêm toán 8 kết nối tri thức đủ cả năm
CÁCH ĐẶT MUA:
Liên hệ Zalo: Fidutech - nhấn vào đây
