Giáo án kì 2 hóa học 8 kết nối tri thức
Có đủ giáo án word + PPT kì 2 hóa học 8 kết nối tri thức. Giáo án word đầy đủ chi tiết, Giáo án PPT hấp dẫn, lấy về chỉ việc trình chiếu và dạy. Với bộ giáo án cả năm gồm kì 1 + kì 2 hóa học 8 kết nối tri thức. Tin rằng: việc dạy sẽ đạt hiệu quả cao và trở nên nhẹ nhàng hơn
Click vào ảnh dưới đây để xem giáo án rõ







Một số tài liệu quan tâm khác
Phần trình bày nội dung giáo án
I. GIÁO ÁN KÌ 2 HÓA HỌC 8 KẾT NỐI TRI THỨC
CHƯƠNG I. PHẢN ỨNG HÓA HỌC
Giáo án KHTN 8 kết nối bài 2 Phản ứng hóa học
Giáo án KHTN 8 kết nối bài 3 Mol và tỉ khối chất khí
Giáo án KHTN 8 kết nối bài 4 Dung dịch và nồng độ
Giáo án KHTN 8 kết nối bài 5 Định luật bảo toàn khối lượng và phương trình hóa học
Giáo án KHTN 8 kết nối bài 6 Tính theo phương trình hóa học
Giáo án KHTN 8 kết nối bài 7 Tốc độ phản ứng và chất xúc tác
CHƯƠNG II. MỘT SỐ HỢP CHẤT THÔNG DỤNG
Giáo án KHTN 8 kết nối bài 8 Acid
Giáo án KHTN 8 kết nối bài 9 Base. Thang pH
Giáo án KHTN 8 kết nối bài 10 Oxide
Giáo án KHTN 8 kết nối bài 11 Muối
Giáo án KHTN 8 kết nối bài 12 Phân bón hóa học
=> Xem thêm: Giáo án hóa học 8 kết nối tri thức đủ cả năm
II. GIÁO ÁN WORD HÓA HỌC 8 KÌ 2 KẾT NỐI TRI THỨC
Giáo án Word bài: Acid
Ngày soạn:…/…/…
Ngày dạy:…/…/…
CHƯƠNG II. MỘT SỐ HỢP CHẤT THÔNG DỤNG
BÀI 8. ACID
- MỤC TIÊU
- Kiến thức
Sau bài học này, HS sẽ:
- Nêu được khái niệm acid (tạo ra ion H+).
- Tiến hành được thí nghiệm của hydrochloric acid (làm đổi màu chất chỉ thị; phản ứng với kim loại, nêu và giải thích hiện tượng xảy ra trong thí nghiệm (viết phương trình hóa học) à rút ra nhận xét về tính chất của acid.
- Trình bày được một số ứng dụng của một số acid thông dụng (HCl, H2SO4, CH3COOH)
- Năng lực
Năng lực chung:
- Năng lực tự chủ và tự học: Chủ động, tích cực tìm hiểu về acid.
- Năng lực giao tiếp và hợp tác: Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV, tích cực tham gia các hoạt động trong lớp.
- Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
Năng lực khoa học tự nhiên:
- Nhận thức khoa học tự nhiên: Nêu được khái niệm acid và trình bày được một số ứng dụng của acid thông dụng.
- Tìm hiểu tự nhiên: Tiến hành được các thí nghiệm của hydrochloric acid (làm đổi màu chất chỉ thị; phản ứng với kim loại, nêu và giải thích hiện tượng xảy ra trong thí nghiệm (viết phương trình hóa học) à rút ra nhận xét về tính chất của acid.
- Vận dụng kiến thức, kĩ năng đã học: Vận dụng kiến thức về acid để giải thích việc dùng giấm ăn để loại bỏ cặn trong các dụng cụ đun nấu, làm sạch đồ dùng, đồ trang sức bằng kim loại và biết cách sử dụng các sản phẩm tẩy rửa có thành phần acid mạnh như đeo gang tay, không để chất tẩy rửa dính vào da, quần áo
- Phẩm chất
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Cẩn thận, trung thực và thực hiện các yêu cầu trong bài học.
- Có niềm say mê, hứng thú với việc khám phá và học tập khoa học tự nhiên.
- THIẾT BỊ DẠY HỌC
- Đối với giáo viên
- SGK, SGV, SBT KHTN 8 phần Hóa học.
- Phiếu học tập, phiếu bài tập.
- Máy chiếu, bảng nhóm.
- Đối với học sinh
- SGK, SBT KHTN 8 phần Hóa học.
- Tranh ảnh, tư liệu sưu tầm liên quan đến bài học và dụng cụ học tập (nếu cần) theo yêu cầu của GV.
III. TIẾN TRÌNH DẠY HỌC
- HOẠT ĐỘNG KHỞI ĐỘNG
- Mục tiêu: GV hướng dẫn HS hình thành tư duy tỏng quan cho bài học. Từ đó khám phá, tìm tòi và chủ động việc tìm kiếm kiến thức mới về acid.
- Nội dung: GV giới thiệu một số tình huống thực tế liên quan đến tính chất của acid để tạo hứng thú cho HS như: nước quả chanh có vị chua; hiện tượng mưa acid gây hư hỏng các công trình xây dựng, làm mất cân bằng môi trường sống của các loại sinh vật;…
- Sản phẩm học tập: HS trả lời được câu hỏi theo ý kiến cá nhân.
- Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV đưa ra một số hình ảnh và đặt vấn đề:
“ Tại sao nước quả chanh lại có vị chua?”
“Người ta thường dùng chanh để loại bỏ cặn trong các dụng cụ đun nước”
“Vậy phải chăng chanh có thành phần chứa chất nào đó gây nên vị chua đặc trưng và có tác dụng loại bỏ cặn bám trong các dụng cụ đun nước?”
Bước 2: Thực hiện nhiệm vụ
- HS lắng nghe câu hỏi, suy nghĩ, thảo luận trả lời câu hỏi phần khởi động.
Bước 3: Báo cáo kết quả hoạt động và thảo luận
- HS đưa ra chất gây nên vị chua của chanh và chất giúp loại bỏ cặn bám trong dụng cụ đun nước.
Bước 4: Kết luận, nhận định
- Đáp án: Acid
- GV đánh giá câu trả lời của HS, trên cơ sở đó dẫn dắt HS vào bài học: Acid chính là thành phần gây nên vị chua và tính chất hóa học cho nước chanh. Vậy acid là gì, có tính chất như thế nào, chúng ta tìm hiểu thông qua - Bài 8. Acid.
- HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
- KHÁI NIỆM ACID.
Hoạt động 1: Tìm hiểu khái niệm acid.
- Mục tiêu: HS nêu được khái niệm acid
- Nội dung: GV giới thiệu cho HS công thức hóa học của các acid và yêu cầu HS nhận xét về đặc điểm chung của chúng, từ đó đề xuấ khái niệm acid.
- Sản phẩm học tập: Khái niệm acid và đáp án cho hoạt động trong sgk trang 35, câu hỏi mục I sgk trang 36.
- Tổ chức hoạt động:
HOẠT ĐỘNG CỦA GV - HS | DỰ KIẾN SẢN PHẨM | ||||||||||||||||||
Bước 1: Chuyển giao nhiệm vụ: - GV giới thiệu bảng 8.1, yêu cầu HS hoạt động nhóm 4, thảo luận hoàn thành hoạt động trong sgk trang 35: Bảng 8.1:
Quan sát bảng 8,1 và thực hiện các yêu cầu sau: 1. Công thức hóa học của các aicd có đặc điểm gì giống nhau? 2. Dạng tồn tại của các acid trong dung dịch có đặc điểm gì chung? 3. Đề xuất khái niệm về acid.
- GV yêu cầu HS hoạt động nhóm đôi trả lời câu hỏi mục I sgk trang 36. Bước 2: Thực hiện nhiệm vụ - Nhóm HS hoạt động nhóm trả lời các câu hỏi, yêu cầu GV đưa ra. - GV hướng dẫn, theo dõi, hỗ trợ HS nếu cần thiết. Bước 3: Báo cáo kết quả hoạt động và thảo luận - Đại diện HS trả lời câu hỏi - GV mời HS khác nhận xét, bổ sung. Bước 4: Kết luận, nhận định - GV đánh giá, nhận xét, chuẩn kiến thức | I.Khái niệm acid - Đáp án hoạt động sgk trang 35: 1. Công thức hóa học của acid đều chứa nguyên tử H. 2. Dạng tồn tại trong dung dịch đều chứa cation H+ và anion gốc acid 3. Acid là những hợp chất mà phân tử gồm một hay nhiều nguyên tử hydrogen và gốc acid. Khi hòa tan trong nước, acid tách ra cation H+ và anion gốc acid.
- Đáp án câu hỏi mục I sgk trang 36: Gốc acid: SO42-, Cl-, NO3-
| ||||||||||||||||||
- TÍNH CHẤT HÓA HỌC
Hoạt động 2: Tìm hiểu tính chất hóa học của acid
- Mục tiêu: HS nêu được các tính chất hóa học của acid.
- Nội dung: HS tiến hành được các thí nghiệm tìm hiểu tính chất của acid HCl: làm đổi màu chất chỉ thị, phản ứng với kimm loại;.. từ đó rút ra nhận xét về tính chất của acid.
- Sản phẩm học tập: Các tính chất hóa học của acid và Đáp án câu hỏi mục II sgk trang 36.
- Tổ chức hoạt động:
HOẠT ĐỘNG CỦA GV - HS | DỰ KIẾN SẢN PHẨM |
Bước 1: Chuyển giao nhiệm vụ: -GV chia lớp thành các nhóm 5-6 HS thực hành hoặc chiếu video thí nghiệm : “ Tính chất của dung dịch hydrochloric acid” : -Chuẩn bị: dung dịch HCl 1M, giấy quỳ tím; hai ống nghiệm mỗi ống đựng một trong các kim loại Fe, Zn, ống hút nhỏ giọt. - Tiến hành: + Nhỏ 1-2 giọt dung dịch HCl vào mẩu quỳ tím. + Cho khoảng 3ml dung dịch HCl vào mỗi ống nghiệm đã chuẩn bị ở trên. Mô tả hiện tượng xảy ra và viết phương trình hóa học.
- GV yêu cầu HS hoạt động nhóm đôi trả lời câu hỏi mục II sgk trang 36. Bước 2: Thực hiện nhiệm vụ - HS thực hành theo nhóm và trả lời các câu hỏi, yêu cầu của GV. - GV hướng dẫn, theo dõi, hỗ trợ HS nếu cần thiết. Bước 3: Báo cáo kết quả hoạt động và thảo luận - Đại diện HS trả lời câu hỏi của GV. - GV mời HS khác nhận xét, bổ sung. Bước 4: Kết luận, nhận định - GV đánh giá, nhận xét, chuẩn kiến thức | II. Tính chất hóa học - Hiện tượng xảy ra: Dung dịch acid HCl làm đổi màu giấy quỳ tím sang đỏ. Ống nghiệm chứa các Zn, Fe sau khi cho dung dịch HCl có bọt khí thoát ra và kim loại tan dần. PTHH: Zn + 2HCl → ZnCl2 + H2 Fe + 2HCl → FeCl2 + H2
- Đáp án câu hỏi mục II sgk trang 36: PTHH: Mg + 2HCl → MgCl2 +H2 |
- MỘT SỐ ACID THÔNG DỤNG
Hoạt động 3. Tìm hiểu một số acid thông dụng.
- Mục tiêu: HS trình bày được ứng dụng của một số acid thông dụng: HCl, H2SO4, CH3COOH.
- Nội dung: GV chia nhóm để thực hiện hoạt động “Tìm hiểu ứng dụng của một số acid quan trọng” (làm ở nhà). Các nhóm thảo luận và trình bày trước lớp.
- Sản phẩm học tập: Tính chất và ứng dụng của một số acid quan trọng, đáp án câu hỏi mục III.1 sgk trang 37, câu hỏi mục III.2 sgk trang 37,câu hỏi mục III.3 sgk trang 38
- Tổ chức hoạt động:
HOẠT ĐỘNG CỦA GV - HS | DỰ KIẾN SẢN PHẨM |
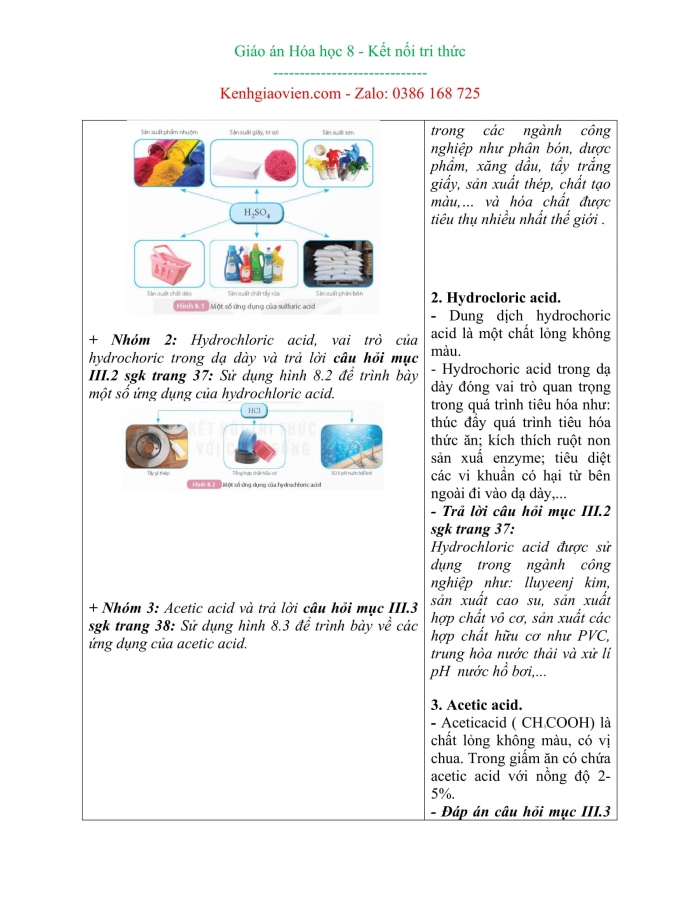
Bước 1: Chuyển giao nhiệm vụ: - GV chia lớp thành 3 nhóm yêu cầu các nhóm thảo luận nêu các tính chất của một acid và trả lời các câu hỏi. + Nhóm 1: Sulfuric acid, lưu ý khi sử dụng sulfuric acid đặc và trả lời câu hỏi mục III.1 sgk trang 37: Sử sụng hình 8.1 để trình bày về các ứng dụng của sulfuric acid.
+ Nhóm 2: Hydrochloric acid, vai trò của hydrochoric trong dạ dày và trả lời câu hỏi mục III.2 sgk trang 37: Sử dụng hình 8.2 để trình bày một số ứng dụng của hydrochloric acid.
+ Nhóm 3: Acetic acid và trả lời câu hỏi mục III.3 sgk trang 38: Sử dụng hình 8.3 để trình bày về các ứng dụng của acetic acid. - GV giao nhiệm vụ về nhà cho 3 nhóm: tìm hiểu về nhu cầu sử dụng của các acid vừa học + Nhóm 1: HCl + Nhóm 2: H2SO4 + Nhóm 3: CH3COOH. Và đồng thời cả 3 nhóm đều tìm hiểu “Việc sử dụng acid không đúng cách sẽ gây ô nhiễm môi trường đất, nước, không khí như thế nào?” - GV đưa ra một số gợi ý để HS thực hiện nhiệm vụ và yêu cầu các nhóm nộp sản phẩm vào tiết học sau. Bước 2: Thực hiện nhiệm vụ - HS thực hành theo nhóm và trả lời các câu hỏi, yêu cầu của GV. - GV hướng dẫn, theo dõi, hỗ trợ HS nếu cần thiết. Bước 3: Báo cáo kết quả hoạt động và thảo luận - Đại diện HS trả lời câu hỏi của GV. - GV mời HS khác nhận xét, bổ sung. Bước 4: Kết luận, nhận định - GV đánh giá, nhận xét, chuẩn kiến thức | III. Một số acid quan trọng 1. Sulfuric acid - Sulfuric acid là chất lỏng không màu, không bay hơi, sánh như dầu ăn, nặng gần gấp 2 lần nước. Sulfuric acid tan vô hạn trong nước và tỏa nhiều nhiệt. - Lưu ý: sulfuric acid đặc có tính háo nước nên không được tự ý pha loãng. - Trả lời câu hỏi mục III.1 sgk trang 37: Sulfuric acid là một tong các hóa chất được sử dụng nhiều trong các ngành công nghiệp như phân bón, dược phẩm, xăng dầu, tẩy trắng giấy, sản xuất thép, chất tạo màu,… và hóa chất được tiêu thụ nhiều nhất thế giới .
2. Hydrocloric acid. - Dung dịch hydrochoric acid là một chất lỏng không màu. - Hydrochoric acid trong dạ dày đóng vai trò quan trọng trong quá trình tiêu hóa như: thúc đẩy quá trình tiêu hóa thức ăn; kích thích ruột non sản xuấ enzyme; tiêu diệt các vi khuẩn có hại từ bên ngoài đi vào dạ dày,... - Trả lời câu hỏi mục III.2 sgk trang 37: Hydrochloric acid được sử dụng trong ngành công nghiệp như: lluyeenj kim, sản xuất cao su, sản xuất hợp chất vô cơ, sản xuất các hợp chất hữu cơ như PVC, trung hòa nước thải và xử lí pH nước hồ bơi,...
3. Acetic acid. - Aceticacid ( CH3COOH) là chất lỏng không màu, có vị chua. Trong giấm ăn có chứa acetic acid với nồng độ 2-5%. - Đáp án câu hỏi mục III.3 sgk trang 38: Acetic acid được sử dụng trong ngành công nghiệp như: sản xuất sợi poly ( vinyl acetate), sơn, dược phẩm, chế biến thực phẩm, ...
- HS trình bày về nhu cầu sử dụng và ứng dụng của một acid theo dàn ý: + Giới thiệu tên gọi, công thức hóa học và một số tính chất đặc trưng của acid đó. + TRình bày nhu cầu sử dụng của acid đó trên thế giới và Việt Nam (theo đơn vị tấn/năm) + Trình bày ứng dụng của acid đó dựa trên tue liệu, tranh, ảnh, video clip,.. - HS trình bày việc sử dụng acid không đúng cách sẽ gây ô nhiễm môi trường đất, nước, không khí theo dàn ý: + Trình bày tổng quan về acid (khái niệm, tính chất hóa học) + Trình bày tác hại của việc sử sụng acid không dúng cách gây ô nhiễm môi trường đất, nước, không khí dựa trên tư liệu, tranh ảnh, video clip. |
- HOẠT ĐỘNG LUYỆN TẬP
- Mục tiêu: Củng cố lại kiến thức đã học thông qua trả lời câu hỏi dưới dạng trắc nghiệm.
- Nội dung: HS sử dụng SGK, kiến thức đã học, GV hướng dẫn (nếu cần thiết) để trả lời câu hỏi.
- Sản phẩm học tập: HS hoàn thành được bài tập trắc nghiệm
- Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV giao nhiệm vụ cho HS: Khoanh tròn vào câu đặt trước câu trả lời đúng
Câu 1: Acid là phân tử khi tan trong nước phân li ra:
- OH-
- H+
- Ca2+
- Cl-
Câu 2. Dung dịch acid đổi màu quỳ tím sang
- Xanh
- Trắng
- Đỏ
- Đen
Câu 3. Khí cho một mảnh iron (Fe) vào hydrochloric acid, ta thật sủi bọt khí. Đó là khí gì?
- Oxygen
- Carbon dioxide.
Câu 4. Để phân biệt 2 dung dịch HCl và H2SO4 loãng. Ta dùng một kim loại là
- Mg
- Ba
- Cu
- Zn
Câu 5. Cho 5,6 g iron tác dụng với hydrochloric acid dư, sau phản ứng khối lượng khí hydrogen thu được là
- 0,1 gam
- 0,2 gam
- 0,01 gam
- 0,05 gam
=> Xem nhiều hơn:
- Giáo án hóa học 6 sách kết nối tri thức và cuộc sống
- Soạn giáo án Hoá học 7 kết nối tri thức theo công văn mới nhất
- Giáo án hóa học 8 kết nối tri thức
- Giáo án Hóa học 9 soạn theo công văn 5512
III. GIÁO ÁN ĐIỆN TỬ HÓA HỌC 8 KÌ 2 KẾT NỐI TRI THỨC
Giáo án powerpoint bài: Acid
NHIỆT LIỆT CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI!
KHỞI ĐỘNG
Tại sao nước quả chanh lại có vị chua?”
Người ta thường dùng chanh để loại bỏ cặn trong các dụng cụ đun nước
Vậy phải chăng chanh có thành phần chứa chất nào đó gây nên vị chua đặc trưng và có tác dụng loại bỏ cặn bám trong các dụng cụ đun nước?”
BÀI 8. ACID
NỘI DUNG BÀI HỌC
Khái niệm acid
Tính chất hóa học
Một số acid quan trọng
01 KHÁI NIỆM ACID
BẢNG 8.1
Quan sát bảng 8,1 và thực hiện các yêu cầu sau:
- Công thức hóa học của các aicd có đặc điểm gì giống nhau?
- Dạng tồn tại của các acid trong dung dịch có đặc điểm gì chung?
- Đề xuất khái niệm về acid.
Tên acid | Công thức hóa học | Dạng tồn tại trong dung dịch | |
Ion dương | Ion âm (gốc acid) | ||
Hydrochloric acid | HCl | H+ | Cl- |
Nitric acid | HNO3 | H+ | NO3- |
Sulfuric acid | H2SO4 | H+ | SO42- |
TRẢ LỜI
- Công thức hóa học của acid đều chứa nguyên tử H.
- Dạng tồn tại trong dung dịch đều chứa cation H+ và anion gốc acid
- Acid là những hợp chất mà phân tử gồm một hay nhiều nguyên tử hydrogen và gốc acid. Khi hòa tan trong nước, acid tách ra cation H+ và anion gốc acid.
THẢO LUẬN NHÓM ĐÔI
Hãy cho biết gốc acid trong các acid sau: , HCL,
Gốc acid: SO42-, Cl-, NO3-
02 TÍNH CHẤT HÓA HỌC
THỰC HÀNH: Tính chất của dung dịch hydrochloric acid
Chuẩn bị
dung dịch HCl 1M, giấy quỳ tím; hai ống nghiệm mỗi ống đựng một trong các kim loại Fe, Zn, ống hút nhỏ giọt.
Tiến hành
- Nhỏ 1-2 giọt dung dịch HCl vào mẩu quỳ tím.
- Cho khoảng 3ml dung dịch HCl vào mỗi ống nghiệm đã chuẩn bị ở trên.
Mô tả hiện tượng xảy ra và viết phương trình hóa học.
Hiện tượng xảy ra:
- Dung dịch acid HCl làm đổi màu giấy quỳ tím sang đỏ.
- Ống nghiệm chứa các Zn, Fe sau khi cho dung dịch HCl có bọt khí thoát ra và kim loại tan dần.
PTHH:
Zn + 2HCl → ZnCl2 + H2
Fe + 2HCl → FeCl2 + H2
Cho dung dịch HCL tác dụng với kim loại Mg. Viết phương trình hóa học của phản ứng xảy ra.
03 MỘT SỐ ACID QUAN TRỌNG
HOẠT ĐỘNG NHÓM
Nhóm 1: Sulfuric acid, lưu ý khi sử dụng sulfuric acid đặc và trả lời câu hỏi mục III.1 sgk trang 37: Sử sụng hình 8.1 để trình bày về các ứng dụng của sulfuric acid.
Nhóm 2: Hydrochloric acid, vai trò của hydrochoric trong dạ dày và trả lời câu hỏi mục III.2 sgk trang 37: Sử dụng hình 8.2 để trình bày một số ứng dụng của hydrochloric acid.
Nhóm 3: Acetic acid và trả lời câu hỏi mục III.3 sgk trang 38: Sử dụng hình 8.3 để trình bày về các ứng dụng của acetic acid.
- Sulfuric acid
Sulfuric acid là chất lỏng không màu, không bay hơi, sánh như dầu ăn, nặng gần gấp 2 lần nước. Sulfuric acid tan vô hạn trong nước và tỏa nhiều nhiệt.
Lưu ý: sulfuric acid đặc có tính háo nước nên không được tự ý pha loãng
Trả lời câu hỏi mục III.1 sgk trang 37:
=> Xem nhiều hơn:

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
=> Giáo án hóa học 8 kết nối tri thức
Từ khóa: giáo án hóa học 8 kết nối tri thức, tải giáo án hóa học 8 KNTT đầy đủ, tải trọn bộ giáo án kì 2 hóa học 8 kết nối, tải giáo án word và điện tử hóa học 8 kì 2 KNTTĐẦY ĐỦ GIÁO ÁN CÁC BỘ SÁCH KHÁC
GIÁO ÁN WORD LỚP 8 KẾT NỐI TRI THỨC
Giáo án ngữ văn 8 kết nối tri thức đủ cả năm
Giáo án địa lí 8 kết nối tri thức đủ cả năm
Giáo án lịch sử 8 kết nối tri thức đủ cả năm
Giáo án khoa học tự nhiên 8 kết nối tri thức đủ cả năm
Giáo án vật lí 8 kết nối tri thức đủ cả năm
Giáo án sinh học 8 kết nối tri thức đủ cả năm
Giáo án hóa học 8 kết nối tri thức đủ cả năm
Giáo án tin học 8 kết nối tri thức đủ cả năm
Giáo án công dân 8 kết nối tri thức đủ cả năm
Giáo án công nghệ 8 kết nối tri thức đủ cả năm
Giáo án âm nhạc 8 kết nối tri thức đủ cả năm
Giáo án thể dục 8 kết nối tri thức đủ cả năm
Giáo án mĩ thuật 8 kết nối tri thức đủ cả năm
Giáo án hoạt động trải nghiệm 8 kết nối tri thức đủ cả năm
GIÁO ÁN POWERPOINT LỚP 8 KẾT NỐI TRI THỨC
GIÁO ÁN DẠY THÊM LỚP 8 KẾT NỐI TRI THỨC
Giáo án dạy thêm toán 8 kết nối tri thức đủ cả năm
CÁCH ĐẶT MUA:
Liên hệ Zalo: Fidutech - nhấn vào đây
