Giáo án điện tử KHTN 8 kết nối Bài 3: Mol và tỉ khối chất khí
Bài giảng điện tử Khoa học tự nhiên 8 (Hoá học) kết nối tri thức. Giáo án powerpoint Bài 3: Mol và tỉ khối chất khí. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt, tạo hứng thú học tập cho học sinh. Thầy, cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 8 kết nối tri thức
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét










Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 8 kết nối tri thức
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC HÔM NAY!
KHỞI ĐỘNG
Bằng phép đo thông thường, ta chỉ xác định được khối lượng chất rắn, chất lỏng hoặc thể tích của chất khí. Làm thế nào để biết lượng chất có bao nhiêu phân tử, nguyên tử?
Hãy nêu khối lượng của hạt proton, neutron, electron, của nguyên tử carbon, phân tử oxygen,…
CHƯƠNG 1:
PHẢN ỨNG HÓA HỌC
BÀI 3:
MOL VÀ TỈ KHỐI CỦA CHẤT KHÍ
NỘI DUNG BÀI HỌC
Mol
Tỉ khối chất khí
- Mol
Trong toán học, người ta quy định :
- 1 tá trứng bằng bao nhiêu quả trứng? => 12 quả trứng
- 1 chục quả trứng bằng bao nhiêu quả trứng? =>10 quả trứng
- Khái niệm
- Số 6,022.1023 được gọi là số Avogadro, được kí hiệu là NA
- Mol là lượng chất có chứa NA (6,022.1023) nguyên tử hoặc phân tử của chất đó.
Ví dụ
- a) 12 gam carbon có NA nguyên tử C hay 1 mol nguyên tử carbon
- b) 254 gam iodine có NA phân tử I2 hay 1 mol phân tử idodine
- c) 18 gam nước có NA phân tử H2O hay 1 mol phân tử nước
Đọc thông tin Hình 3.1 và so sánh khối lượng của 1 mol nguyên tử carbon, 1 mol phân tử iodine và 1 mol phân tử nước.
Khối lượng 1 mol nguyên tử C < khối lượng 1 mol phân tử H2O < khối lượng 1 mol phân tử I2.
- Khối lượng mol
Khối lượng mol của một chất là gì?
Khối lượng mol (kí hiệu là M) của một chất là khối lượng của NA nguyên tử hoặc phân tử chất đó tính theo đơn vị gam.
Bảng 3.1. Khối lượng một số nguyên tử và khối lượng mol nguyên tử tương ứng
|
Nguyên tử |
Kí hiệu hóa học |
Khối lượng nguyên tử |
Khối lượng mol nguyên tử |
|
Carbon |
C |
12 amu |
12 g/mol |
|
Hydrogen |
H |
1 amu |
1 g/mol |
|
Oxygen |
O |
16 amu |
16 g/mol |
Khối lượng mol (g/mol) của một chất và khối lượng nguyên tử hoặc phân tử của chất đó (amu) bằng nhau về trị số, khác về đơn vị đo.
Gọi n là số mol chất có trong m gam. Khối lượng mol (M) được tính theo công thức:
M = (g/mol)
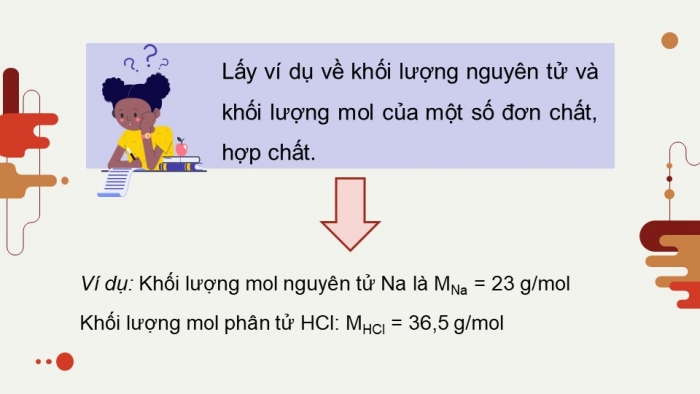
Lấy ví dụ về khối lượng nguyên tử và khối lượng mol của một số đơn chất, hợp chất.
Ví dụ: Khối lượng mol nguyên tử Na là MNa = 23 g/mol
Khối lượng mol phân tử HCl: MHCl = 36,5 g/mol
Hoàn thành bảng sau:
|
Chất |
Khối lượng phân tử (g/mol) |
Khối lượng (g) |
Số mol |
|
Urea |
? |
3 |
0,05 |
|
Nước |
18 |
27 |
? |
|
Sắt |
56 |
? |
0,2 |
CH1. Tính khối lượng mol của chất X, biết rằng 0,4 mol chất này có khối lượng là 23,4 gam.
CH2. Tính số mol phân tử có trong 9 gam nước, biết rằng khối lượng mol của nước là 18 g/mol.
Trả lời CH1 :
Khối lượng mol của chất X :
M = = 58,5 (g/mol)
Trả lời CH2 :
Số mol nước là:
n = (mol)
- Thể tích mol của chất khí
Nêu khái niệm thể tích mol của chất khí
Trong cùng một điều kiện nhiệt độ và áp suất thì khối lượng mol của chúng như nào?
Thể tích mol của chất khí là thể tích chiếm bởi NA phân tử của chất khí đó.
Thể tích mol của các chất khí bất kì ở cùng điều kiện nhiệt độ và áp suất đều bằng nhau.
Ở điều kiện chuẩn (25oC và 1 bar), n mol chất khí bất kì đều chiếm thể tích là V = 24,79.n (L).
THẢO LUẬN CẶP ĐÔI
Tìm thể tích của:
- 1 mol phân tử khí O2 ở đktc
- 2 mol phân tử khí H2 ở đktc
Ví dụ: Ở đktc:
- Thể tích của 1 mol phân tử khí O2 là 22,4 L.
- Thể tích của 2 mol phân tử khí H2 là 44,8 L.
Lưu ý
- Giá trị 1 bar = 105 Pa, xấp xỉ bằng áp suất khí quyển ở độ cao ngang mặt nước biển hoặc vùng đồng bằng nơi ta đang sống.
- Ở cùng điều kiện nhiệt độ và áp suất, thể tích mol của chất rắn hoặc chất lỏng là khác nhau.
Câu 1. Ở 25 oC và 1 bar, 1,5 mol khí chiếm thể tích bao nhiêu?
Thể tích 1,5 mol khí 25 oC, 1 bar là:
V = 24,79.1,5 = 37,185 (L)
Câu 2. Một hỗn hợp gồm 1 mol khí oxygen với 4 mol khí nitrogen. Ở 25 oC và 1 bar, hỗn hợp khí này có thể tích là bao nhiêu ?
Số mol khí là: 1 + 4 = 5 (mol)
Thể tích hỗn hợp khí thu được là:
V = 24,79.5 = 123,95 (L)
- Tỉ khối chất khí
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 8 kết nối tri thức
ĐẦY ĐỦ GIÁO ÁN CÁC BỘ SÁCH KHÁC
GIÁO ÁN WORD LỚP 8 KẾT NỐI TRI THỨC
Giáo án ngữ văn 8 kết nối tri thức đủ cả năm
Giáo án địa lí 8 kết nối tri thức đủ cả năm
Giáo án lịch sử 8 kết nối tri thức đủ cả năm
Giáo án khoa học tự nhiên 8 kết nối tri thức đủ cả năm
Giáo án vật lí 8 kết nối tri thức đủ cả năm
Giáo án sinh học 8 kết nối tri thức đủ cả năm
Giáo án hóa học 8 kết nối tri thức đủ cả năm
Giáo án tin học 8 kết nối tri thức đủ cả năm
Giáo án công dân 8 kết nối tri thức đủ cả năm
Giáo án công nghệ 8 kết nối tri thức đủ cả năm
Giáo án âm nhạc 8 kết nối tri thức đủ cả năm
Giáo án thể dục 8 kết nối tri thức đủ cả năm
Giáo án mĩ thuật 8 kết nối tri thức đủ cả năm
Giáo án hoạt động trải nghiệm 8 kết nối tri thức đủ cả năm
GIÁO ÁN POWERPOINT LỚP 8 KẾT NỐI TRI THỨC
GIÁO ÁN DẠY THÊM LỚP 8 KẾT NỐI TRI THỨC
Giáo án dạy thêm toán 8 kết nối tri thức đủ cả năm
CÁCH ĐẶT MUA:
Liên hệ Zalo: Fidutech - nhấn vào đây
