Giáo án powerpoint hóa học 11 chân trời sáng tạo
Giáo án powerpoint hay còn gọi là giáo án điện tử, bài giảng điện tử, giáo án trình chiếu. Dưới đây là bộ giáo án powerpoint hóa học 11 sách chân trời sáng tạo. Giáo án được thiết kế theo phong cách hiện đại, đẹp mắt để tạo hứng thú học tập cho học sinh. Với tài liệu này, hi vọng việc dạy môn hóa học 11 chân trời sáng tạo của thầy cô sẽ nhẹ nhàng hơn
Click vào ảnh dưới đây để xem giáo án rõ











Xem video về mẫu Giáo án powerpoint hóa học 11 chân trời sáng tạo
Một số tài liệu quan tâm khác
Phần trình bày nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
KHỞI ĐỘNG
- Trong các phản ứng hóa học, có một loại phản ứng trong đó các chất sản phẩm có khả năng phản ứng để tạo thành các chất đầu => Phản ứng xảy ra không hoàn toàn và thường có hiệu suất không cao.
- Phản ứng tổng hợp ammonia từ nitrogen và hydrogen thuộc loại phản ứng này.
CHƯƠNG I. CÂN BẰNG HOÁ HỌC
BÀI 1. KHÁI NIỆM VỀ CÂN BẰNG HOÁ HỌC
NỘI DUNG BÀI HỌC
NỘI DUNG BÀI HỌC
- PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HOÁ HỌC
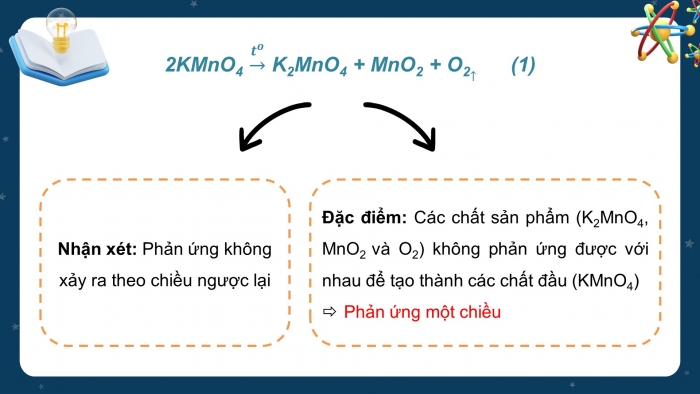
- Phản ứng điều chế khí oxygen trong phòng thí nghiệm bằng cách đun nóng tinh thể KMnO4 (thuốc tím) tạo thành K2MnO4, MnO2, O2 có phương trình hóa học như sau:
- Câu hỏi thảo luận: Dựa vào phương trình hóa học của phản ứng điều chế khí oxygen từ KMnO4, em hãy cho biết phản ứng có xảy ra theo chiều ngược lại không?
- Nhận xét: Phản ứng không xảy ra theo chiều ngược lại
Đặc điểm: Các chất sản phẩm (K2MnO4, MnO2 và O2) không phản ứng được với nhau để tạo thành các chất đầu (KMnO4)
Phản ứng một chiều
Nhận xét
- Khái niệm: Phản ứng một chiều là phản ứng chỉ xảy ra theo chiều từ chất tham gia tạo thành sản phẩm mà sản phẩm không thể tác dụng lại với nhau để tạo thành chất ban đầu.
- Kí hiệu chiều phản ứng:
Ví dụ : NaOH + HCl NaCl + H2O
Vậy có phản ứng nào mà các chất sản phẩm lại phản ứng được với nhau để tạo thành chất đầu không ?
Phản ứng thuận nghịch
THẢO LUẬN NHÓM: Quan sát phản ứng sau và trả lời câu hỏi câu hỏi 2 (SGK tr.6)
Phản ứng Cl2 tác dụng với H2O có đặc điểm gì khác với phản ứng nhiệt phân thuốc tím?
Phản ứng trên xảy ra theo hai chiều, các chất sản phẩm tác dụng được với nhau tạo lại Cl2 và H2O
Phản ứng thuận nghịch
Phản ứng thuận:
Cl2 + H2O => HCl + HClO
Phản ứng thuận:
Cl2 + H2O=>HCl + HClO
Phản ứng thuận nghịch
- Khái niệm: Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều xác định.
- Kí hiệu chiều phản ứng: . Chiều từ trái sang phải là chiều thuận, chiều từ phải sang trái là chiều nghịch.
Ví dụ: 3O2 2O3
Trạng thái cân bằng
THẢO LUẬN NHÓM: Nghiên cứu trạng thái cân bằng hóa học thông qua phản ứng và trả lời câu hỏi 3, 4 (SGK tr.6)
Câu hỏi 3 (SGK tr.6). Quan sát Hình 1.1, nhận xét sự biến thiên nồng độ của các chất trong hệ phản ứng theo thời gian (với điều kiện nhiệt độ không đổi).
Câu hỏi 4 (SGK tr.6). Quan sát Hình 1.2, nhận xét về tốc độ của phản ứng thuận và tốc độ của phản ứng nghịch theo thời gian trong điều kiện nhiệt độ không đổi. Nồng độ các chất trong phản ứng thay đổi như thế?
Trạng thái cân bằng
Câu hỏi 3.
Theo thời gian: số mol N2, H2 giảm dần và đến một thời điểm => Không thay đổi nữa
Theo thời gian: số mol NH3 tăng dần và đến cùng một thời điểm => Không thay đổi nữa
Câu hỏi 4.
- Biểu thức định luật tác dụng khối lượng đối với phản ứng thuận:
vt = kt N2. H23
- Biểu thức định luật tác dụng khối lượng đối với phản ứng nghịch:
vn = kn NH32
Theo thời gian, số mol N2, H2 giảm dần
[N2] và [H2] giảm dần
Tốc độ phản ứng thuận giảm
Theo thời gian, số mol NH3 tăng dần
[NH3] tăng dần
Tốc độ phản ứng nghịch tăng
Nhận xét
- Trong thí nghiệm:
- Lúc đầu: Phản ứng thuận có tốc độ lớn hơn phản ứng nghịch, ưu tiên tạo ra ammonia.
- Theo thời gian: Tốc độ phản ứng thuận giảm dần, tốc độ phản ứng nghịch tăng dần đến khi tốc độ hai phản ứng bằng nhau.
- Tại thời điểm này: Số mol của các chất hydrogen, nitrogen, ammonia không thay đổi nữa.
Thời điểm phản ứng thuận nghịch đạt tới trạng thái cân bằng.
Trạng thái cân bằng
Khái niệm: Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Trạng thái cân bằng
ĐẶC
ĐIỂM
Cân bằng hóa học là một cân bằng động
Ở trạng thái cân bằng: Phản ứng thuận và phản ứng nghịch vẫn xảy ra với tốc độ bằng nhau
=> Không nhận thấy sự thay đổi thành phần của hệ
- HẰNG SỐ CÂN BẰNG CỦA PHẢN ỨNG THUẬN NGHỊCH
HOẠT ĐỘNG NHÓM
Thảo luận, tìm hiểu hằng số cân bằng của phản ứng thuận nghịch qua hệ cân bằng dưới đây và trả lời câu hỏi 5, 6 (SGK tr.7)
2NO2(g) N2O2(g)
(nâu đỏ) (không màu)
Câu hỏi 5 (SGK tr.7). Sử dụng dữ liệu Bảng 1.1, hãy tính giá trị biểu thức trong 5 thí nghiệm. Nhận xét giá trị thu được từ các thí nghiệm khác nhau.
Bảng 1.1. Dữ liệu thực nghiệm về nồng độ các khí trước và sau khi đặt trạng thái cân bằng ở 25°C
Câu hỏi 6 (SGK tr.7). Viết các biểu thức tính tốc độ phản ứng thuận và tốc độ phản ứng nghịch của phản ứng thuận nghịch sau, biết phản ứng thuận và phản ứng nghịch đều là phản ứng đơn giản:
aA + bB cC + Dd
Lập tỉ lệ giữa hằng số tốc độ phản ứng thuận và hằng số tốc độ phản ứng nghịch ở trạng thái cân bằng.
Câu hỏi 5.
Nhận xét:
Giá trị biểu thức thay đổi không đáng kể dù nồng độ ban đầu và nồng độ các chất tại thời điểm cân bằng khác nhau.
Câu hỏi 6.
- Biểu thức định luật tác dụng khối lượng đối với phản ứng thuận:
vt = kt. Bb
- Biểu thức định luật tác dụng khối lượng đối với phản ứng nghịch:
vn = kn Cc. Dd
- Ở trạng thái cân bằng: kt. Bb = kn Cc. Dd
Kết luận
- Tổng quát, nếu có phản ứng thuận nghịch sau: aA + bB cC + dD
- Khi phản ứng ở trạng thái cân bằng, ta có:
- [A], [B], [C], [D]: Nồng độ mol của các chất M, N, A, B ở trạng thái cân bằng.
- a, b, c, d: Hệ số tỉ lượng của các chất trong phương trình hóa học của phản ứng.
- Tổng quát, nếu có phản ứng thuận nghịch sau: aA + bB cC + dD
- Khi phản ứng ở trạng thái cân bằng, ta có:
- KC: Hằng số cân bằng của một phản ứng thuận nghịch.
- Phụ thuộc nhiệt độ và bản chất của phản ứng.
- Không phụ thuộc nồng độ ban đầu của các chất.
----Còn tiêps----

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
=> Giáo án hóa học 11 chân trời sáng tạo
Từ khóa: Giáo án powerpoint hóa học 11 chân trời sáng tạo, GA trình chiếu hóa học 11 chân trời sáng tạo, GA điện tử hóa học 11 chân trời sáng tạo, bài giảng điện tử hóa học 11 chân trời sáng tạoĐẦY ĐỦ GIÁO ÁN CÁC BỘ SÁCH KHÁC
GIÁO ÁN WORD LỚP 11 CHÂN TRỜI SÁNG TẠO
GIÁO ÁN POWERPOINT LỚP 11 CHÂN TRỜI SÁNG TẠO
GIÁO ÁN CHUYÊN ĐỀ 11 CHÂN TRỜI SÁNG TẠO
GIÁO ÁN DẠY THÊM 11 CHÂN TRỜI SÁNG TẠO
CÁCH ĐẶT MUA:
Liên hệ Zalo: Fidutech - nhấn vào đây
