Giáo án bồi dưỡng học sinh giỏi Hóa học 10
Giáo án Chuyên đề Bồi dưỡng học sinh giỏi môn Hóa học 10 dùng cho 3 bộ sách mới: Kết nối tri thức, Chân trời , Cánh diều. Bộ tài liệu soạn theo chủ đề bao gồm: tóm tắt câu hỏi lí thuyết, câu hỏi và bài tập sẽ giúp học sinh ôn luyện năng cao, ôn thi HSG đạt kết quả cao. Giáo án tải về và chỉnh sửa được. Mời thầy cô tham khảo
Click vào ảnh dưới đây để xem giáo án rõ





Phần trình bày nội dung giáo án
CHỦ ĐỀ 1. CẤU TẠO NGUYÊN TỬA. TÓM TẮT KIẾN THỨC LÝ THUYẾT
I. THÀNH PHẦN NGUYÊN TỬ
- 1. Thành phần cấu tạo nguyên tử
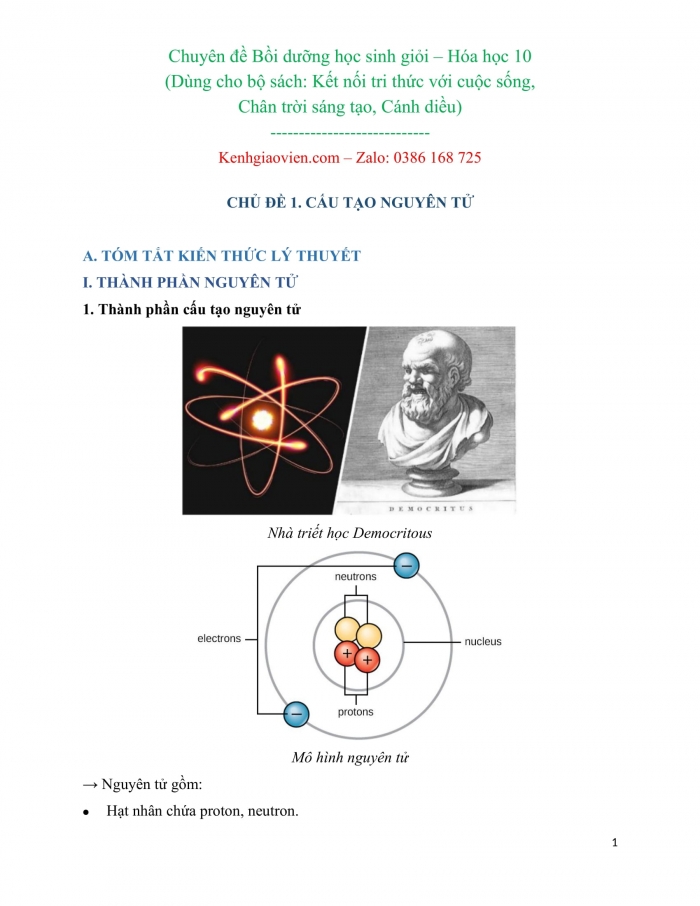
Nhà triết học Democritous
Mô hình nguyên tử
→ Nguyên tử gồm:
- Hạt nhân chứa proton, neutron.
- Vỏ nguyên tử chứa electron.
- Sự tìm ra electron
Thí nghiệm của Thomson- 1897 Joseph John Thomson
Thí nghiệm: Phóng điện trong một ống thủy tinh gần như chân không (gọi là ống tia âm cực)
- Khái niệm: Trong nguyên tử tồn tại một loại hạt có khối lượng và mang điện tích âm, được gọi là electron
- Kí hiệu: e
- Đặc điểm:
+ Điện tích: qe= -1,602.10-19 C quy ước là -1
+ Khối lượng me = 9,11.10-31 kg
- Sự khám phá ra hạt nhân nguyên tử
→ Kết quả:
- Hầu hết các hạt α xuyên thẳng qua lá vàng chứng tỏ nguyên tử có cấu tạo rỗng.
- Một số ít hạt α bị lệch quỹ đạo so với ban đầu chứng tỏ hạt nhân nguyên tử cùng điện tích dương như hạt hạt alpha (ion He2+, kí hiệu là α).
- Một số rất ít hạt α bị bật ngược trở lại chứng tỏ kích thước hạt nhân nhỏ hơn rất nhiều so với kích thước của nguyên tử và khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.
- Cấu tạo hạt nhân nguyên tử
Rutherford:
- Năm 1918, bắn phá hạt nhân nguyên tử nitrogen bằng các hạt alpha
- Xuất hiện một loại hạt mang một đơn vị điện tích dương, đó là proton
Chadwick
- Năm 1932, dùng các hạt alpha để bắn phá hạt nhân nguyên tử beryllium
- Xuất hiện của một loại hạt có khối lượng xấp xỉ hạt proton, nhưng không mang điện, đó là neutron, kí hiệu là n.
- Kích thước và khối lượng nguyên tử
- Khối lượng
- Khối lượng của nguyên tử vô cùng nhỏ, để biểu thị khối lượng nguyên tử, các hạt cơ bản người ta dùng đơn vị khối lượng là amu.
1 amu =
- Trong nguyên tử khối lượng của electron rất nhỏ so với khối lượng của proton và neutron. Nên khối lượng của nguyên tử tập trung chủ yếu ở hạt nhân.
- Kích thước nguyên tử
- Kích thước của nguyên tử là khoảng không gian tạo bởi sự chuyển động của electron. Nếu xem nguyên tử như một khối cầu thì đường kính nguyên tử khoảng 10-12 m.
→ Kích thước nguyên tử rất nhỏ.
→ Thường dùng đơn vị pm, nm, .
1pm = 10-12m
1 = 10-10m
1nm =10-9m
Đường kính nguyên tử, hạt nhân trong nguyên tử carbon
+ Đường kính nguyên tử lớp hơn đường kính hạt nhân khoảng 10 000 lần.
TỔNG KẾT
II. NGUYÊN TỐ HÓA HỌC
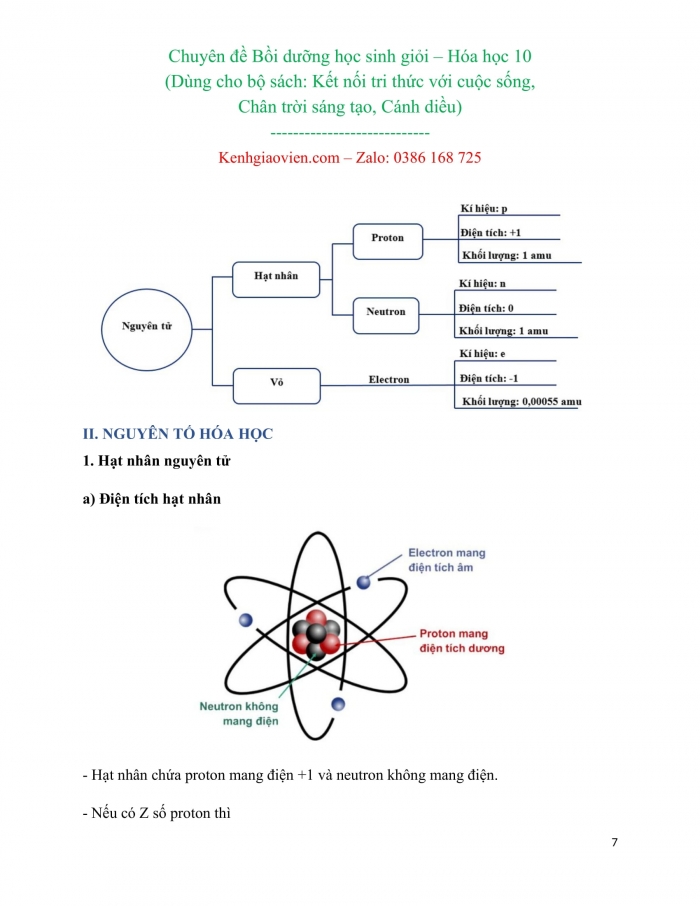
- Hạt nhân nguyên tử
- a) Điện tích hạt nhân
- Hạt nhân chứa proton mang điện +1 và neutron không mang điện.
- Nếu có Z số proton thì
+ Điện tích hạt nhân là = +Z
+ Số đơn vị điện tích hạt nhân = Z = số p= số e.
- b) Số khối
A = Z + N
Số khối= số proton + Số neutron
Số khối A= NTK tính theo amu
- Nguyên tố hóa học
- Tìm hiểu về số hiệu nguyên tử
- Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số hiệu nguyên tử (Z) của nguyên tố đó. Mỗi nguyên tố hóa học có một số hiệu nguyên tử.
- Nguyên tố hóa học
- Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân (Z)
- Kí hiệu nguyên tử
Trong đó:
- X là kí hiệu nguyên tố.
- Số hiệu nguyên tử Z và số khối A là đặc trưng cơ bản của nguyên tử.
- Đồng vị
- Khái niệm: những nguyên tử có cùng số proton nhưng khác nhau về số nơtron, do đó số khối A của chúng khác nhau.
Ngoài những đồng vị bền, các nguyên tố còn có một số đồng vị không bền, gọi là các đồng vị phóng xạ, được sử dụng nhiều trong đời sống, y học, nghiên cứu khoa học,..
- Nguyên tử khối và nguyên tử khối trung bình
* Nguyên tử khối
- Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử (1 amu)
- Có thể coi khối lượng nguyên tử gần bằng số khối của hạt nhân.
* Nguyên tử khối trung bình
- Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình của hỗn hợp các đồng vị của nguyên tố đó.
Ví dụ: Bằng phương pháp phổ khối lượng, người ta xác định được trong tự nhiên nguyên tố chlorine có hai đồng vị bền sau với % lần lượt là 75,77% và 24,23%.
Nguyên tử khố trung bình của chlorine là (35.75,77 + 37.24,23)/100= 35,48
Tổng quát: Công thức tính nguyên tử khối trung bình của nguyên tố X
III. CẤU TRÚC LỚP VỎ ELECTRON CỦA NGUYÊN TỬ
- Sự chuyển động của electron trong nguyên tử.
Mô hình nguyên tử theo Rutherford- Bohr | Mô hình nguyên tử hiện đại |
Electron chuyển động xung quanh hạt nhân theo quỹ đạo tròn hay bầu dục, giống như quỹ đạo hành tinh quay xung quanh mặt trời. | - Electron chuyển động rất nhanh, quanh hạt nhân, không theo quỹ đạo xác định, tạo thành đám mây electron. - Vùng không quanh hạt nhân mà tại đó xác suất tìm thấy (có mặt) electron khoảng 90% gọi là orbital nguyên tử kí hiệu là AO |
- Tìm hiểu về orbital nguyên tử
Loại AO | Hình dạng |
AOs | Hình cầu |
AOp | Hình số 8 nổi được phân bố theo các trục của hệ tọa độ Đề Các |
AO px ( vị trí AO p phân bố trên trục Ox) | |
AO py ( vị trí AO p phân bố trên trục Oy) | |
AO pz ( vị trí AO p phân bố trên trục Oz) | |
AOd,f | Có hình dạng phức tạp |
- Ô orbital
Một AO được biểu diễn bằng một ô vuông, gọi là ô orbital
|
Một AO có chứa tối đa 2 electron, chúng được gọi là cặp electron ghép đôi và được biểu diễn bằng 2 mũi tên ngược chiều nhau.
↑↓ |
Nếu AO chỉ chứa 1 electron, electron này được gọi là electron độc thân
↑ |
Nếu AO không chứa electron nào gọi là AO trống
- Lớp và phân lớp electron
- Tìm hiểu lớp electron.
Đặc điểm:
- Trong nguyên tử, các lớp electron được sắp xếp thành từng lớp từ gần đến xa hạt nhân, theo thứ tự từ lớp n=1 đến n=7 ứng với lớp K, L, M, N, O, P, Q.
- Các lớp electron trên cùng một lớp có năng lượng gần bằng nhau.
- Lớp electron càng gần hạt nhân có năng lượng càng thấp nên bị giữ càng chặt.
- Tìm hiểu phân lớp electron
Đặc điểm:
- Mỗi lớp electron được phân chia thành các phân lớp, kí hiệu bằng các chữ cái viết thường: s, p, d, f ( theo thứ tự năng lượng lớn dần s< p< d< f)
- Các electron thuộc phân lớp e, p, d, f được gọi tương ứng là các electron s, p, d, f.
- Các electron trên cùng một phân lớp có năng lượng bằng nhau.
- Lớp thứ n thì có n phân lớp và kí hiệu là ns, np, sd, nf,..
+ Phân lớp s có 1 AO
|
+ Phân lớp p có 3 AO
|
|
|
+ Phân lớp d có 5 AO
|
|
|
|
|
+ Phân lớp f có 7 AO
|
|
|
|
|
|
|
- Với 4 lớp đầu số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.
- Cấu hình electron nguyên tử
- Nguyên lí bền vững
- Nguyên lí: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 5s 4d 5p…
- Nguyên lí Pauli
- Nguyên lí: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau.
- Xác định số AO và số electron tối đa trong một phân lớp và trong mỗi lớp
- Quy tắc hund
- Số electron tối đa trên mỗi phân lớp s2, p6, d10,f14 → phân lớp bão hòa
- Số electron chứa một nửa số electron tối đa: s1,p3,d5,f7 → phân lớp bán bão hòa
- Phân lớp chưa đủ số electron tối đa → phân lớp chưa bão hòa
- Quy tắc: Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa.
- Tìm hiểu cách viết cấu hình electron nguyên tử
- Cấu hình electron nguyên tử biểu diễn sự phân bố electron trong vỏ nguyên tử trên các phân lớp thuộc các lớp khác nhau
*Cách viết cấu hình electron:
Bước 1: Xác định số electron của nguyên tử
Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần theo các nguyên lí và quy tắc phân bố electron trong nguyên tử.
Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron.
- Biểu diễn cấu hình electron theo ô orbital
*Các bước biểu diễn
Bước 1: Viết cấu hình electron nguyên tử
Bước 2: biểu diễn mỗi AO là một ô vuông, các AO cùng một phân lớp viết liền nhau, các phân lớp viết tách nhau.
Bước 3: Mỗi một electron biểu diễn bằng một mũi tên và điền từ trái sang phải và theo yêu cầu:
- Trong 1 AO electron đầu tiên được biểu diễn bằng mũi tên quay lên.
- 1 AO chứa tối đa 2 electron có chiều ngược nhau
- Trong mỗi phân lớp electron được phân bố sao cho số electron độc thân là tối đa.
Nguyên lí gần đúng slater
Các electron là những hạt mang điện tích âm nên khi chuyển động chúng sẽ che chắn lẫn nhau khỏi lực hút của hạt nhân nguyên tử. Khi đó năng lượng của hệ sẽ được tính như sau:
En,l = = -13,6 .
Trong đó:
b là hằng số chắn.
n là số lượng tử chính.
n* là số lượng tử hiệu dụng.
Z là số điện tích hạt nhân hiệu dụng.
L là số lượng tử phụ
Cách tính n*
n | 1 | 2 | 3 | 4 | 5 | 6 |
n* | 1 | 2 | 3 | 3,7 | 4 | 4,2 |
Cách tính hằng số chắn b:
Để tính hằng số chắn b, các AO được chia thành các nhóm như sau:
1s | 2s2p | 3s3p | 3d | 4s4p | 4d | 4f | … |
Tính hằng số chắn dựa theo nguyên tắc:
+ Trị số b đối với 1 electron đang xét bằng tổng các trị số góp electron khác.
+ Các electron ở các nhóm AO phía bên ngoài AO đang xét (bên phải cấu hình electron của nguyên tử sẽ không góp vào hằng số chắn:
Ví dụ: 1s22s22p63s23p3
- Nếu ta xét electron trong nhóm AO: 2s22p6 thì các electron ở nhóm 3s23p3 sẽ không góp gì vào hằng số chắn.
- Mỗi electron nằm trong cùng một nhóm AO đang xét sẽ đóng góp vào hằng số chắn một lượng 0, 35; riêng electron ở AO-1s chỉ đóng góp 0,3.
- c) Mỗi electron nằm phía bên trong của AO đang xét (phía bên tay trái) sẽ đóng góp như sau:
- AO đang xét là AO có vị trí nhóm AO giả sử là m, và AO đang xét là AO-s, p:
+Nhóm AO bên trong kế cạnh nhóm m đó là AO ở nhóm m-1:
+ Nếu AO ở nhóm số m-1: là AO-s.p: Đóng góp vào hằng số chắn 0, 85.
+ Nếu AO ở nhóm số m-1 là AO-d, f: Đóng góp vào hằng số chắn 0, 85.
- AO đang xét là AO có vị trí nhóm AO giả sử là m, và AO đang xét là AO-d, f:
+ Tất cả các electron ở các AO bên trong đều đóng góp hằng số chắn là 1.
- Tất cả các AO ở nhóm số m - 2: đều đóng góp vào hằng số chắn là 1.
Ví dụ: Cấu hình electron của Ni là 1s22s22p63s23p63d84s2
Chia thành các nhóm như sau (1s2)(2s22p6)(3s23p6)(3d8)(4s2 )
Các hằng số chắn của electron ở từng nhóm được tính như sau:
+ b (1s) = 1.0,3=0,3
+ b (2s2p) = 2.0,85 + 7.0,35= 4,15
+ b (3s3p) = 2.1+8.0.85 +7.0,35= 11,25
+ b (3d) = 18.1+7.0,35 = 20,45
+ b (4s) =10.1 +8.1 + 8.0,85 + 1.0,55 =25,15
Chú ý: electron đang xét không tham gia vào tính hằng số chắn.
B. CÂU HỎI VÀ BÀI TẬP
Câu 1. a) Cho rằng Sb có 2 đồng vị 121Sb và 123Sb, khối lượng trung bình của Sb là 121,75. Hãy tính thành phần phần trăm khối lượng của 121Sb trong Sb2O3. b) Hãy tính bán kính nguyên tử Li (đơn vị nm), biết thể tích của 1 mol tinh thể kim loại Li bằng 7,07 cm3 và trong tinh thể các nguyên tử Li chiếm 68%, còn lại là khe trống. Trả lời: a) Xét 2 mol Sb Gọi số mol của đồng vị 121Sb và 123Sb là a và b, ta có a+b= 2 (1) Khối lượng trung bình của Sb là 121,75 tức là: 121.a + 123.b = 2.121,75 → a= 1,25 ; b=0,75 % khối lượng của 121Sb trong Sb2O3 là: b) Xét 1 mol Li, ta có 6,02.1023. ..r3 = 0,68.7,07 → r = 1,24.10-8 cm (12,4nm) |
Câu 2: Người ta quy ước trị số năng lượng của electron trong nguyên tử có dấu (-). Electron trong He+ khi chuyển động trên một lớp xác định có một trị số năng lượng tương ứng đó là năng lượng của một mức. Có 3 trị số năng lượng (theo eV) của electron trong hệ He+ là -13,6; -54,4; -6,04. a) Hãy chỉ ra trị số năng lượng mức 1, 2, 3 từ 3 trị số trên. b) Từ trị số nào trong 3 trị số trên ta có thể xác định được một trị số năng lượng ion hóa của He? Giải thích? Trả lời: Ta có electron càng gần hạt nhân càng bị hút chặt, vì vậy electron ở mực 1 có năng lượng thấp nhất đó là -54,4 eV, electron ở mức thứ hai có mức năng lượng là -13,6 eV, electron ở mức thứ ba có năng lượng là 6,04 eV. Ta có He+ → He2+ + 1e Năng lượng cần thiết để tách electron mức 1 này là năng lượng ion hóa I2. Vậy năng lượng ion hóa I2 của He là 54,4 eV ( đây là năng lượng ở mức 1 của electron nhưng có dấu dương) |
----Còn tiếp ------

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
