Giáo án Powerpoint hóa học 10 kì 1 chân trời sáng tạo
Giáo án powerpoint hay còn gọi là giáo án điện tử, bài giảng điện tử, giáo án trình chiếu. Dưới đây là bộ giáo án powerpoint hóa học 10 kì 1 sách chân trời sáng tạo. Giáo án được thiết kế theo phong cách hiện đại, đẹp mắt để tạo hứng thú học tập cho học sinh. Với tài liệu này, hi vọng việc dạy môn hóa học 10 chân trời sáng tạo của thầy cô sẽ nhẹ nhàng hơn
Click vào ảnh dưới đây để xem giáo án rõ









Phần trình bày nội dung giáo án
CHÀO MỪNG CÁC EM HỌC SINH ĐẾN VỚI BÀI HỌC MỚI.
Các electron cũng được sắp xếp xung quanh sao cho có lợi về mặt năng lượng nhất. Em hãy dự đoán cách sắp xếp của electron trong nguyên tử?
BÀI 4:
CẤU TRÚC LỚP VỎ ELECTRON CỦA NGUYÊN TỬ
NỘI DUNG BÀI HỌC
Sự chuyển động của electron trong nguyên tử
Lớp và phân lớp electron
Cấu hình electron nguyên tử
- Sự chuyển động của electron trong nguyên tử
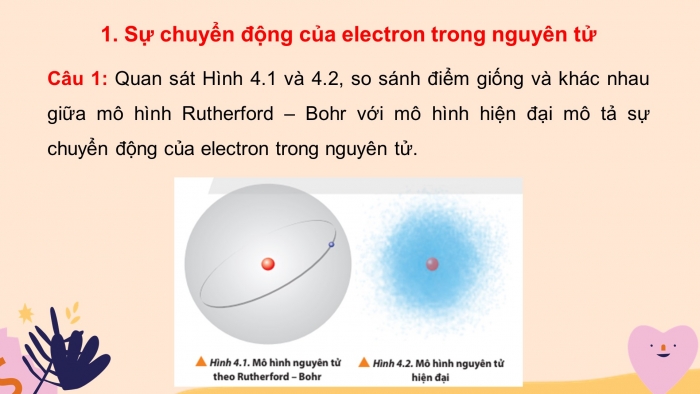
Câu 1: Quan sát Hình 4.1 và 4.2, so sánh điểm giống và khác nhau giữa mô hình Rutherford – Bohr với mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử.
So sánh:
- Giống nhau: Electron chuyển động xung quanh hạt nhân.
- Khác nhau:
KẾT LUẬN
- Theo mô hình nguyên tử Rutherford - Bohr, các electron chuyển động trên những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân.
- Theo mô hình hiện đại, trong nguyên tử các electron chuyển động rất nhanh xung quanh hạt nhân không theo quỹ đạo nhất định, tạo thành đám mây electron.
Hệ Mặt Trời gồm Mặt Trời ở trung tâm và các thiên thể quay quanh theo những quỹ đạo xác định. Hãy cho biết mô hình nguyên tử của nhà khoa học nào được gọi là mô hình hành tinh nguyên tử, tương tự như hệ Mặt Trời?
- Mô hình Rutherford – Bohr được gọi là mô hình hành tinh nguyên tử tương tự như Mặt Trời.
- Tìm hiểu về orbital nguyên tử
Câu 2: Quan sát Hình 4.3, phân biệt khái niệm đám mây electron và khái niệm orbital nguyên tử.
Câu trả lời:
- Giống nhau: đều là khu vực không gian xung quanh hạt nhân chứa electron nguyên tử.
- Khác nhau: Orbital là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt ( xác xuất tìm thấy) electron khoảng 90%.
Câu 3: Cho biết khái niệm orbital nguyên tử xuất phát từ mô hình nguyên tử của Rutherford – Bohr hay mô hình nguyên tử hiện đại.
Câu trả lời:
Khái niệm orbital bắt nguồn từ mô hình nguyên tử hiện đại.
Câu 4: Quan sát Hình 4.4, hãy cho biết điểm giống và khác nhau giữa các orbital p ( , , ).
Câu trả lời:
- Giống nhau: Đều có số 8 nổi
- Khác nhau: Các orbital định hướng khác nhau trong không gian
Câu hỏi:
- Quan sát hình trên và cho biết các quả táo chín rơi xuống tập trung ở khu vực nào?
- Khu vực nào ở gốc cây sẽ không tìm thấy các quả táo rơi xuống?
- Hãy liên hệ với xác suất có mặt các electron trong nguyên tử.
Câu trả lời:
- Các quả táo chín rơi xuống tập trung ở khu vực quanh gốc cây.
- Khu vực chính giữa gốc cây và khu vực cách gốc cây quá xa sẽ không tìm thấy các quả táo rơi xuống.
- Vùng xung quanh hạt nhân một khoảng nhất định, nơi ta có thể tìm thấy electron với xác suất lớn. Ở vị trí hạt nhân nguyên tử hay cách hạt nhân quá xa, ta không thể tìm thấy electron.
KẾT LUẬN
- Orbital nguyên tử (Atomic orbital, viết tắt là AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron là lớn nhất ( khoảng 90%)
- Một số AO thường gặp: s, p, d, f.
- Các AO có hình dạng khác nhau: AO s có hình cầu, AO p có hình số 8 nổi, AO d và f có hình dạng phức tạp.
- Lớp và phân lớp electron
- Tìm hiểu về lớp electron.
Câu 5: Quan sát Hình 4.5, nhận xét cách gọi tên các lớp electron bằng các chữ cái tương ứng với các lớp từ 1 đến 7.
- Các lớp electron được sắp xếp từ gần hạt nhân ra ngoài, được gọi tên bắt đầu từ chữ K đến Q (theo bảng chữ cái A, B, C,…) tương ứng với các lớp từ 1 đến 7
Câu 6: Từ Hình 4.5, cho biết lực hút của hạt nhân với electron ở lớp nào là lớn nhất và lớp nào là nhỏ nhất.
- Lực hút hạt nhân với electron lớp 1 là lớn nhất và lớp 7 là nhỏ nhất.
KẾT LUẬN
- Trong nguyên tử, các electron được sắp xếp thành từng lớp (kí hiệu K, L, M, N, O, P, Q) từ gần đến xa hạt nhân, theo thứ tự từ lớp n= 1 đến n=7.
- Các electron trên cùng một lớp có năng lượng gần bằng nhau.
- Tìm hiểu về phân lớp electron
Câu 7: Quan sát Hình 4.6, nhận xét về số lượng phân lớp trong các lớp từ 1 đến 4.
- Lớp 1 có 1 phân lớp: 1s.
- Lớp 2 có 2 phân lớp: 2s, 2p.
- Lớp 3 có 3 phân lớp: 3s, 3p, 3d.
- Lớp 4 có 4 phân lớp: 4s, 4p, 4d, 4f.
- Lớp n có n phân lớp: ns, np, nd, nf, ng,
KẾT LUẬN
- Mỗi lớp electron phân chia thành các phân lớp, được kí hiệu bằng các chữ cái viết thường là s, p, d, f.
- Các electron thuộc các phân lớp s, p, d và f được gọi tương ứng là các electron s, p, d và f.
- Các phân lớp s, p, s và f lần lượt có các số AO tương ứng là 1, 3, 5, 7.
- Các electron trên cùng một phân lớp có năng lượng bằng nhau. Với 4 lớp đầu (1, 2, 3, 4) số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.
- Cấu hình electron nguyên tử
- Tìm hiểu nguyên lí vững bền
Câu 8: Quan sát HÌnh 4.7, nhận xét chiều tăng năng lượng của các electron trên các AO ở trạng thái cơ bản (trạng thái có năng lượng thấp nhất).
Câu trả lời:
Nhìn chung, năng lượng của các electron trên các AO ở trạng thái cơ bản tăng theo số lớp electron. Tuy nhiên khi điện tích hạt nhân tăng có sự chèn mức năng lượng, mức 4s trở nên thấp hơn 3d, mức 5s thấp hơn 4d.
KẾT LUẬN
Nguyên lí vững bền: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p …
- Tìm hiểu nguyên lí Pauli (Pau-li)
Câu 9: Quan sát Hình 4.8, cho biết cách biểu diễn 2 electron trong một orbital dựa trên cơ sở nào.
- Trong một orbital, 2 electron có chiều quay ngược nhau
Câu 10: Quan sát Hình 4.9, hãy cho biết nguyên tử oxygen có bao nhiêu electron ghép đôi và bao nhiêu electron độc thân.
KẾT LUẬN
Nguyên lí Pauli: mỗi orbital chứa tối đa 2 electron và có chiều tự quay ngược nhau.
- Xác định số AO và số electron tối đa trong một phân lớp và trong
Câu 11: Từ Bảng 4.1, hãy chỉ ra mối quan hệ giữa số thứ tự lớp và số electron tối đa trong mỗi lớp.
Câu trả lời:
- Lớp n được chia thành n phân lớp.
- Mỗi phân lớp có số lượng AO nhất định, lớp n có n2 AO
- Mỗi AO chỉ chứa tối đa 2 electron.
- Do đó lớp n có tối đa 2n2

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Giáo án word đủ các môn
Giáo án Toán 10 chân trời sáng tạo đủ cả năm
Giáo án Ngữ văn 10 chân trời sáng tạo đủ cả năm
Giáo án Kinh tế pháp luật 10 chân trời sáng tạo đủ cả năm
Giáo án Hoá học 10 chân trời sáng tạo đủ cả năm
Giáo án Vật lí 10 chân trời sáng tạo đủ cả năm
Giáo án Sinh học 10 chân trời sáng tạo đủ cả năm
Giáo án Địa lí 10 chân trời sáng tạo đủ cả năm
Giáo án Hoạt động trải nghiệm, hướng nghiệp 10 bản 1 chân trời sáng tạo đủ cả năm
Giáo án Hoạt động trải nghiệm, hướng nghiệp 10 bản 2 chân trời sáng tạo đủ cả năm
Giáo án Âm nhạc 10 chân trời sáng tạo đủ cả năm
Giáo án chuyên đề Kinh tế pháp luật 10 chân trời sáng tạo đủ cả năm
Giáo án chuyên đề Vật lí 10 chân trời sáng tạo đủ cả năm
Giáo án chuyên đề Hóa học 10 chân trời sáng tạo đủ cả năm
Giáo án chuyên đề Sinh học 10 chân trời sáng tạo đủ cả năm
Giáo án chuyên đề Lịch sử 10 chân trời sáng tạo đủ cả năm
