Giáo án điện tử KHTN 7 chân trời- Phần hóa học bài 6: Giới thiệu về liên kết hóa học (4 tiết)
Bài giảng điện tử KHTN 7 chân trời- Phần hóa học. Giáo án powerpoint bài 6: Giới thiệu về liên kết hóa học (4 tiết). Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo
Xem: => Giáo án hóa học 7 chân trời sáng tạo (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét










Xem video về mẫu Giáo án điện tử KHTN 7 chân trời- Phần hóa học bài 6: Giới thiệu về liên kết hóa học (4 tiết)
Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hóa học 7 chân trời sáng tạo
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC HÔM NAY!
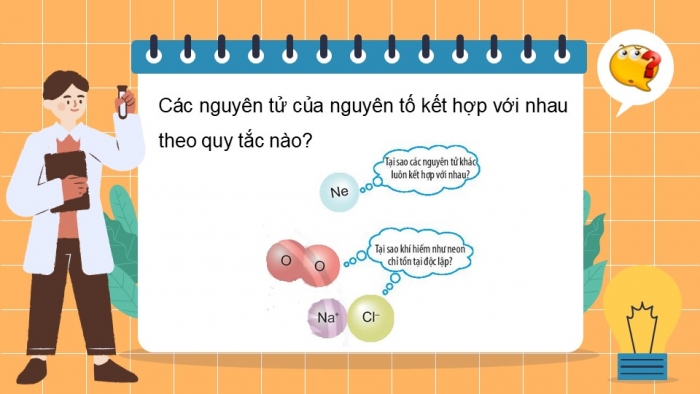
Các nguyên tử của nguyên tố kết hợp với nhau theo quy tắc nào?
BÀI 6: GIỚI THIỆU VỀ LIÊN KẾT HÓA HỌC
(4 Tiết)
NỘI DUNG BÀI HỌC
Vỏ nguyên tử khí hiếm
Liên kết ion
Liên kết cộng hóa trị
Chất ion, chất cộng hóa trị
Một số tính chất của chất ion và chất cộng hóa trị
- Vỏ nguyên tử khí hiếm
- Vỏ nguyên tử khí hiếm
- Hãy đọc tên các nguyên tố thuộc nhóm khí hiếm?
- Số electron ngoài cùng của mỗi nguyên tố?
- Số lớp electron của mỗi nguyên tố?
Trừ helium, vỏ nguyên tử của các nguyên tố còn lại có những điểm giống và khác nhau gì?
Giống nhau: Đều có 8 electron ở lớp ngoài cùng.
Khác nhau: Số lớp electron khác nhau (tăng dần: 1 lớp, 2 lớp, 3 lớp…)
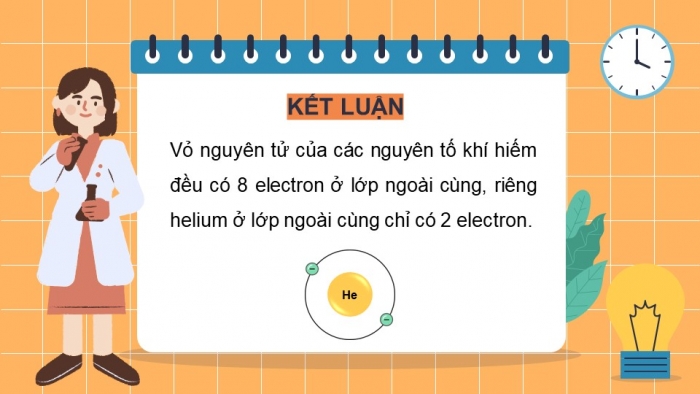
KẾT LUẬN
Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium ở lớp ngoài cùng chỉ có 2 electron.
Để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm, các nguyên tử của các nguyên tố có khuynh hướng nhường hoặc nhận hoặc góp chung electron.
Nguyên tử của các nguyên tố kim loại thường có khuynh hướng nhường electron.
Nguyên tử của các nguyên tố phi kim thường có khuynh hướng nhận hoặc góp chung electron.
- Liên kết ion
- Mô tả sự tạo thành ion dương
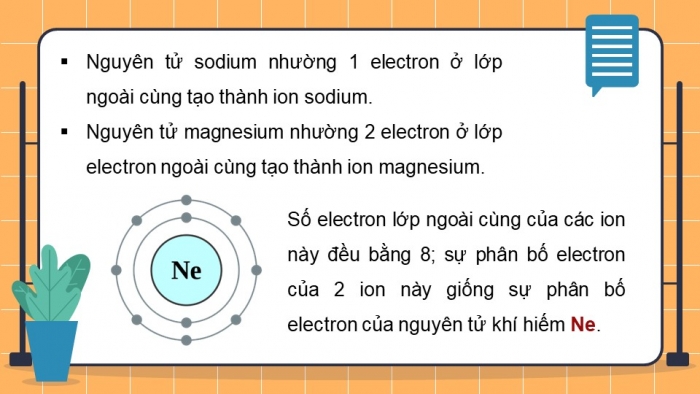
Quan sát Hình 6.2, em hãy mô tả sự tạo thành ion sodium, ion magnesium.
Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
- Nguyên tử sodium nhường 1 electron ở lớp ngoài cùng tạo thành ion sodium.
- Nguyên tử magnesium nhường 2 electron ở lớp electron ngoài cùng tạo thành ion
- Số electron lớp ngoài cùng của các ion này đều bằng 8; sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm Ne.
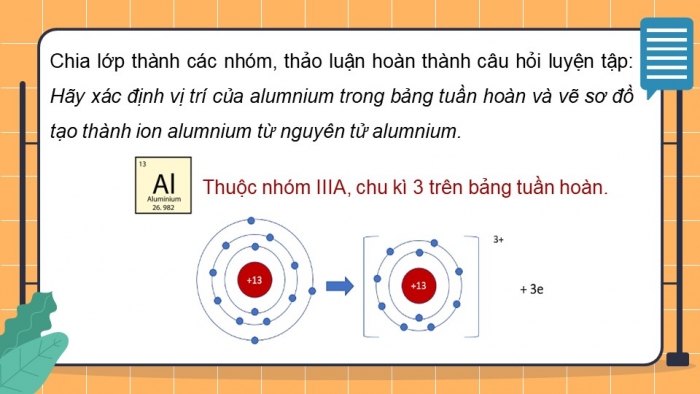
- Chia lớp thành các nhóm, thảo luận hoàn thành câu hỏi luyện tập: Hãy xác định vị trí của alumnium trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion alumnium từ nguyên tử alumnium.
- Chia lớp thành các nhóm, thảo luận hoàn thành câu hỏi luyện tập: Hãy xác định vị trí của alumnium trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion alumnium từ nguyên tử alumnium.
- Thuộc nhóm IIA, chu kì 4 trong bảng tuần hoàn.
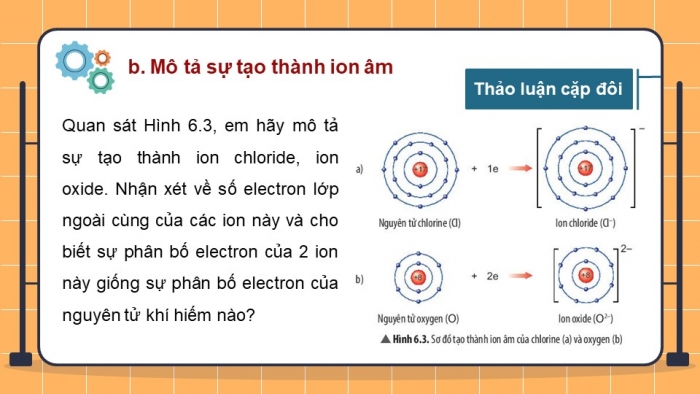
- Mô tả sự tạo thành ion âm
Quan sát Hình 6.3, em hãy mô tả sự tạo thành ion chloride, ion oxide. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
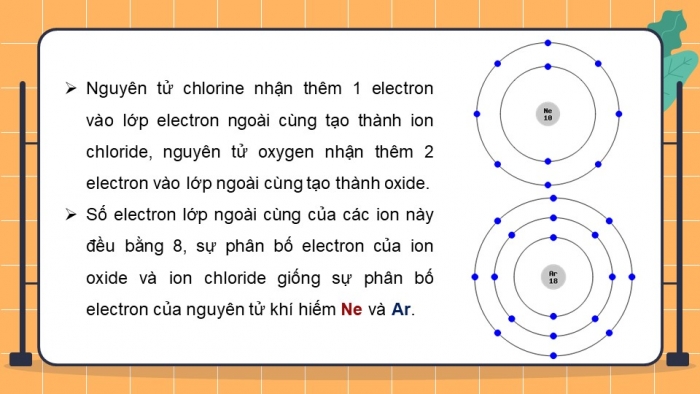
- Nguyên tử chlorine nhận thêm 1 electron vào lớp electron ngoài cùng tạo thành ion chloride, nguyên tử oxygen nhận thêm 2 electron vào lớp ngoài cùng tạo thành oxide.
- Số electron lớp ngoài cùng của các ion này đều bằng 8, sự phân bố electron của ion oxide và ion chloride giống sự phân bố electron của nguyên tử khí hiếm Ne và Ar.
Chia lớp thành các nhóm, thực hiện nhiệm vụ:
Nhóm 1 + 3:
Xác định vị trí của sunfur trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion sunfur ( ) từ nguyên tử sunfur.
Nhóm 2 + 4:
Xác định vị trí của nitrogen trên bảng tuần hoàn và vẽ sơ đồ tạo thành ion nitride từ nguyên tử nitrogen.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hóa học 7 chân trời sáng tạo
GIÁO ÁN WORD LỚP 7 - SÁCH CHÂN TRỜI
Giáo án Toán 7 chân trời sáng tạo đủ cả năm
Giáo án Vật lí 7 chân trời sáng tạo đủ cả năm
Giáo án Hoá học 7 chân trời sáng tạo đủ cả năm
Giáo án Sinh học 7 chân trời sáng tạo đủ cả năm
Giáo án Tin học 7 chân trời sáng tạo đủ cả năm
Giáo án Ngữ văn 7 chân trời sáng tạo cả năm
Giáo án Công dân 7 chân trời sáng tạo đủ cả năm
Giáo án Công nghệ 7 chân trời sáng tạo đủ cả năm
Giáo án Lịch sử 7 chân trời sáng tạo đủ cả năm
Giáo án Địa lí 7 chân trời sáng tạo đủ cả năm
Giáo án Thể dục 7 chân trời sáng tạo đủ cả năm
Giáo án Mĩ thuật 7 bản 1 chân trời sáng tạo đủ cả năm
Giáo án Mĩ thuật 7 bản 2 chân trời sáng tạo đủ cả năm
Giáo án Hoạt động trải nghiệm, hướng nghiệp 7 bản 1 chân trời sáng tạo đủ cả năm
Giáo án Hoạt động trải nghiệm, hướng nghiệp 7 bản 2 chân trời sáng tạo đủ cả năm
GIÁO ÁN POWERPOINT LỚP 7 - SÁCH CHÂN TRỜI
GIÁO ÁN LỚP 7 CÁC BỘ SÁCH KHÁC
Giáo án đủ các môn lớp 7 sách kết nối tri thức (bản word)
Giáo án đủ các môn lớp 7 sách kết nối tri thức (bản powrerpoint)
Giáo án đủ các môn lớp 7 sách cánh diều (bản word)
Giáo án đủ các môn lớp 7 sách cánh diều (bản powrerpoint)
