Giáo án và PPT KHTN 7 chân trời Bài 6: Giới thiệu về liên kết hoá học
Đồng bộ giáo án word và powerpoint (ppt) Bài 6: Giới thiệu về liên kết hoá học. Thuộc chương trình Khoa học tự nhiên 7 (Hoá học) chân trời sáng tạo. Giáo án được biên soạn chỉnh chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word










Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 7 chân trời sáng tạo
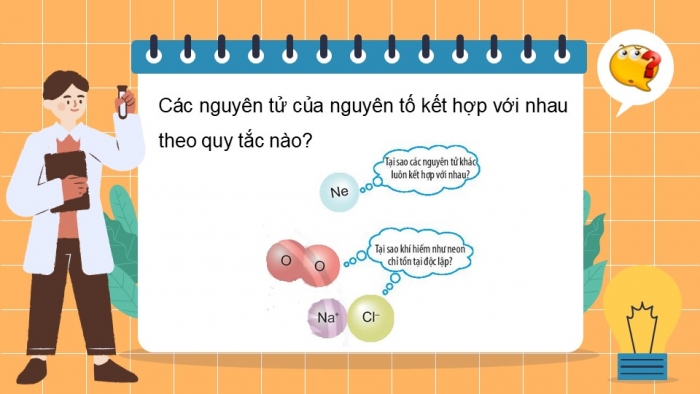
BÀI 6: GIỚI THIỆU VỀ LIÊN KẾT HÓA TRỊ
HOẠT ĐỘNG KHỞI ĐỘNG
GV cho HS xem video vui về sức mạnh của sự đoàn kết
Link youtube: https://www.youtube.com/watch?v=lvbjhB-j9YE
HS nêu ý nghĩa rút ra được từ video. GV dẫn dắt để đặt vấn đề vào bài mới: Giống như con người và các sinh vật, các nguyên tử của các nguyên tố (ngoại trừ nguyên tố khí hiếm) thường có xu hướng kết hợp với nhau. Vậy chúng kết hợp theo nguyên tắc nào? Các nguyên tử khí hiếm các đặc điểm gì đặc biệt mà lại không có xu hướng kết hợp với các nguyên tử khác?
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
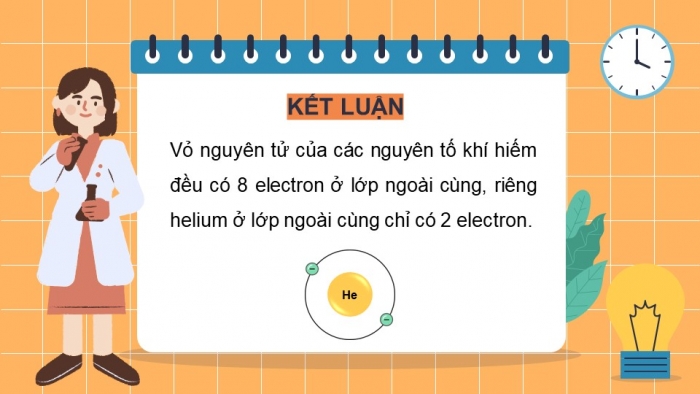
1. VỎ NGUYÊN TỬ KHÍ HIẾM
Hoạt động 1: Tìm hiểu vỏ nguyên tử khí hiếm
GV hướng dẫn HS quan sát Hình 6.1 trong SGK, tổ chức cho HS thảo luận theo câu hỏi 1 trong SGK.
Sản phẩm dự kiến:
- Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium ở lớp ngoài cùng chỉ có 2 electron.
2. LIÊN KẾT ION
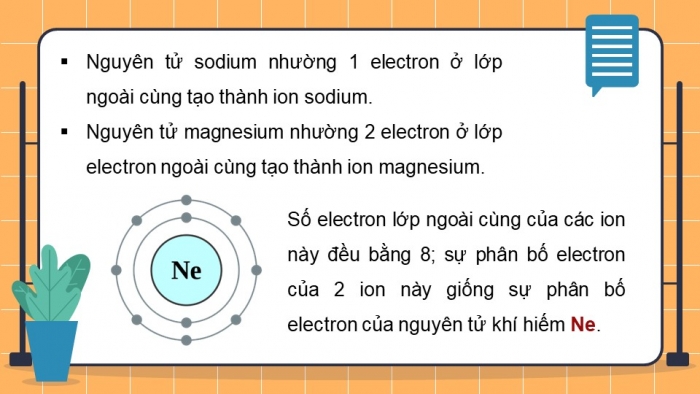
Hoạt động 2: Tìm hiểu sự hình thành liên kết ion
Sử dụng kĩ thuật mảnh ghép, chia lớp thành 4 nhóm, thảo luận theo 2 vòng
Vòng 1: Nhóm chuyên gia
Nhóm chuyên gia 1 và 2: thảo luận câu hỏi 2 trong SGK
Quan sát Hình 6.2, em hãy mô tả sự tạo thành ion sodium, ion magnesium. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào.
Nhóm chuyên gia 3 và 4: thảo luận câu hỏi 3 trong SGK
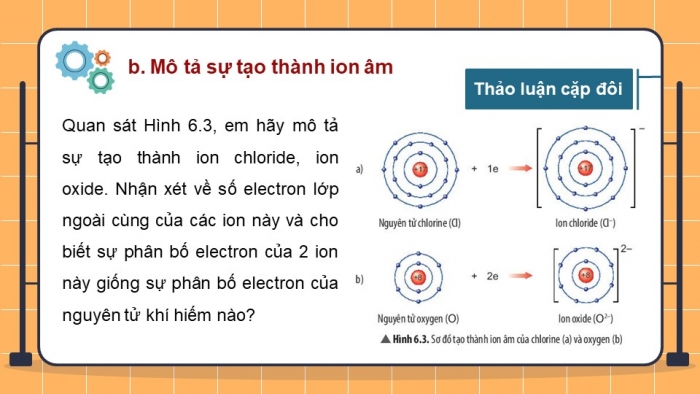
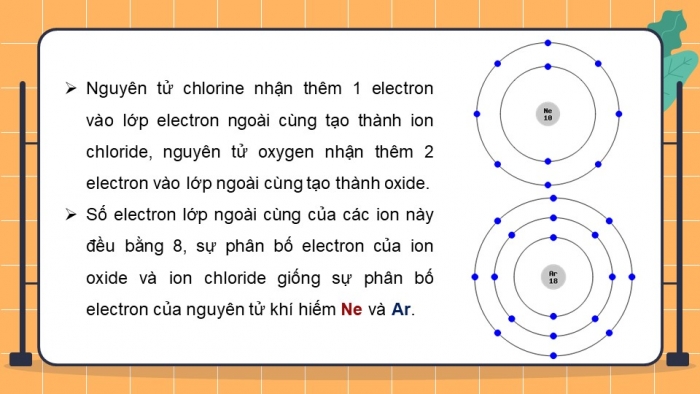
Quan sát Hình 6.3, em hãy mô tả sự tạo thành ion chloride, ion oxide. Nhận xét vể số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào.
Vòng 2: Nhóm mảnh ghép
Các thành viên trong nhóm 1, 2, 3, 4 di chuyển về nhóm mới A, B, C, D. Trong mỗi nhóm mới đều gồm các thành viên từ các nhóm chuyên gia ở cả 2 lĩnh vực.
Đầu tiên các chuyên gia sẽ chia sẻ kiến thức mình vừa thảo luận được cho thành viên trong nhóm mảnh ghép.
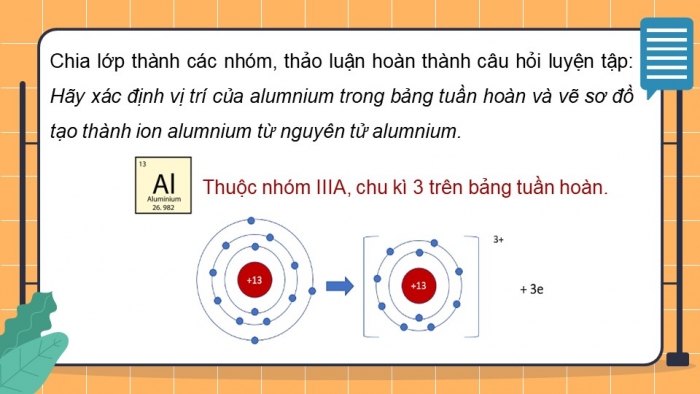
Sau đó, các thành viên trong nhóm mảnh ghép cùng nhau thảo luận các câu hỏi mới như sau:
1. Hãy xác định vị trí của aluminium trên bảng tuần hoàn và vẽ sơ đổ tạo thành ion aluminium từ nguyên tử aluminium.
2. Em hãy xác định vị trí của sulfur trên bảng tuần hoàn và vẽ sơ đổ tạo thành ion sulfide (S2-) từ nguyên tử sulfur.
3. Quan sát Hình 6.4a, em hãy mô tả quá trình tạo thành liên kết ion trong phân tử sodium chloride. Hãy nêu một số ứng dụng của sodium chloride trong đời sống.
Sản phẩm dự kiến:
- Liên kết ion là liên kết giữa ion dương và ion âm
- Các ion dương và ion âm đơn nguyên tử có lớp ngoài electron ngoài cùng giống với nguyên tử của nguyên tố khí hiếm.
3. LIÊN KẾT CỘNG HÓA TRỊ
Hoạt động 3: Tìm hiểu liên kết cộng hoá trị
Sử dụng phương pháp trực quan quan: sát Hình 6.5,6.6,6.7 trong SGK để rút ra được sự khác nhau giữa cấu tạo vỏ nguyên tử khí hiếm và các nguyên tử còn lại, thây được khí hiếm bển hơn, biết được sự hình thành liên kết cộng hoá trị.
- Phiếu học tập 1:
Câu 1: Dựa vào Bảng tuần hoàn, hãy chỉ ra nguyên tố khí hiếm gần nhất của hydrogen và oxygen. Để có lớp electron ngoài cùng gióng nguyên tố khí hiếm gần nhất, nguyên tử hydrogen và oxygen có xu hướng gì?
Câu 2: Dựa vào các hình 6.5,6.6 và 6.7, em hãy cho biết số electron lớp ngoài cùng của mỗi nguyên tử trong phân tử hydrogen và oxygen là bao nhiêu. Khi đó, lớp electron ngoài cùng của nguyên tử hydrogen và nguyên tử oxygen sẽ giống với khí hiếm nào?
Câu 3: Em hãy mô tả quá trình tạo thành liên kết cộng hoá trị trong phân tử hydrogen và oxygen.
Câu 4: Quan sát Hình 6.8, em hãy cho biết số electron dùng chung của nguyên tử H và nguyên tử O.Trong phân tử nước, số electron ở lớp ngoài cùng của O và H là bao nhiêu và giống với khí hiếm nào?
Câu 5: Em hãy mô tả quá trình tạo thành và biểu diễn liên kết cộng hoá trị trong phân tử nước.
Sản phẩm dự kiến:
- Liên kết cộng hóa trị là liên kết được hình thành bởi sự dùng chung electron giữa hai nguyên tử.
- Liên kết cộng hóa trị thường là liên kết giữa hai nguyên tử của nguyên tố phi kim với phi kim
4. CHẤT ION, CHẤT CỘNG HÓA TRỊ
Hoạt động 4: Tìm hiểu chất ion, chất cộng hoá trị
Sử dụng phương pháp trực quan Từ việc thực hiện thí nghiệm 1 hoặc quan sát Hình 6.9,6.10 trong SGK, giúp HS nhận biết được các chất ion và chất cộng hoá trị.
- Phiếu học tập 2:
Câu 1: Cho biết mỗi phân tử của chất trong Hình 6.9 được tạo bởi các ion nào. Ở điều kiện thường, các chất này ở thể gì?
Câu 2: Quan sát và cho biết thể của các chất có trong Hình 6.10.
Câu 3: Nêu một số ví dụ về chất cộng hoá trị và cho biết thể của chúng ở điều kiện thường.
Sản phẩm dự kiến:
- Chất được tạo bởi ion dương và ion âm được gọi là chất ion.
- Chất được tạo thành nhờ liên kết cộng hóa trị được gọi là chất cộng hóa trị.
- Ở điều kiện thường, chất ion thường ở thể rắn, chất cộng hóa trị có thể ở các thể khác nhau (rắn, lỏng, khí).
5. MỘT SỐ TÍNH CHẤT CỦA CHẤT ION VÀ CHẤT CỘNG HÓA TRỊ
Hoạt động 5: Thí nghiệm tìm hiểu một số tính chất của chất ion và chất cộng hoá trị
Sử dụng phương pháp trực quan việc thực hiện Thí nghiệm 1 và quan sát Hình 6.11, 6.12 trong SGK, GV giúp HS rút ra được sự khác nhau vể khả năng hoà tan và khả năng dẫn điện giữa các hợp chất ion và hợp chất cộng hoá trị.
- Phiếu học tập 3:
Câu 1: Quan sát Thí nghiệm 1 (Hình 6.11,6.12) và đánh đấu để hoàn thành bảng sau:
| Tính chất | Muối | Đường |
| Tan trong nước | ||
| Dẫn điện được |
Câu 2 : Quan sát Thí nghiệm 2 (Hình 6.13), cho biết muối hay đường bền nhiệt hơn. Ở ống nghiệm nào có sự tạo thành chất mới?
Sản phẩm dự kiến:
- Chất ion khó bay hơi, khó nóng chảy, khi tan trong nước tạo dung dịch dẫn được điện
- Chất cộng hóa trị thường dễ bay hơi, kém vền với nhiệt, một số chất tan được trong nước thành dung dịch. Tùy thuộc vào chất cộng hóa trị khi tan trong nước mà dung dịch thu được có thể dẫn điện hoặc không dẫn điện.
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Phát biểu nào sau đây đúng?
A. Các nguyên tố khí hiếm đều rất khó hoặc không kết hợp với nguyên tố khác thành hợp chất.
B. Vỏ nguyên tử của các nguyên tố khí hiếm đều có cùng số lớp electron.
C. Tất cả các nguyên tố khí hiếm đều có 8 electron ở lớp electron ngoài cùng.
D. Hợp chất tạo bởi các nguyên tố khí hiếm đều ở thể khí
Câu 2: Hãy chọn phát biểu đúng để hoàn thành câu sau: Để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm, các nguyên tử của các nguyên tố có khuynh hướng
A. Nhường các electron ở lớp ngoài cùng.
B. Nhận thêm electron vào lớp electron ngoài cùng.
C. Nhường electron hoặc nhận electron để lớp electron ngoài cùng đạt trạng thái bền (có 8 electron).
D. Nhường electron hoặc nhận electron hoặc góp chung electron.
Câu 3: Phát biểu nào sau đây đúng?
A. Để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhường các electron ở lớp ngoài cùng.
B. Để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
C. Để tạo ion dương thì nguyên tử của nguyên tố kim loại sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
D.Để tạo ion dương thì nguyên tử của nguyên tố hoá học sẽ nhường các electron ở lớp ngoài cùng.
Sản phẩm dự kiến:
Câu 1: A
Câu 2: D
Câu 3: D
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Trong quả nho chín có chứa nhiều glucose. Phân tử glucose gồm có 6 nguyên tử carbon, 12 nguyên tử hydrogen và 6 nguyên tử oxygen. Theo em, trong phân tử glucose có liên kết ion hay liên kết cộng hoá trị? Giải thích và tính khối lượng phân tử glucose.
Câu 2: Magnesium oxide (gồm 1 nguyên tử magnesium và 1 nguyên tử oxygen) có nhiều ứng dụng trong đời sống. Nó là thành phần chính trong các lò sản xuất sắt, thép, các loại kim loại màu, thủy tinh hay xi măng, … Em hãy cho biết thêm các ứng dụng khác của magnesium oxide. Vẽ sơ đồ hình thành liên kết tạo ra phân tử magnesium oxide và tính khối lượng phân tử của nó.
t và cách tính khối lượng phân tử
- HS quan sát hình 5.1 + Đọc thông tin, chiếu ảnh mô phỏng 5.2 hoạt động cặp đôi thảo luận nội dung 1 trong SGK.
- GV chia lớp thành các nhóm và yêu cầu các nhóm quan sát ảnh vể mô phỏng các đơn chất và hợp chất như trong Hình 5.3, 5.4 ở SGK. thảo luận và hoàn thành câu hỏi 2,3 trong SGK.
Sản phẩm dự kiến:
- Phân tử là hạt đại diện cho chất, gồm một số nguyên tử kết hợp với nhau và thể hiện đầy đủ tính chất hóa học của chất
- Chú ý: Các đơn chất kim loại và một số phi kim rắn, khí hiếm có phân tử là nguyên tử (là dạng đặc biệt của phân tử)
- Khối lượng phân tử của một chất là khối lượng tính bằng đơn vị amu của một phân tử chất đó, có giá trị bằng tổng khối lượng các nguyên tử có trong phân tử.
- Tổng quát: Phân tử của hợp chất gồm 3 nguyên tố: AxByCz
Trong đó có x nguyên tử của nguyên tố A
y nguyên tử của nguyên tố B
z nguyên tử của nguyên tố C
⤇ KLPT = x. KLNTA + y.KLNTB + z.KLNTC
2. ĐƠN CHẤT
Hoạt động 2: Tìm hiểu về đơn chất
- Từ việc quan sát Hình 5.5 trong SGK, GV hướng dẫn HS liệt kê các đơn chất và tên gọi tương ứng với các nguyên tố có trong Hình 5.5.
- GV chia lớp thành các nhóm, yêu cầu HS quan sát Hình 5.5 trong SGK (hoặc dùng máy chiếu phóng to Hình 5.5); hướng dẫn các nhóm HS quan sát kĩ
Sản phẩm dự kiến:
- Đơn chất là những chất được cấu tạo nên từ một nguyên tố hóa học.
- Đơn chất được phân thành kim loại, phi kim, khí hiếm tương ứng. Ở điều kiện thường:
+ Các kim loại như đồng, sắt, nhôm,…) tồn tại ở thể rắn (trừ thủy ngân tồn tại ở thể lỏng).
+ Các phi kim có thể tồn tại ở thể rắn (sulfur, carbon,…), thể khí (như hydrogen, nitrogen,…) và thể lỏng như bromine.
+ Các khí hiếm đều tồn tại ở thể khí.
3. HỢP CHẤT
Hoạt động 3: Tìm hiểu về hợp chất
GV chia lớp thành các nhóm và yêu cầu các nhóm quan sát ảnh về mô hình các đơn chất và hợp chất như trong Hình 5.7,5.8 ở SGK. GV hướng dẫn các nhóm HS quan sát và trả lời các câu hỏi:
1. Quan sát Hình 5.7, em hãy cho biết phân tử chất nào là phân tử đơn chất, phân tử chất nào là phân tử hợp chất? Giải thích.
- Phân tử Hình 5.7 (a), (b) là đơn chất vì được tạo thành từ 1 nguyên tổ.
- Phân tử Hình 5.7 (c) là hợp chất vì được tạo thành từ nhiều nguyên tố.
2. Muối ăn (Hình 5.8) là đơn chất hay hợp chất? Vì sao?
- Muối ăn là hợp chất vì nó được tạo bởi từ nhiều nguyên tó hoá học (gổm nguyên tố Na và nguyên tố Cl).
3. Hãy nêu một số ví dụ về phân tử hợp chất mà em biết và cho biết phân tử đó được tạo thành từ các nguyên tử của nguyên tố nào.
GV hướng dẫn HS tìm thêm một sổ hợp chất có ở xung quanh các em;
Một số hợp chất gợi ý:
Phân tử hợp chất | Đặc điểm cấu tạo |
| Phân tử khí ammonia | 1 nguyên tử nitrogen và 3 nguyên tử hydrogen |
| Phân tử ethanol (có trong cón sát khuẩn) | 2 nguyên tửcarbon, 6 nguyên tử hydrogen và 1 nguyên tửoxygen |
| Phân tử glucose (có trong quả nho chín) | 6 nguyên tửcarbon, 12 nguyên tử hydrogen và 6 nguyên tửoxygen |
Sản phẩm dự kiến:
- Phân tử hợp chất gồm nhiều nguyên tố hoá học tạo nên
- Hợp chất là chất được tạo nên từ hai hay nhiều nguyên tố hóa học.
- Phân loại: + Hợp chất vô cơ. Vd muối ăn…
+ Hợp chất hữu cơ. Vd rượu, dầu ăn…
- Đặc điểm cấu tạo: Các nguyên tử của các nguyên tố liên kết nhau theo thứ tự và 1 tỉ lệ nhất định.
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Khối lượng phân tử là
A. tổng khối lượng các nguyên tố có trong phân tử.
B. tổng khối lượng các hạt hợp thành của chất có trong phân tử.
C. tổng khối lượng các nguyên tử có trong hạt hợp thành của chất.
D. khối lượng của nhiều nguyên tử.
Câu 2: Phân tử (X) được tạo thành bởi nguyên tố carbon và nguyên tố oxygen. Khối lượng phân tử (X) là
A. 28 amu.
B. 32 amu.
C. 44 amu.
D. 28 amu hoặc 44 amu.
Câu 3: Phát biểu đúng là
A. Phân tử đơn chất là do các đơn chất tạo thành.
B. Phân tử hợp chất là do các hợp chất tạo thành.
C. Các phân tử khí trơ đều do các nguyên tử khí trơ kết hợp với nhau theo một trật tự xác định.
D. Phân tử kim loại do các nguyên tử kim loại kết hợp với nhau theo một trật tự xác định.
Sản phẩm dự kiến:
Câu 1: C
Câu 2: D
Câu 3: D
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Em hãy liệt kê một số phân tử chính có trong không khí. Tính khối lượng phân tử của chúng.
Câu 2: Trong mật ong có nhiều fructose. Phân tử frutose gồm 6 nguyên tử C, 12 nguyên tử H và 6 nguyên tử O. Em hãy cho biết fructose thuộc loại phân tử gì? Tính khối lượng phân tử frutose.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 7 chân trời sáng tạo
TÀI LIỆU GIẢNG DẠY KHTN 7 (HOÁ HỌC) KẾT NỐI TRI THỨC
Giáo án Hoá học 7 kết nối tri thức đủ cả năm
Giáo án điện tử hóa học 7 kết nối tri thức
Trò chơi khởi động Hoá học 7 kết nối tri thức
Video AI khởi động Hoá học 7 kết nối tri thức hấp dẫn
Trắc nghiệm hoá học 7 kết nối tri thức
Đề thi khoa học tự nhiên 7 kết nối tri thức
File word đáp án hóa học 7 kết nối tri thức
Câu hỏi tự luận hóa học 7 kết nối tri thức
Kiến thức trọng tâm khoa học tự nhiên 7 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 7 kết nối tri thức
Phiếu học tập theo bài Hoá học 7 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 7 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 7 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY KHTN 7 (HOÁ HỌC) CHÂN TRỜI SÁNG TẠO
Giáo án Hoá học 7 chân trời sáng tạo đủ cả năm
Giáo án điện tử hóa học 7 chân trời sáng tạo
Trò chơi khởi động Hoá học 7 chân trời sáng tạo
Video AI khởi động Hoá học 7 chân trời sáng tạo hấp dẫn
Trắc nghiệm hoá học 7 chân trời sáng tạo
Đề thi khoa học tự nhiên 7 chân trời sáng tạo
File word đáp án hóa học 7 chân trời sáng tạo
Câu hỏi tự luận hóa học 7 chân trời sáng tạo
Kiến thức trọng tâm khoa học tự nhiên 7 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 7 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 7 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 7 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 7 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY KHTN 7 (HOÁ HỌC) CÁNH DIỀU
Giáo án Hoá học 7 cánh diều đủ cả năm
Giáo án điện tử hóa học 7 cánh diều
Trò chơi khởi động Hoá học 7 cánh diều
Video AI khởi động Hoá học 7 cánh diều hấp dẫn
Trắc nghiệm hoá học 7 cánh diều
Đề thi khoa học tự nhiên 7 cánh diều
File word đáp án hóa học 7 cánh diều
Câu hỏi tự luận hóa học 7 cánh diều
Kiến thức trọng tâm khoa học tự nhiên 7 cánh diều
Đề kiểm tra 15 phút Hoá học 7 cánh diều
Phiếu học tập theo bài Hoá học 7 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 7 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 7 cánh diều cả năm
