Giáo án hệ thống kiến thức khoa học tự nhiên 7 kết nối tri thức
Dưới đây là tài liệu giáo án hệ thống kiến thức khoa học tự nhiên 7 kết nối tri thức. Tài liệu này được xây dựng bao gồm: ôn tập kiến thức lí thuyết, bài tập trắc nghiệm và tự luận, đáp án đầy đủ chi tiết sẽ giúp thấy cô ôn tập cho học sinh kiến thức môn khoa học tự nhiên 7 một cách có hệ thống. Bộ tài liệu này được xây dựng là sự kết hợp giữa sơ đồ tư duy, hệ thống kiến thức và có file word tải về được.
Click vào ảnh dưới đây để xem giáo án rõ






Một số tài liệu quan tâm khác
Phần trình bày nội dung giáo án
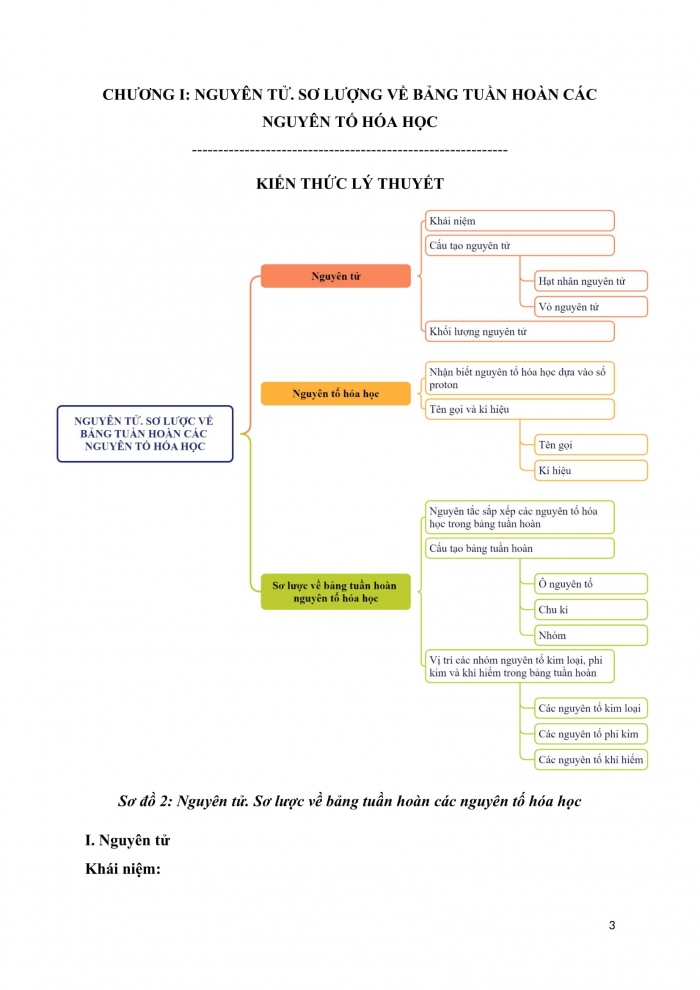
CHƯƠNG I: NGUYÊN TỬ. SƠ LƯỢNG VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
------------------------------------------------------------
KIẾN THỨC LÝ THUYẾT
Sơ đồ 2: Nguyên tử. Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- Nguyên tử
Khái niệm:
Nguyên tử là hạt vô cùng nhỏ, trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm.
Cấu tạo nguyên tử:
- Hạt nhân nguyên tử gồm các hạt proton mang điện tích dương và neutron không mang điện.
- Vỏ nguyên tử gồm các hạt electron mang điện tích âm sắp xếp thành từng lớp.
Khối lượng nguyên tử:
Khối lượng nguyên tử tập trung ở hạt nhân, đươc coi bằng khối lượng của hạt nhân và có đơn vị là amu.
- Nguyên tố hóa học
Nhận biết nguyên tố hóa học dựa vào số proton:
- Mỗi nguyên tố hóa học có tính chất riêng biệt do được tạo thành từ các nguyên tử có số proton xác định.
- Những nguyên tử có cùng số proton thuộc cùng một nguyên tố hóa học.
- Các nguyên tử thuộc cùng một nguyên tố hóa học có thể có số neutron khác nhau.
Tên gọi và kí hiệu của nguyên tố hóa học:
- Tên gọi: Ngày nay, tên gọi của các nguyên tố được quy định dùng thống nhất trên toàn thế giới theo IUPAC.
- Kí hiệu: gồm một hoặc hai chữ cái có trong tên gọi của nguyên tố, trong đó chữ cái đầu được viết ở dạng chữ in hoa và chữ cái sau viết thường.
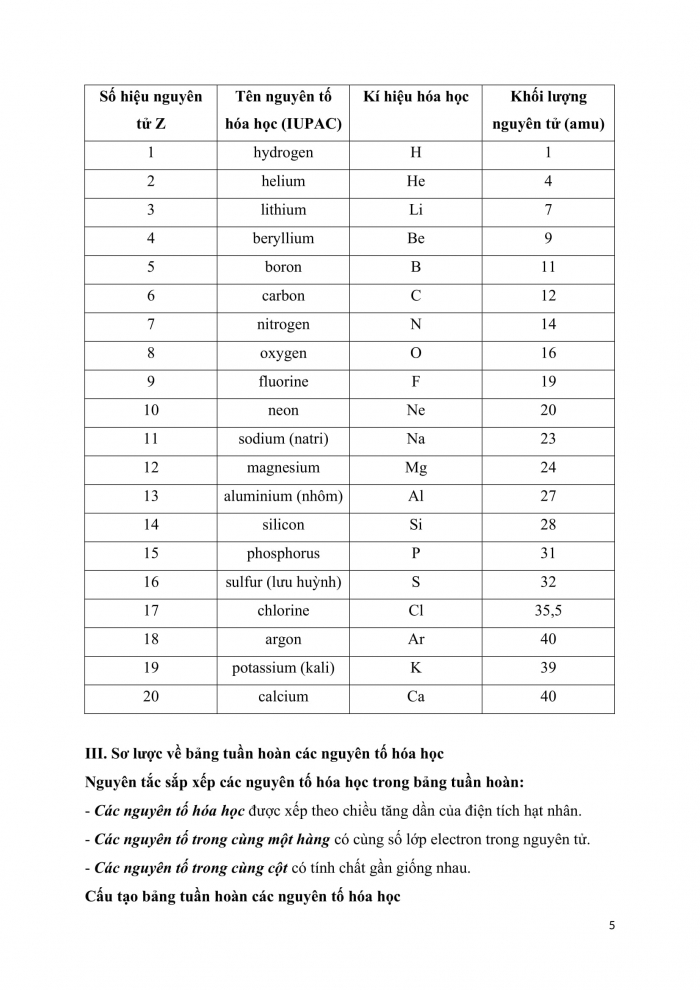
Bảng. Tên gọi, kí hiệu hóa học và khối lượng nguyên tử của
20 nguyên tố đầu tiên
Số hiệu nguyên tử Z | Tên nguyên tố hóa học (IUPAC) | Kí hiệu hóa học | Khối lượng nguyên tử (amu) |
1 | hydrogen | H | 1 |
2 | helium | He | 4 |
3 | lithium | Li | 7 |
4 | beryllium | Be | 9 |
5 | boron | B | 11 |
6 | carbon | C | 12 |
7 | nitrogen | N | 14 |
8 | oxygen | O | 16 |
9 | fluorine | F | 19 |
10 | neon | Ne | 20 |
11 | sodium (natri) | Na | 23 |
12 | magnesium | Mg | 24 |
13 | aluminium (nhôm) | Al | 27 |
14 | silicon | Si | 28 |
15 | phosphorus | P | 31 |
16 | sulfur (lưu huỳnh) | S | 32 |
17 | chlorine | Cl | 35,5 |
18 | argon | Ar | 40 |
19 | potassium (kali) | K | 39 |
20 | calcium | Ca | 40 |
III. Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn:
- Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân.
- Các nguyên tố trong cùng một hàng có cùng số lớp electron trong nguyên tử.
- Các nguyên tố trong cùng cột có tính chất gần giống nhau.
Cấu tạo bảng tuần hoàn các nguyên tố hóa học
- Ô nguyên tố: Mỗi nguyên tố hóa học được xếp vào một ô của bảng tuần hoàn, gọi là ô nguyên tố.
- Mỗi ô nguyên tố cho biết:
+ Kí hiệu hóa học
+ Tên nguyên tố
+ Số hiệu nguyên tử ( = Số đơn vị điện tích hạt nhân = Số electron trong nguyên tử)
+ Khối lượng nguyên tử của nguyên tố đó
- Số hiệu nguyên tử chính là số thứ tự của nguyên tố trong bảng tuần hoàn.
- Ví dụ:
- Chu kì: Là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần khi đi từ trái sang phải.
- Bảng tuần hoàn hiện nay có 7 chu kì, mỗi chu kì là 1 hàng ngang.
- Chu kì 1, 2, 3 được gọi là chu kì nhỏ.
- Chu kì 4, 5, 6, 7 được gọi là chu kì lớn.
- Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
- Nhóm:
- Bảng tuần hoàn gồm 8 nhóm A được đánh số từ IA đến VIIIA và 8 nhóm B được đánh số từ IB đến VIIIB.
- Các nguyên tố trong cùng một nhóm A có số electron ở ngoài cùng bằng nhau (trừ nguyên tố He) → có tính chất gần giống nhau.
- Trong cùng một nhóm, khi đi từ trên xuống dưới, điện tích hạt nhân của nguyên tử các nguyên tố tăng dần.
- Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố nhóm đó.
Vị trí các nhóm nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn:
- Các nguyên tố kim loại:
+ Hầu hết thuộc nhóm IA, nhóm IIA và một số nguyên tố ở các nhóm IVA, VA, VIA.
+ Các nguyên tố thuộc nhóm IB đến VIIIB, các nguyên tố lathannide và các nguyên tố actinide được xếp riêng thành hai hàng ở cuối bảng.
- Các nguyên tố phi kim:
+ Hầu hết thuộc nhóm VIIA, VIA, VA.
+ Một số nguyên tố thuộc nhóm IVA, IIIA.
+ Nguyên tố H ở nhóm IA.
- Các nguyên tố khí hiếm: nằm ở nhóm VIIIA.
CÂU HỎI TRẮC NGHIỆM VÀ TỰ LUẬN 1
- PHẦN TRẮC NGHIỆM
Khoanh tròn chữ cái trước câu trả lời đúng:
Câu 1: Phát biểu nào sau đây không mô tả đúng mô hình nguyên tử của Rơ-dơ-pho- Bo?
- Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở tâm nguyên tử và các electron ở vỏ nguyên tử.
- Nguyên tử có cấu tạo đặc khít, gồm hạt nhân nguyên tử và các electron.
- Electron chuyển động xung quanh hạt nhân theo những quỹ đạo xác định tạo thành các lớp electron.
- Hạt nhân nguyên tử mang điện tích dương, electron mang điện tích âm.
Câu 2: Khối lượng của nguyên tử magnesium là 24 amu. Biết rằng trong hạt nhân, số hạt mang điện bằng số hạt không mang điện. Số hạt proton trong nguyên tử magnesum là
- 12
- 24
- 36
- 8
Câu 3: Trừ hạt nhân của nguyên tử hydrogen, hạt nhân các nguyên tử còn lại được thành từ các hạt:
- eletron và proton.
- eletron và neutron.
- eletron, proton và neutron.
- proton và neutron.
Câu 4: Kí hiệu của 3 hạt neutron, proton, electron lần lượt là:
- n, p, e
- e, p, n
- n, e, p
- p, n , e
Câu 5: Cho các phát biểu:
(1) Nguyên tử trung hoà về điện.
(2) Khối lượng của nguyên tử tập trung chủ yếu ở hạt nhân.
(3) Trong nguyên tứ, số hạt mang điện tích dương bằng số hạt mang điện tích
âm nên số hạt electron bằng số hạt neutron.
(4) Vỏ nguyên tử, gồm các lớp electron có khoảng cách khác nhau đối với
hạt nhân.
Trong các phát biểu trên, số phát biểu đúng là
- 1
- 2
- 3
- 4
Câu 6: Theo mô hình nguyên tử Rơ-dơ-pho - Bo, lớp đầu tiên gần sát hạt nhân chứa tối đa bao nhiêu electron?
- 2
- 3
- 6
- 8
Câu 7: Theo Rơ-dơ-pho (1871-1937), nguyên tử được cấu tạo bởi
- Neutron và electron.
- Proton và electron.
- Proton và electron.
- Electron.
Câu 8: Hạt nhân nguyên tử được cấu tạo bởi
- Neutron và electron.
- Proton và electron.
- Proton và neutron.
- Electron.
Câu 9: Trong nguyên tử, hạt nào mang điện tích dương?
- Electron.
- Proton.
- Neutron.
- Neutron và proton.
Câu 10: Tại sao nói khối lượng của nguyên tử chính là khối lượng của hạt nhân?
- Khối lượng của electron rất nhỏ.
- Khối lượng của electron rất nhỏ so với tổng khối lượng của proton và neutron.
- Khối lượng của electron rất nhỏ so với khối lượng của proton.
- Khối lượng của electron rất lớn.
Câu 11: Tìm phát biểu sai.
- Hạt nhân nguyên tử được tạo bởi proton và neutron.
- Số proton trong nguyên tử bằng số neutron.
- Số proton trong hạt nhân bằng số electron của lớp vỏ nguyên tử.
- Trong nguyên tử, các electron ở vỏ được xếp thành từng lớp và chuyển động xung quanh hạt nhân theo những quỹ đạo như các hành tinh quay quanh Mặt Trời.
Câu 12: Đơn vị của khối lượng nguyên tử là?
- gam
- kilogam
- lít
- amu
Câu 13: Một nguyên tử có 20 proton. Số electron của nguyên tử đó là?
- 20
- 21
- 22
- 23
Câu 14: Cho nguyên tử sodium có 11 proton trong hạt nhân. Câu nào sau đây không đúng?
- Sodium có 11 electron ở lớp vỏ nguyên tử.
- Sodium có điện tích hạt nhân là +11.
- Sodium có số đơn vị điện tích hạt nhân là 11.
- Sodium có 11 neutron trong hạt nhân.
Câu 15: Cho sơ đồ nguyên tử carbon và oxygen như sau:
Khẳng định nào sau đây là sai?
- Nguyên tử carbon có ít electron hơn nguyên tử oxygen.
- Nguyên tử carbon và nguyên tử oxygen đều cần thêm 4 electron để lớp ngoài cùng có số electron tối đa.
- Nguyên tử carbon và nguyên tử oxygen đều có 2 lớp electron.
- Số electron ở lớp ngoài cùng của nguyên tử carbon và oxygen lần lượt là 4e và 6e.
Câu 16: Một nguyên tử carbon có khối lượng là 1,9926 × 10-23 gam. Khối lượng nguyên tử carbon tính theo đơn vị amu là ? (biết 1 amu = 1,6605×10-24 gam)
- 12 amu.
- 24 amu.
- 6 amu.
- 48 amu.
Câu 17: Muối ăn chứa hai nguyên tố hoá học là natri (sodium) và chlorine. Trong hạt nhân nguyên tử của các nguyên tố natri và chlorine có lần lượt 11 và 17 proton. Số electron ở lớp ngoài cùng của vỏ nguyên tử natri và chlorine lần lượt là?
- 1 và 7.
- 3 và 9.
- 9 và 15.
- 3 và 7.
Câu 18: Trong hạt nhân nguyên tử lưu huỳnh (sulfur) có 16 proton. Số electron trong các lớp của vỏ nguyên tử sulfur, viết từ lớp trong ra lớp ngoài, lần lượt là?
- 2, 10, 6.
- 2, 6, 8.
- 2, 8, 6.
- 2, 9, 5.
Câu 19: Nguyên tử X có 2 electron ở lớp thứ nhất, 8 electron ở lớp thứ hai, 3 electron ở lớp thứ ba. Số hạt mang điện trong nguyên tử X là
- 13
- 26
- 39
- 10
Câu 20: Nguyên tử aluminium có 13 proton và 14 neutron. Khối lượng gần đúng của nguyên tử aluminium là
- 13 amu.
- 14 amu.
- 27 amu.
- 40 amu.
- PHẦN TỰ LUẬN
Câu 1: Điền từ còn thiếu vào chỗ ...
- …………………….. là hạt vô cùng nhỏ tạo nên các chất.
- Nguyên tử gồm hạt nhân mang điện tích ………….. và vỏ nguyên tử mang điện tích …………...
- Nguyên tử …………………….. về điện nên tổng số hạt proton ………….. tổng số hạt electron.
Câu 2: Cho sơ đồ một số nguyên tử sau:
+7 +12 |
Nitrogen Magnesium
Hãy chỉ ra: Số p trong hạt nhân, số e trong nguyên tử, số lớp electron và số e lớp ngoài cùng của mỗi nguyên tử.
Câu 3: Vẽ sơ đồ cấu tạo các nguyên tử có số hạt mang điện tích dương trong hạt nhân là 8, 13. Từ những sơ đồ đó có thể cho ta biết những thông tin gì về các nguyên tử đó?
Câu 4: Nguyên tử của một nguyên tố có tổng số các loại hạt là 34, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10. Xác định số p, số n, số e của nguyên tử nguyên tố đó.
Câu 5: Tổng số hạt proton, nơtron, electron của một nguyên tố X là 40, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Xác định số p, số n, số e của X và vẽ sơ đồ cấu tạo nguyên tử của nguyên tố X.

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
=> Giáo án khoa học tự nhiên 7 kết nối tri thức (bản word)
