Giáo án và PPT KHTN 8 cánh diều Bài 7: Tốc độ phản ứng và chất xúc tác
Đồng bộ giáo án word và powerpoint (ppt) Bài 7: Tốc độ phản ứng và chất xúc tác. Thuộc chương trình Khoa học tự nhiên 8 (Hoá học) cánh diều. Giáo án được biên soạn chỉnh chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word










Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 8 cánh diều
BÀI 7: TỐC ĐỘ PHẢN ỨNG VÀ CHẤT XÚC TÁC
HOẠT ĐỘNG KHỞI ĐỘNG
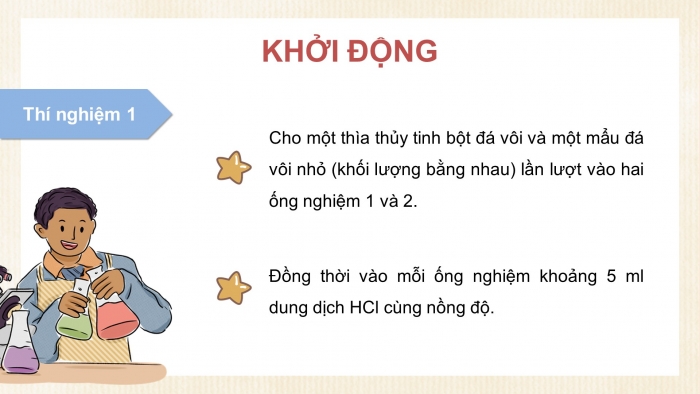
GV yêu cầu HS tiến hành thí nghiệm 1 và trả lời:
Thí nghiệm 1
Cho một thìa thủy tinh bột đá vôi và một mẩu đá vôi nhỏ có khối lượng bằng nhau lần lượt vào hai ống nghiệm 1 và 2, sau đó cho đồng thời vào mỗi ống nghiệm khoảng 5 ml dung dịch HCl cùng nồng độ. Quan sát hiện tượng xảy ra ở hai ống nghiệm và trả lời các câu hỏi sau:
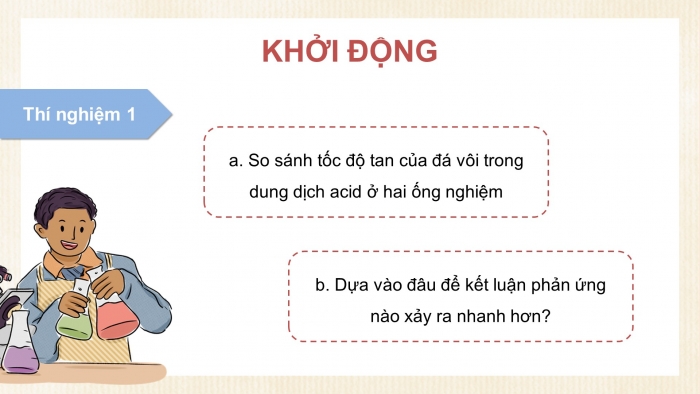
a) So sánh tốc độ tan của đá vôi trong dung dịch acid ở hai ống nghiệm
b) Dựa vào đâu để kết luận phản ứng nào xảy ra nhanh hơn?
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
I. TỐC ĐỘ CỦA PHẢN ỨNG HÓA HỌC LÀ GÌ?
GV cho HS quan sát Hình 7. 1 và trả lời câu hỏi:
- Quan sát Hình 7.1 và cho biết phản ứng nào xảy ra nhanh hơn, phản ứng nào xảy ra chậm hơn? Tốc độ của phản ứng hóa học là gì?

- Trường hợp nào có phản ứng xảy ra với tốc độ nhanh hơn trong hai trường hợp sau:a) Để que đóm còn tàn đỏ ở ngoài không khí. b) Đưa que đóm còn tàn đỏ vào bình chứa oxygen
Sản phẩm dự kiến:
- Phản ứng đốt cháy cồn xảy ra nhanh hơn so với sự gỉ của sắt
![]() Khái niệm: Tốc độ của phản ứng hóa học là đại lượng chỉ mức độ nhanh hay chậm của một phản ứng hóa học
Khái niệm: Tốc độ của phản ứng hóa học là đại lượng chỉ mức độ nhanh hay chậm của một phản ứng hóa học
- Trường hợp b) có phản ứng xảy ra với tốc độ nhanh hơn vì que đóm cháy trong khí oxygen nguyên chất, còn trường hợp a que đóm cháy trong không khí (thành phần oxygen chỉ chiếm xấp xỉ 21%)
II. CÁC YẾU TỔ ẢNH HƯỞNG ĐẾN TỐC ĐỘ CỦA PHẢN ỨNG HÓA HỌC
Hoạt động 1: Ảnh hưởng của diện tích bề mặt tiếp xúc
GV cho HS đọc thí nghiệm 1 và trả lời câu hỏi:
- Cho cùng một lượng Zn hạt và Zn bột vào hai ống nghiệm 1 và 2. Sau đó, cho cùng một thể tích dung dịch HCl dư cùng nồng độ vào hai ống nghiệm. Dự đoán lượng Zn ở ống nghiệm nào sẽ tan hết trước.
- Diện tích bề mặt tiếp xúc có ảnh hưởng đến tốc độ của phản ứng hóa học như thế nào ? Cho ví dụ.
Sản phẩm dự kiến:
- Dự đoán Zn ở ống nghiệm 2 (Zn dạng bột) sẽ tan hết trước do diện tích tiếp xúc với dung dịch HCl của Zn dạng bột lớn hơn của Zn dạng hạt.
- Diện tích bề mặt tiếp xúc có ảnh hưởng đến tốc độ của phản ứng hóa học. Diện tích bề mặt tiếp xúc càng lớn, tốc độ phản ứng càng nhanh.
- Ví dụ:
+ Nấu cháo từ bột gạo sẽ nhanh hơn nấu cháo từ hạt gạo
+ Thanh củi được chẻ nhỏ sẽ cháy nhanh hơn thanh củi to
Hoạt động 2: Ảnh hưởng của nhiệt độ
GV cho HS đọc thí nghiệm 2 và trả lời câu hỏi:
Thí nghiệm 2
Chuẩn bị
- Dụng cụ: ống nghiệm, đèn cồn, kẹp ống nghiệm, ống hút nhỏ giọt
- Hóa chất: dung dịch H2SO4 1M, đinh sắt
Tiến hành
- Cho lần lượt vào mỗi ống nghiệm 1 và 2 một chiếc đinh sắt nhỏ, sau đó rót vào mỗi ống nghiệm khoảng 5 ml dung dịch H2SO4 1M. Đun nóng ống nghiệm 1, ống nghiệm 2 không đun nóng.
- Mô tả hiện tượng xảy ra trong hai ống nghiệm và so sánh tốc độ phản ứng trong hai trường hợp đó. Giải thích?
- Nhận xét ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
- Cho hai cốc thủy tinh đựng nước lạnh và nước nóng, thả đồng thời vào mỗi cốc một viên vitamin C (dạng sủi). Dự đoán xem ở cốc nào viên vitamin C tan nhanh hơn.
Sản phẩm dự kiến:
- Mô tả hiện tượng thí nghiệm 2: Ở ống nghiệm 1, bọt khí thoát ra nhanh và nhiều hơn ống nghiệm 2. Có bọt khí thoát ra là do có phản ứng hóa học sau:
Fe + H2SO4 ![]() FeSO4 + H2
FeSO4 + H2![]()
=>Giải thích: Tốc độ của phản ứng ở ống nghiệm 1 nhanh hơn ở ống nghiệm 2 là do ống nghiệm 1 được đun nóng lên.
- Nhận xét ảnh hưởng của nhiệt độ đến tốc độ phản ứng: Khi tăng nhiệt độ, phản ứng diễn ra với tốc độ nhanh hơn.
- Dự đoán ở cốc nước nóng viên vitamin C tan nhanh hơn.
Hoạt động 3: Ảnh hưởng của nồng độ
GV cho HS tiến hành thí nghiệm 3 và trả lời câu hỏi:
Thí nghiệm 3
Chuẩn bị
- Dụng cụ: ống nghiệm, kẹp ống nghiệm, ống hút nhỏ giọt.
- Hóa chất: dung dịch HCl 5%, dung dịch HCl 10%, Zn viên
Tiến hành
Lần lượt cho vào mỗi ống nghiệm 1 và ống nghiệm 2 ba viên Zn có kích thước tương đương nhau. Sau đó, cho vào ống nghiệm 1 khoảng 5 ml dung dịch HCl 5%, ống nghiệm 2 khoảng 5 ml dung dịch HCl 10%.
- Mô tả hiện tượng xảy ra trong hai ống nghiệm và so sánh lượng bọt khí thoát ra ở hai ống nghiệm. Giải thích.
- Nhận xét ảnh hưởng của nồng độ đến tốc độ phản ứng.
Sản phẩm dự kiến:
- Mô tả hiện tượng thí nghiệm 3: Ở ống nghiệm 2, bọt khí thoát ra nhanh và nhiều hơn ống nghiệm 1. Có bọt khí thoát ra là do có phản ứng hóa học sau:
Zn + HCl ![]() ZnCl2 + H2
ZnCl2 + H2![]()
=> Giải thích: Tốc độ của phản ứng ở ống nghiệm 2 nhanh hơn ở ống nghiệm 1 là do nồng độ dung dịch HCl lớn hơn)
- Nhận xét ảnh hưởng của nồng độ đến phản ứng hóa học: Nồng độ các chất phản ứng càng cao, tốc độ phản ứng càng nhanh.
Hoạt động 4: Chất xúc tác và chất ức chế
GV cho HS tiến hành thí nghiệm 4 và trả lời câu hỏi:
Thí nghiệm 4: Cho vào hai bình tam giác 1 và 2, mỗi bình khoảng 10 ml dung dịch hydrogen peroxide (H2O2). Sau đó, cho vào bình 2 một lượng nhỏ bột manganese dioxide (MnO2) có màu đen, nhận thấy bọt khí oxygen (O2) ở bình 2 thoát ra rất nhanh và mạnh, trong khi ở bình 1 hầu như không thấy khí oxygen thoát ra.
- Trong thí nghiệm 4, cho biết MnO2 làm thay đổi tốc độ phản ứng như thế nào.
- Qua đó em kết luận gì về chất xúc tác và chất ức chế?
Sản phẩm dự kiến:
- Trong thí nghiệm 4, MnO2 làm tăng tốc độ phản ứng
- Kết luận:
- Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị thay đổi cả về lượng và chất sau phản ứng
- Chất ức chế là chất được sử dụng để giảm tốc độ phản ứng nhưng không bị thay đổi cả về lượng và chất sau phản ứng.
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây
A. Thời gian xảy ra phản ứng
B. Bề mặt tiếp xúc giữa các chất phản ứng
C. Nồng độ các chất tham gia phản ứng
D. Chất xúc tác
Câu 2. Điền và hoàn thiện khái niệm về chất xúc tác
“Chất xúc tác là chất làm ..(1).. tốc độ phản ứng nhưng ..(2).. cả về lượng và chất sau phản ứng”
A. (1) tăng, (2) bị tiêu hao
B. (1) giảm, (2) bị tiêu hao
C. (1) tăng, (2) không bị thay đổi
D. (1) giảm, (2) không bị thay đổi
Câu 3. Khi cho cùng một lượng nhôm (Al) vào cốc đựng dung dịch acid HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng nhôm (Al) ở dạng nào sau đây?
A. Dạng viên nhỏ
B. Dạng bột mịn
C. Dạng tấm mỏng
D. Dạng nhôm dây
Sản phẩm dự kiến:
Câu 1: A
Câu 2: C
Câu 3: B
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Trong hai phản ứng sau, phản ứng nào có tốc độ nhanh hơn, phản ứng nào có tốc độ chậm hơn?
a) Đốt cháy dây sắt trong oxygen
b) Sự gỉ của sắt trong không khí
Câu 2: Kể thêm hai phản ứng, một phản ứng có tốc độ nhanh và một phản ứng có tốc độ chậm trong thực tế.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 8 cánh diều
TÀI LIỆU GIẢNG DẠY KHTN 8 (HOÁ HỌC) KẾT NỐI TRI THỨC
Giáo án hóa học 8 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 8 kết nối tri thức
Trò chơi khởi động Hoá học 8 kết nối tri thức
Video AI khởi động Hoá học 8 kết nối tri thức hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 8 kết nối tri thức
Đề thi hóa học 8 kết nối tri thức
File word đáp án hoá học 8 kết nối tri thức
Bài tập file word hoá học 8 kết nối tri thức
Kiến thức trọng tâm hóa học 8 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 8 kết nối tri thức
Đề thi, đề kiểm tra cuối kì 2 hoá học 8 kết nối tri thức
Phiếu học tập theo bài Hoá học 8 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 8 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 8 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY KHTN 8 (HOÁ HỌC) CHÂN TRỜI SÁNG TẠO
Giáo án hóa học 8 chân trời sáng tạo
Giáo án powerpoint hóa học 8 chân trời sáng tạo
Video AI khởi động Hoá học 8 chân trời sáng tạo hấp dẫn
TÀI LIỆU GIẢNG DẠY KHTN 8 (HOÁ HỌC) CÁNH DIỀU
Giáo án hóa học 8 cánh diều đủ cả năm
Giáo án điện tử hoá học 8 cánh diều
Trò chơi khởi động Hoá học 8 cánh diều
Video AI khởi động Hoá học 8 cánh diều hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 8 cánh diều
Đề thi hóa học 8 cánh diều
File word đáp án hoá học 8 cánh diều
Bài tập file word Hoá học 8 cánh diều
Kiến thức trọng tâm hóa học 8 cánh diều
Đề kiểm tra 15 phút Hoá học 8 Cánh diều
Đề thi, đề kiểm tra cuối kì 2 hoá học 8 cánh diều
Phiếu học tập theo bài Hoá học 8 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 8 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 8 cánh diều cả năm
