Giáo án và PPT đồng bộ Hoá học 8 cánh diều
Khoa học tự nhiên 8 (Hoá học) cánh diều. Giáo án word chỉn chu. Giáo án ppt (powerpoint) hấp dẫn, hiện đại. Word và PPT được soạn đồng bộ, thống nhất với nhau. Bộ tài liệu sẽ giúp giáo viên nhẹ nhàng trong giảng dạy. Thầy/cô tham khảo trước để biết chất lượng.
Click vào ảnh dưới đây để xem giáo án rõ

































Một số tài liệu quan tâm khác
Phần trình bày nội dung giáo án
Trường:…………..
Giáo viên:
Bộ môn: Hóa học 8 Cánh diều
PHẦN 1: SOẠN GIÁO ÁN WORD HÓA HỌC 8 CÁNH DIỀU
CHỦ ĐỀ 1: PHẢN ỨNG HÓA HỌC
BÀI 4: MOL VÀ TỈ KHỐI CHẤT KHÍ
I. MỤC TIÊU
1. Kiến thức
Sau bài học này, HS sẽ:
Nêu được khái niệm về mol (nguyên tử, phân tử).
Tính được khối lượng mol (M)
Chuyển đổi được giữa số mol (n) và khối lượng (m).
Nêu được khái niệm tỉ khối, viết được công thức tính tỉ khối của chất khí.
So sánh được khí này nặng hay nhẹ hơn chất khí khác dựa vào công thức tính tỉ khối.
Nêu được khái niệm thể tích mol của chất khí ở áp suất 1 bar và 25 oC.
Sử dụng được công thức n (mol) =
 để chuyển đổi giữa số mol và thể tích chất khí ở điều kiện chuẩn: áp suất 1 bar ở 25 oC.
để chuyển đổi giữa số mol và thể tích chất khí ở điều kiện chuẩn: áp suất 1 bar ở 25 oC.
2. Năng lực
Năng lực chung:
Năng lực tự chủ và tự học: Chủ động, tích cực tìm hiểu được khái niệm về mol, tỉ khối, thể tích mol của chất khí và công thức tính.
Năng lực giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để mô tả các khái niệm, hiện tượng. Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV, tích cực tham gia các hoạt động trong lớp.
Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
Năng lực khoa học tự nhiên:
Nhận thức khoa học tự nhiên: Nêu được khái niệm mol, tỉ khối, thể tích mol của chất khí và cách tính.
Tìm hiểu tự nhiên: Thông qua các hoạt động thảo luận, quan sát các hiện tượng thực tiễn, để tìm hiểu về tỉ khối của chất khí.
Vận dụng kiến thức, kĩ năng đã học: Giải thích được các hiện tượng thực tế, các ứng dụng trong cuộc sống (như bóng bay được bơm khí hydrogen,…).
3. Phẩm chất
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Cẩn thận, trung thực và thực hiện các yêu cầu trong bài học.
- Có niềm say mê, hứng thú với việc khám phá và học tập khoa học tự nhiên.
II. THIẾT BỊ DẠY HỌC
1. Đối với giáo viên
SGK, SGV, SBT KHTN 8 phần Hóa học.
Tranh ảnh, video liên quan đến bài học, phiếu học tập
2. Đối với học sinh
SGK, SBT KHTN 8 phần Hóa học.
Tranh ảnh, tư liệu sưu tầm liên quan đến bài học và dụng cụ học tập (nếu cần) theo yêu cầu của GV.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a. Mục tiêu: Tạo tâm thế hứng thú cho học sinh và từng bước làm quen bài học.
b. Nội dung: GV trình bày vấn đề, HS suy nghĩ và trả lời câu hỏi.
c. Sản phẩm học tập: HS trả lời được câu hỏi theo ý kiến cá nhân.
d. Tổ chức thực hiện:
Bước 1: Chuyển giao nhiệm vụ:
- GV đặt vấn đề:
Nếu yêu cầu đếm số lượng viên gạch để xây bức tường của lâu đài (hình 4.1) và đếm số lượng hạt cát để xây bức tường của lâu đài bằng cát (hình 4.2), yêu cầu nào có thể thực hiện được ? Vì sao ?


Bước 2: Thực hiện nhiệm vụ
- HS lắng nghe câu hỏi, suy nghĩ, thảo luận trả lời câu hỏi phần khởi động.
Bước 3: Báo cáo kết quả hoạt động và thảo luận
- HS đưa ra những nhận định ban đầu.
Bước 4: Kết luận, nhận định
- GV đánh giá câu trả lời của HS, trên cơ sở đó dẫn dắt HS vào bài học: Với những vật thể có kích thước và khối lượng đáng kể như viên gạch, quả táo,… người ta dễ dàng xác định số lượng, khối lượng và thể tích của chúng bằng cách đếm, cân, đo,.. Nhưng với những hạt có kích thước vô cùng nhỏ bé như nguyên tử, phân tử rất khó để có thể cân và đếm được chúng, Vậy làm thế nào để có thể xác định một cách thuận lợi số nguyên tử, phân tử và khối lượng, thể tích của chúng khi tham gia và tạo thành phản ứng hóa học? Sau khi học xong bài học hôm nay chúng ta sẽ giải quyết được vấn đề trên. Chúng ta cùng đi vào bài– Bài 4: Mol và tỉ khối chất khí
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
Hoạt động 1: Tìm hiểu khái niệm mol
a. Mục tiêu: Thông qua hoạt động, HS nêu được khái niệm, ví dụ về mol.
b. Nội dung: GV trình bày vấn đề; HS lắng nghe, đọc SGK, quan sát hình ảnh, thảo luận và trả lời CH1 SGK trang 27.
c. Sản phẩm học tập: HS phát biểu được khái niệm về mol, lấy được ví dụ, câu trả lời cho CH1 SGK trang 27.
d. Tổ chức hoạt động:
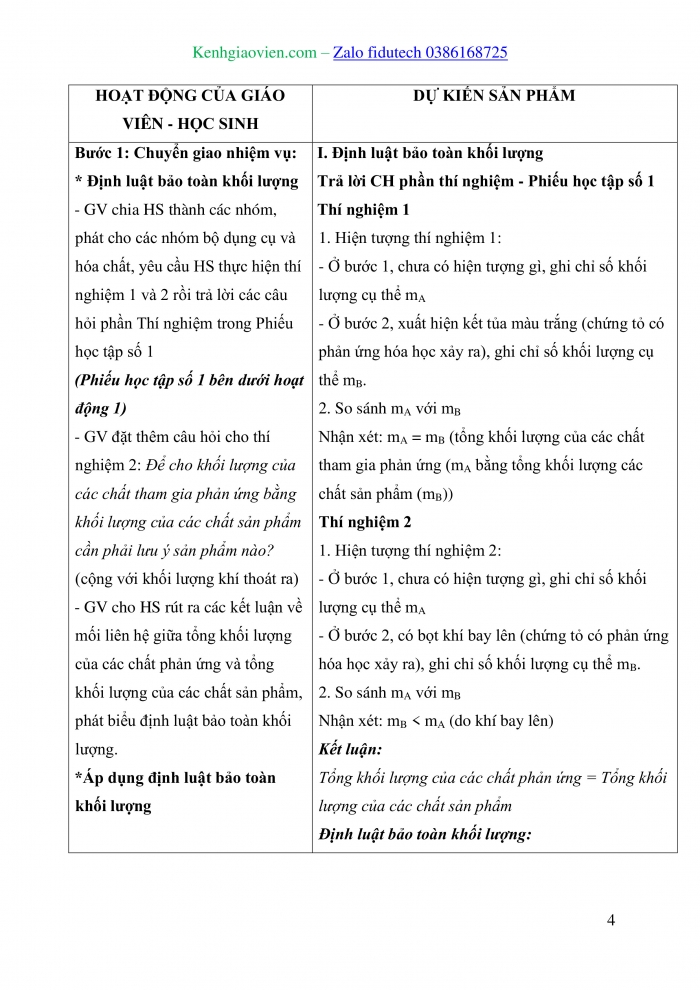
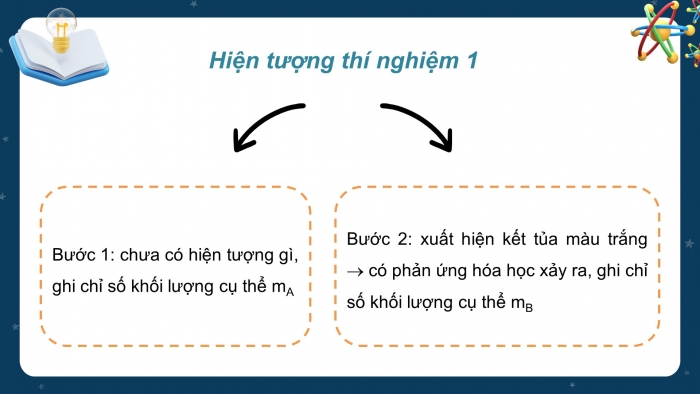
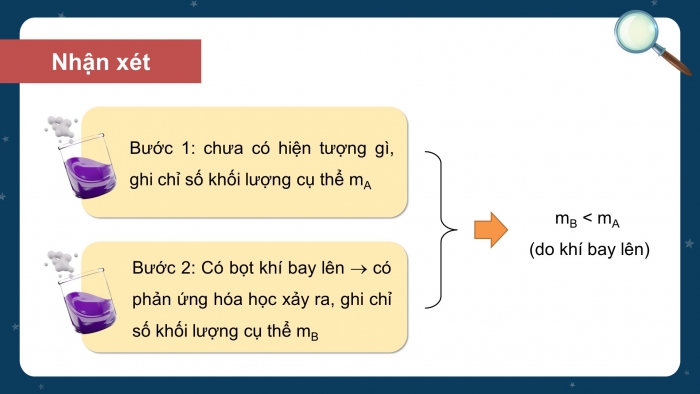
HOẠT ĐỘNG CỦA GIÁO VIÊN - HỌC SINH | DỰ KIẾN SẢN PHẨM |
Bước 1: Chuyển giao nhiệm vụ: - GV yêu cầu HS trả lời câu hỏi : Trong toán học, người ta quy định : + 1 tá trứng bằng bao nhiêu quả trứng? (12 quả trứng) + 1 chục quả trứng bằng bao nhiêu quả trứng? (10 quả trứng) - GV: 12 và 10 là số lượng quy định chục và tá. Định nghĩa mol cũng được dựa trên cơ sở đó. - GV đưa ra định nghĩa về mol: Mol là lượng chất có chứa 6,022 - GV giải thích số 6,022.1023 được gọi là số Avogadro, kí hiệu N. - GV: Giá trị số Avogadro là vô cùng lớn. Nếu một máy đếm các nguyên tử với tốc độ 10 triệu nguyên tử mỗi giây thì sẽ mất khoảng 2 tỉ năm để đếm hết các nguyên tử trong một mol. - GV yêu cầu HS trả lời CH1 SGK trang 27 : 1. Xác định số nguyên tử có trong : a) 2 mol nguyên tử nhôm (aluminium) b) 1,5 mol nguyên tử carbon Bước 2: Thực hiện nhiệm vụ - HS suy nghĩ trả lời câu hỏi của GV, CH1 SGK trang 27. - GV hướng dẫn, theo dõi, hỗ trợ HS nếu cần thiết. Bước 3: Báo cáo kết quả hoạt động và thảo luận - Đại diện HS trả lời câu hỏi của GV, CH1 SGK trang 27. - GV mời HS khác nhận xét, bổ sung. Bước 4: Kết luận, nhận định GV đánh giá, nhận xét, chuẩn kiến thức về định nghĩa mol, chuyển sang nội dung mới. | I. Khái niệm mol - Mol là lượng chất có chứa 6,022 - Số 6,022 Ví dụ : + 1 mol nguyên tử đồng (Cu) là lượng đồng có chứa 6,022 + 1 mol phân tử nước (H2O) là lượng nước có chứa 6,022 Trả lời CH1 SGK trang 27: a) 2 mol nguyên tử nhôm là lượng nhôm có chứa 2 b) 1,5 mol nguyên tử carbon là lượng carbon có chứa 1,5
|
-----------Còn tiếp-----------
PHẦN 2: BÀI GIẢNG POWERPOINT HÓA HỌC 8 CÁNH DIỀU
CHÀO MỪNG TẤT CẢ CÁC EM ĐẾN VỚI TIẾT HỌC HÔM NAY!
KHỞI ĐỘNG
- Trong công nghiệp, người ta sản xuất nhôm từ aluminium oxide (Al2O3).
- Làm thế nào tính được khối lượng nguyên liệu cần dùng để sản xuất nhôm hoặc tính khối lượng nhôm tạo ra nếu biết khối lượng nguyên liệu đã dùng?
BÀI 5: TÍNH THEO PHƯƠNG TRÌNH HOÁ HỌC
NỘI DUNG BÀI HỌC
Xác định khối lượng, số mol của chất phản ứng và sản phẩm trong phản ứng hóa học
Hiệu suất phản ứng
- Xác định khối lượng, số mol của chất phản ứng và sản phẩm trong phản ứng hóa học
Đọc ví dụ (SGK tr.32, 33), tìm hiểu các bước tính theo phương trình hoá học
- Các bước tính theo phương trình hoá học
Bước 1: Viết phương trình hóa học của phản ứng
Bước 2: Tính số mol chất đã biết dựa vào khối lượng hoặc thể tích
Bước 3: Dựa vào PTHH và số mol chất đã biết để tìm số mol của các chất phản ứng hoặc chất sản phẩm khác
Bước 4: Tính khối lượng hoặc thể tích của chất cần tìm
Luyện tập (SGK tr.33): Đốt cháy hết 0,54 gam Al trong không khí thu được aluminium oxide theo sơ đồ phản ứng:
Al + O2 Al2O3
Lập phương trình hóa học của phản ứng và tính:
- a) Khối lượng aluminium oxide tạo ra.
- b) Thể tích khí oxygen tham gia phản ứng ở điều kiện chuẩn.
Trả lời:
- (mol)
- 4Al + 3O2 2Al2O3
0,02 0,015 0,01
- a) (gam)
- b) (lit)
- Hiệu suất phản ứng
- Chất phản ứng hết, chất phản ứng dư
Quan sát Hình 5.1 (SGK tr.34) và trả lời câu hỏi:
Cho biết số phân tử O2, H2 trước phản ứng, tham gia phản ứng và còn lại sau phản ứng
Cho biết số phân tử H2O tạo thành sau phản ứng
Khi phản ứng kết thúc, chất phản ứng nào hết và chất nào còn dư?
| H2 | + | O2 | 2H2O | ||
| Số phân tử | 2 phân tử H2 | + | 1 phân tử O2 | 2 phân tử H2O | |
| Số mol | 2 mol H2 | + | 1 mol O2 | 2 mol H2O |
> Sau phản ứng, O2 là chất phản ứng hết, H2 là chất phản ứng dư.
Câu hỏi 1 (SGK tr.33): Đốt nóng bình chứa hỗn hợp gồm 1 mol khí hydrogen và 0,4 mol khí oxygen đến khi phản ứng xảy ra hoàn toàn. Cho biết chất nào còn dư sau phản ứng.
Lời giải
| 2H2 | + | O2 | 2H2O | ||
| Theo PTHH | 2 mol H2 | + | 1 mol O2 | 2 mol H2O | |
| Ban đầu | 1 mol H2 | + | 0,4 mol O2 | ||
| Phản ứng | 0,8 mol | 0,4 mol | 0,8 mol H2O | ||
| Sau phản ứng | 0,2 mol | 0 mol |
KẾT LUẬN
- Chất phản ứng hết là chất không còn sau khi phản ứng kết thúc.
- Chất phản ứng dư là chất còn lại sau khi kết thúc phản ứng.
- Hiệu suất phản ứng
Khi đốt cháy than (thành phần chính là carbon) trong oxygen hoặc trong không khí sinh ra carbon dioxide:
Theo PTHH, nếu đốt 1 mol carbon trong 1 mol oxygen thì thu được bao nhiêu gam CO2?
44 gam
Khái niệm: Hiệu suất phản ứng (kí hiệu là H) là tỉ số giữa lượng sản phẩm thu được theo thực tế và lượng sản phẩm thu được theo lí thuyết.
Trả lời câu hỏi
Câu hỏi 2 SGK trang 34:
- a) Hiệu suất phản ứng được tính bằng cách nào?
- b) Khi nào hiệu suất của phản ứng bằng 100% ?
a)
Trong đó:
- H là hiệu suất phản ứng (%)
- mtt là khối lượng chất (gam) thu được theo thực tế
- mlt là khối lượng chất (gam) thu được theo lí thuyết (tính theo phương trình hóa học)
- b) Hiệu suất của phản ứng là 100% tức là phản ứng hóa học xảy ra hoàn toàn.
LUYỆN TẬP
Câu 1. Khi tính toán theo phương trình hóa học, cần thực hiện mấy bước cơ bản?
-----------Còn tiếp-----------
PHẦN 3: TÀI LIỆU THAM KHẢO ĐƯỢC TẶNG KÈM
1. TRỌN BỘ TRẮC NGHIỆM HÓA HỌC 8 CÁNH DIỀU
Bộ trắc nghiệm Hóa học 8 Cánh diều tổng hợp câu hỏi trắc nghiệm: nhận biết, thông hiểu, vận dụng, vận dụng cao và trắc nghiệm Đ/S
BÀI 12. MUỐI
A. TRẮC NGHIỆM
1. NHẬN BIẾT (15 CÂU)
Câu 1: Khái niệm đúng về muối là
- Muối là hợp chất được tạo thành từ sự thay thế ion OH- của base bằng ion kim loại hoặc ammonium.
- Muối là hợp chất được tạo thành từ sự thay thế ion H+ của acid bằng ion kim loại hoặc ammonium.
- Muối là hợp chất được tạo thành từ sự thay thế ion OH- của base bằng ion phi kim
- Muối là hợp chất được tạo thành từ sự thay thế ion H+ của acid bằng ion ammonium.
Câu 2: Công thức phân tử của muối gồm
- Cation kim loại và anion gốc acid
- Cation kim loại và anion phi kim
- Anion phi kim và anion gốc acid
- Cation kim loại và cation phi kim
Câu 3: Đâu là cách gọi tên của muối?
- Tên kim loại + tên gốc acid.
- Tên gốc acid + tên kim loại.
- Tên kim loại (hóa trị đối với kim loại nhiều hóa trị) + tên gốc acid.
- Tên phi kim (hóa trị đối với phi kim nhiều hóa trị) + tên gốc acid.
Câu 4: Gốc acid =S có tên gọi là
- Sulfate
- Hydrogensunfide
- Sulfide
- Sulfite
Câu 5: Nhận định nào sau đây chưa chính xác
- Các muối của kim loại K, Na đều tan tan trong nước.
- Các muối của gốc acid -Cl đều tan trong nước trừ AgCl.
- Các muối của gốc acid -NO3 đều tan trong nước.
- Các muối của gốc acid =CO3 đều không tan trong nước.
Câu 6: Sản phẩm của dung dịch muối phản ứng với kim loại là
- Acid và base
- Muối mới và acid
- Muối mới và kim loại mới
- Muối mới và base.
Câu 7: Sản phẩm của muối phản ứng với dung dịch acid là
- Muối mới và acid mới.
- Muối mới và base mới.
- Muối mới và kim loại mới.
- Acid mới và base mới.
Câu 8: Sản phẩm của muối phản ứng với base là
- Muối mới và acid mới
- Muối mới và base mới
- Muối mới và kim loại mới
- Hai muối mới
Câu 9: Sản phẩm của dung dịch muối tác dung với dung dịch muối là
- Muối mới và acid mới.
- Muối mới và base mới.
- Muối mới và kim loại mới.
- Hai muối mới.
Câu 10: Điều kiện để 2 dung dịch muối có thể phản ứng với nhau là
- Có ít nhất 1 muối mới không tan hoặc ít tan.
- Có ít nhất một muối mới là chất khí
- Cả hai muối mới bắt buộc không tan hoặc ít tan.
- Các muối mới đều là muối tan.
Câu 11: Muối ăn được sản xuất từ
- Dùng NaOH phản ứng với HCl.
- Mỏ muối hoặc nước biển
- Điện phân nước biển
- Dùng Na2SO4 tác dụng với BaCl2
Câu 12: Đâu không phải tính chất hóa học của muối
- phản ứng với kim loại
- phản ứng với phi kim
- phản ứng với base
- phản ứng với acid
Câu 13: Tên của muối Na2SO4 là
- sodium sulfate
- sodium sulfua
- disodium tetrasufur
- sodium(I) sulfate
------Còn tiếp-----------
2. TRỌN BỘ ĐỀ THI HÓA HỌC 8 CÁNH DIỀU
Bộ đề Hóa học 8 Cánh diều biên soạn đầy đủ gồm: đề thi + hướng dẫn chấm điểm, bảng năng lực và cấp độ tư duy, bảng đặc tả kĩ thuật
PHÒNG GD & ĐT ………………. | Chữ kí GT1: ........................... |
TRƯỜNG THCS………………. | Chữ kí GT2: ........................... |
ĐỀ KIỂM TRA GIỮA HỌC KÌ 1
KHOA HỌC TỰ NHIÊN 8 – CÁNH DIỀU
NĂM HỌC: 2023 - 2024
Thời gian làm bài: 60 phút (Không kể thời gian phát đề)
Họ và tên: …………………………………… Lớp: ……………….. Số báo danh: …………………………….……Phòng KT:………….. | Mã phách |
✂
Điểm bằng số
| Điểm bằng chữ | Chữ ký của GK1 | Chữ ký của GK2 | Mã phách |
A. PHẦN TRẮC NGHIỆM (4 điểm)
Khoanh tròn vào chữ cái đứng trước câu trả lời đúng:
Câu 1: (NB) Chất ban đầu bị biến đổi trong quá trình phản ứng được gọi là
chất sản phẩm.
chất xúc tác.
chất phản ứng hay chất tham gia.
chất kết tủa hoặc chất khí.
Câu 2: (NB) Phản ứng tỏa nhiệt là phản ứng
khi xảy ra kèm theo sự truyền nhiệt từ môi trường vào chất phản ứng.
khi xảy ra kèm theo sự giải phóng nhiệt chất phản ứng ra môi trường.
khi xảy ra kèm theo sự trao đổi nhiệt giữa các chất phản ứng với các chất trong môi trường.
khi xảy ra kèm theo sự trao đổi nhiệt giữa các chất phản ứng.
Câu 3 (NB): Chọn phát biểu đúng trong các phát biểu sau.
- Mol là lượng chất có chứa NA nguyên tử hoặc phân tử chất đó.
- Mol là khối lượng của chất có chứa NA nguyên tử hoặc phân tử chất đó.
- Mol là thể tích của chất có chứa NA nguyên tử hoặc phân tử chất đó.
- Mol là nồng độ của chất có chứa NA nguyên tử hoặc phân tử chất đó.
Câu 4 (NB): Điều kiện chuẩn có nhiệt độ và áp suất giá trị là
- 0oC và 1 atm.
- 25oC và 1 atm.
- 25oC và 1 bar.
- 0oC và 1 bar.
Câu 5 (NB): Dung dịch base làm quỳ tím chuyển màu
- đỏ.
- trắng.
- vàng.
- Xanh.
Câu 6 (NB): pH< 7, môi trường có tính gì?
- Acid
- Base.
- Trung tính.
- Không xác định được.
Câu 7 (NB): Điều kiện để 2 dung dịch muối có thể phản ứng với nhau là
- có ít nhất 1 muối mới không tan hoặc ít tan.
- có ít nhất một muối mới là chất khí.
- cả hai muối mới bắt buộc không tan hoặc ít tan.
- các muối mới đều là muối tan.
Câu 8 (NB): Độ dinh dưỡng của phân lân là
A. % K2O.
B. % P2O5.
C. % P.
D. %PO43-.
Câu 9 (TH): Trường hợp nào sau đây không xảy ra phản ứng hóa học?
A. Đốt cao su có mùi hắc rất khó chịu.
B. Trên bề mặt các hồ tôi vôi để lâu ngày sẽ có lớp màng mỏng màu trắng.
C. Quả bóng bay trên cao rồi nổ tung.
D. Khi chiên trứng gà nếu đun quá lửa sẽ có mùi khét.
Câu 10 (TH): Thể tích của 0,5 mol khí CO2 ở điều kiện chuẩn là
- 11,55 (lít).
- 11,2 (lít).
D. 10,95 (lít)
- 12,395 (lít).
Câu 11 (TH): Đốt cháy 1,2 gam carbon cần a gam oxygen, thu được 4,4 gam khí carbondioxide. Tính a.
- 3,8.
- 2,2.
- 3,2.
- 4,2.
Câu 12 (TH): Đâu không phải là biện pháp bón phân để giảm thiểu ô nhiễm của phân bón hóa học?
- Bón đúng loại.
- Bón đúng lúc.
- Bón đúng liều lượng.
- Bón vào trời mưa.
Câu 13 (VD): Khi đốt nến (làm bằng parafin), nến trải qua các giai đoạn sau

- Nến chảy lỏng thấm vào bấc.
- Nến lỏng hóa hơi.
- Hơi nến cháy trong không khí tạo thành carbon dioxide và hơi nước.
Giai đoạn nào của quá trình đốt nến xảy ra biến đổi vật lý, giai đoạn nào biến đổi hóa học?
- (1) biến đổi vật lý; (2) và (3) biến đổi hóa học.
- (1), (2) biến đổi vật lý; (3) biến đổi hóa học.
- (1), (3) biến đổi vật lý; (2) biến đổi hóa học.
- (2), (3) biến đổi vật lý; (1) biến đổi hóa học.
------Còn tiếp-----------

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
=> Giáo án hóa học 8 cánh diều
Từ khóa: Giáo án và PPT đồng bộ hoá học 8 cánh diều, soạn giáo án word và powerpoint Khoa học tự nhiên 8 cánh diều, soạn hoá học 8 cánh diềuTài liệu giảng dạy môn Hóa học THCS
