Trắc nghiệm hoá học 7 cánh diều Bài 5: giới thiệu về liên kết hóa học
Bộ câu hỏi trắc nghiệm hoá học 7 cánh diều . Câu hỏi và bài tập trắc nghiệm Bài 5: giới thiệu về liên kết hóa học. Bộ trắc nghiệm có 4 mức độ: Thông hiểu, nhận biết, vận dụng và vận dụng cao. Hi vọng, tài liệu này sẽ giúp thầy cô nhẹ nhàng hơn trong việc ôn tập. Theo thời gian, chúng tôi sẽ tiếp bổ sung thêm các câu hỏi.
Xem: => Giáo án hóa học 7 cánh diều (bản word)
Các tài liệu bổ trợ
CHỦ ĐỀ 3: GIỚI THIỆU VỀ LIÊN KẾT HÓA HỌCBÀI 5: GIỚI THIỆU VỀ LIÊN KẾT HÓA HỌC
A. TRẮC NGHIỆM
1. NHẬN BIẾT (15 câu)
Câu 1: Điền từ còn thiếu vào chỗ trống
“Lớp vỏ (1)…….. của các nguyên tử khí hiếm có 8 electron (riêng (2)…….. có 2 electron) là lớp vỏ (3)……….”
A. (1) trong cùng; (2) helium; (3) bền vững.
B. (1) ngoài cùng; (2) helium; (3) trơ.
C. (1) ngoài cùng; (2) helium; (3) bền vững.
D. (1) ngoài cùng; (2) lithium; (3) bền vững.
Câu 2: Nguyên tử của các nguyên tố khác có thể đạt được lớp electron ngoài cùng của khí hiếm bằng cách
A. Tạo thành các chất khí.
B. Tạo thành hỗn hợp.
C. Tạo thành liên kết hóa học.
D. Tạo thành mạng tinh thể.
Câu 3: Lớp electron ngoài cùng của nguyên tử khí hiếm chứa
A. 8 electron (trừ He chứa 2 electron).
B. 10 electron (trừ He chứa 2 electron).
C. 8 electron (trừ Ne chứa 2 electron).
D. 10 electron (trừ Ne chứa 2 electron).
Câu 4: Điền từ còn thiếu vào chỗ trống
“Nguyên tử của các nguyên tố khác có xu hướng tham gia các (1)…….. để đạt được lớp electron ngoài cùng giống (2)…… bằng cách (3)………. các electron”
A. (1) liên kết hóa học; (2) khí hiếm; (3) liên kết chặt chẽ.
B. (1) mạng tinh thể; (2) khí hiếm; (3) liên kết chặt chẽ.
C. (1) mạng tinh thể; (2) khí hiếm; (3) nhường, nhận hay dùng chung.
D. (1) liên kết hóa học; (2) khí hiếm; (3) nhường, nhận hay dùng chung.
Câu 5: Liên kết ion là liên kết được hình thành bởi
A. Lực hút giữa các ion mang điện tích trái dấu.
B. Lực hút giữa các ion mang điện tích cùng dấu.
C. Lực đẩy giữa các ion mang điện tích trái dấu.
D. Lực đẩy giữa các ion mang điện tích cùng dấu.
Câu 6: Điền vào chỗ trống
“Các hợp chất ion như muối ăn,… là (1)…….. ở điều kiện thường, khó bay hơi, khó nóng chảy và khi tan trong nước tạo thành dung dịch (2)……..”
A. (1) chất rắn; (2) không màu.
B. (1) chất rắn; (2) dẫn được điện.
C. (1) chất lỏng; (2) dẫn được điện.
D. (1) chất lỏng; (2) không màu.
Câu 7: Chọn đáp án đúng. Sự hình thành liên kết ion trong phân tử muối ăn
A. Nguyên tử natri (Na) nhường một electron ở lớp ngoài cùng cho nguyên tử chlorine (Cl) để tạo thành ion dương $Na^{+}$ có vỏ bền vững giống vỏ nguyên tử khí hiếm Ar.
B. Nguyên tử Cl nhận vào lớp electron ngoài cùng một electron của nguyên tử Na để tạo thành ion âm $〖Cl〗^{-}$ có vỏ bền vững giống vỏ nguyên tử khí hiếm Ne.
C. Hai ion được tạo thành mang điện tích ngược dấu.
D. Hai ion được tạo thành hút nhau để hình thành mạng tinh thể trong tinh thể muối ăn.
Câu 8: Khi kim loại tác dụng với phi kim, nguyên tử kim loại nhường electron để trở thành
A. Ion âm.
B. Ion dương.
C. Khí hiếm.
D. Chất trơ.
Câu 9: Khi kim loại tác dụng với phi kim, nguyên tử phi kim nhận electron để trở thành
A. Ion dương.
B. Chất tinh khiết.
C. Khí hiếm.
D. Ion âm.
Câu 10: Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng
A. Lực hút tĩnh điện.
B. Một hay nhiều đôi electron dùng chung giữa hai nguyên tử.
C. Một cặp electron dùng chung.
D. Lực hút giữa các proton.
Câu 11: Chất cộng hóa trị là
A. Các chất chứa ít nhất một liên kết cộng hóa trị.
B. Các chất được tạo thành nhờ liên kết cộng hóa trị
C. Các chất có cấu trúc mạng tinh thể.
D. Các chất hydrogen, carbon dioxide, oxygen,...
Câu 12: Điền vào chỗ trống
“Các (1)……… có thể là chất khí, chất lỏng hay (2)……… Các chất cộng hóa trị thường có nhiệt độ nóng chảy và nhiệt độ sôi (3)………..”
A. (1) chất cộng hóa trị; (2) chất rắn; (3) cao.
B. (1) chất cộng hóa trị; (2) chất rắn; (3) thấp.
C. (1) hợp chất ion; (2) chất rắn; (3) thấp.
D. (1) hợp chất ion; (2) chất rắn; (3) cao.
Câu 13: Chọn đáp án sai. Sự hình thành phân tử hydrogen
A. Mỗi nguyên tử H có 2 electron ở lớp ngoài cùng.
B. Hai nguyên tử H đã liên kết với nhau bằng cách mỗi nguyên tử H góp chung 1 electron tạo thành một cặp electron dùng chung.
C. Hai nguyên tử H liên kết với nhau để có cấu trúc bền vững của khí hiếm He.
D. Hydrogen là chất khí.
Câu 14: Chọn đáp án đúng
A. Nitrogen là một khí hiếm, tương đối trơ ở điều kiện thường.
B. Hai nguyên tử N có ba đôi electron dùng chung nên liên kết trong phân tử nitrogen khá bền vững.
C. Nitrogen dễ gây cháy nổ và đọc hại.
D. Nitrogen thường được dùng dể bơm vào khinh khí cầu.
Câu 15: Chọn đáp án sai. Sự hình thành phân tử nước
A. Trong phân tử nước có ba cặp electron dùng chung.
B. Phân tử nước được hình thành bởi hai nguyên tử O, một nguyên tử H.
C. Hai nguyên tử H đã liên kết với một nguyên tử O bằng cách nguyên tử O góp chung với mỗi nguyên tử H một electron tạo thành cặp electron dùng chung.
D. Nước tồn tại được ở cả ba thể: rắn, lỏng, khí.
2. THÔNG HIỂU (15 câu)
Câu 1: Nguyên tử thuộc nguyên tố Na có 1 electron ở lớp ngoài cùng. Để đạt được lớp electron ngoài cùng giống khí hiếm, nguyên tử thuộc nguyên tố Na phải nhường đi bao nhiêu electron
A. 4.
B. 1.
C. 3.
D. 7.
Câu 2: Tại sao Helium được sử dụng để bơm vào khí cầu thay thế cho hydrogen
A. Helium nhẹ hơn không khí.
B. Helium là khí trơ, rất khó cháy hay nổ.
C. Hydrogen là chất khí dễ cháy nổ.
D. Tất cả các đáp án trên.
Câu 3: Nguyên tử thuộc nguyên tố H có 1 electron ở lớp ngoài cùng. Để đạt được lớp electron ngoài cùng giống khí hiếm, nguyên tử thuộc nguyên tố H phải nhận bao nhiêu electron
A. 7.
B. 3.
C. 1.
D. 9.
Câu 4: Nguyên tử thuộc nguyên tố Cl có 7 electron ở lớp ngoài cùng. Để đạt được lớp electron ngoài cùng giống khí hiếm, nguyên tử thuộc nguyên tố Cl phải nhận bao nhiêu electron
A. 3.
B. 1.
C. 2.
D. 4.
Câu 5: Chọn đáp án sai
A. Ion là phần tử mang điện.
B. Ion được hình thành khi nguyên tử nhường hay nhận electron.
C. Trừ khí hiếm, nguyên tử các nguyên tố khác thường có xu hướng kết hợp với nhau bằng các liên kết hóa học.
D. Lớp electron ngoài cùng của các nguyên tử khí hiếm đều chứa 8 electron.
Câu 6: Kim loại Mg khi phản ứng với phi kim tạo thành ion Mg^(2+). Số electron lớp ngoài cùng của nguyên tử Mg
A. 1.
B. 2.
C. 6.
D. 8.
Câu 7: Phi kim O khi phản ứng với kim loại tạo thành ion O^(2-). Số electron lớp ngoài cùng của nguyên tử O
A. 2.
B. 6.
C. 8.
D. 4.
Câu 8: Trong các ion Ca^(2+), K^+, S^(2-), Al^(3+), Cl^-, Mg^(2+). Số ion dương là
A. 4.
B. 3.
C. 2.
D. 1.
Câu 9: Trong phân tử KCl, nguyên tử K và nguyên tử Cl liên kết với nhau bằng liên kết
A. Ion.
B. Cộng hóa trị.
C. Kim loại.
D. Phi kim.
Câu 10: Vì sao ammonia (NH3) là chất khí ở nhiệt độ phòng
A. Ammonia là chất cộng hóa trị, có nhiệt độ sôi thấp.
B. Ammonia có khối lượng nhẹ hơn không khí.
C. Ammonia được tạo thành từ nguyên tử hydrogen có khối lượng nhẹ.
D. Ammonia được tạo thành từ nguyên tử nitrogen.
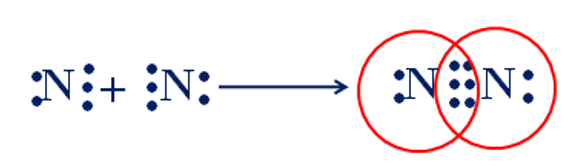
Câu 11: Cho sơ đồ mô tả sự hình thành liên kết cộng hóa trị trong phân tử nitrogen. Số cặp electron dùng chung của hai nguyên tử nitrogen là
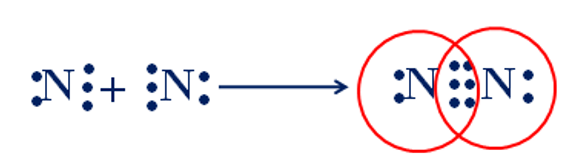
A. 4.
B. 3.
C. 5.
D. 6.
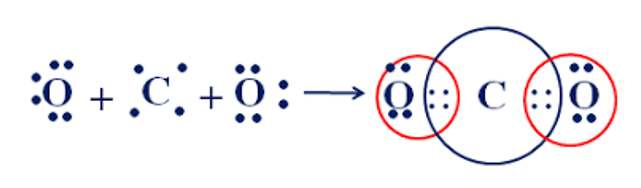
Câu 12: Cho sơ đồ mô tả sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide. Số cặp electron dùng chung trong phân tử carbon dioxide là
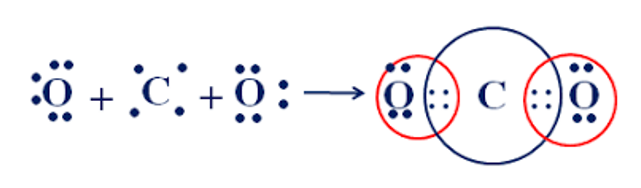
A. 2.
B. 3.
C. 4.
D. 5.
Câu 13: Vì sao trong tự nhiên muối ăn ở dạng rắn, khó nóng chảy, khó bay hơi
A. Do muối ăn rất mặn.
B. Do muối ăn là hợp chất cộng hóa trị.
C. Do muối ăn là hợp chất ion.
D. Do muối ăn ở dạng tinh thể.
Câu 14: Vì sao trọng tự nhiên nước đá ở thể rắn dễ nóng chảy, nước ở thể lỏng dễ bay hơi
A. Do nước là hợp chất ion.
B. Do nước trong tự nhiên là chất tinh khiết.
C. Do nước trong tự nhiên là hỗn hợp.
D. Do nước là hợp chất cộng hóa trị.
Câu 15: Trong các ion $Ca^{2+}$, $Br^{-}$, $S^{2-}$, $Al^{3+}$, $Cl^{-}$, $Zn^{2+}$. Số ion âm là
A. 2.
B. 5.
C. 4.
D. 3.
3. VẬN DỤNG (10 câu)
Câu 1: Phân tử methane gồm một nguyên tử carbon liên kết với bốn nguyên tử hydrogen. Khi hình thành liên kết cộng hóa trị trong methane, nguyên tử carbon góp chung bao nhiêu electron với mỗi nguyên tử hydrogen
A. 1.
B. 2.
C. 3.
D. 4.
Câu 2: Phân tử ammonia (NH3) gồm một nguyên tử nitrogen liên kết với ba nguyên tử hydrogen. Có bao nhiêu cặp electron dùng chung trong phân tử ammonia
A. 1.
B. 2.
C. 3.
D. 4.
Câu 3: Dãy gồm các chất cộng hóa trị
A. NaCl, KBr, N2, HCl.
B. HCl, CaO, K2O, H2.
C. LiF, CO, CuO, O2.
D. NH3, C2H6, O2, Br2.
Câu 4: Số electron trong ion $S^{2-}$ là
A. 14.
B. 18.
C. 16.
D. 20.
Câu 5: Số electron trong ion $Mg^{2+}$là
A. 12.
B. 8.
C. 10.
D. 14.
Câu 6: Nguyên tử Nhôm (aluminium) có số đơn vị điện tích hạt nhân bằng 13. Nguyên tử Nhôm có thể tạo thành ion
A. $Al^{5-}$.
B. $Al^{5+}$.
C. $Al^{3-}$.
D. $Al^{3+}$.
Câu 7: Nguyên tử Lưu huỳnh (sulfur) có số đơn vị điện tích hạt nhân bằng 16. Nguyên tử Lưu huỳnh có thể tạo thành ion
A. $S^{6-}$.
B. $S^{6+}$.
C. $S^{2+}$.
D. $S^{2-}$.
Câu 8: Phân tử carbon dioxide gồm một nguyên tử carbon liên kết với hai nguyên tử oxygen. Khi hình thành liên kết cộng hóa trị trong carbon dioxide, nguyên tử carbon góp chung bao nhiêu electron với mỗi nguyên tử oxygen
A. 1.
B. 2.
C. 3.
D. 4.
Câu 9: Nguyên tử X có 4 lớp electron và 2 electron lớp ngoài cùng, nguyên tử Y có 3 lớp electron và 7 electron lớp ngoài cùng. Liên kết giữa X và Y là
A. Liên kết cộng hóa trị.
B. Liên kết ion.
C. Liên kết cho nhận.
D. Không xác định được.
Câu 10: Nguyên tử X có 3 lớp electron và thuộc nhóm VA, nguyên tử Y có Z < 10 và thuộc nhóm VIA. Liên kết giữa X và Y là
A. Liên kết cho nhận.
B. Không xác định được.
C. Liên kết ion.
D. Liên kết cộng hóa trị.
3. VẬN DỤNG CAO (5 câu)
Câu 1: Cho hợp chất HNO3. Chọn đáp án sai
A. Trong hợp chất HNO3 có liên kết ion.
B. Hợp chất HNO3 tạo thành từ 3 nguyên tử.
C. Trong hợp chất HNO3 có liên kết cộng hóa trị.
D. Hợp chất HNO3 tạo thành từ 3 nguyên tố.
Câu 2: Trong phân tử H2SO4 có mấy cặp electron dùng chung
A. 6.
B. 2.
C. 8.
D. 4.
Câu 3: Trong ion $X^{2-}$ có tổng số hạt bằng 26, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Xác định X
A. S.
B. O.
C. C.
D. N.
Câu 4: Trong ion $X^{3+}$ có tổng số hạt bằng 79, biết trong nguyên tử X số hạt mang điện nhiều hơn số hạt không mang điện là 19. Xác định X
A. Al.
B. Fe.
C. Mn.
D. Ca.
Câu 5: Trong nguyên tử X có tổng số hạt proton, neutron, electron là 24. Biết X có thể tạo thành ion $X^{2-}$. Xác định X
A. S.
B. O.
C. C.
D. Mg.