Trắc nghiệm câu trả lời ngắn Hoá học 10 cánh diều Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hoá học
Tài liệu trắc nghiệm dạng câu trả lời ngắn Hoá học 10 cánh diều Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hoá học. Dựa trên kiến thức của bài học, bộ tài liệu được biên soạn chi tiết, đúng trọng tâm và rõ ràng. Câu hỏi đa dạng với các mức độ khó dễ khác nhau. Tài liệu có file Word tải về. Thời gian tới, nội dung này sẽ tiếp tục được bổ sung.
Xem: => Giáo án hóa học 10 cánh diều (bản word)
BÀI 15. Ý NGHĨA VÀ CÁCH TÍNH BIẾN THIÊN ENTHALPY PHẢN ỨNG HÓA HỌC
Câu 1: Cho các phát biểu:
(a) Tất cả các phản ứng cháy đều tỏa nhiệt.
(b) Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(c) Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều tỏa nhiệt.
(d) Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
(e) Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng.
(g) Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,…) là những ví dụ về phản ứng thu nhiệt vì cần khơi mào.
Số phát biểu đúng là
3
Câu 2: Cho các phát biểu:
(a) Biến thiên enthalpy chuẩn của một phản ứng hóa học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và
(b) Nhiệt (tỏa ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó.
(c) Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
(d) Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường.
Số phát biểu đúng là
2
Câu 3: Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện..) và giúp ngăn cản sự phát triển của một số vi khuẩn và nấm gây hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25°C, phản ứng giữa mol sulfur với oxygen xảy ra theo phương trình
“S (s) + O2(g) → SO2(g)” và tỏa ra một lượng nhiệt là 196,9kJ. Cho các phát biểu sau:
(1) Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ mol -1
(2) Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ.
(3) Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
(4) 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
(5) 32 gam sulfur cháy hoàn toàn tỏa ra một lượng nhiệt là 2,969x105J.
Các phát biểu đúng là (Ghi thứ tự các phát biểu đúng từ nhỏ đến lớn, VD: 123, 234, 125…)
2345
Câu 4: Ethanol sôi ở 78,29oC. Để làm 1 gam ethanol lỏng nóng thêm 1oC cần một nhiệt lượng là 1,44J; để 1 gam ethanol hóa hơi (ở 78,29oC) cần một nhiệt lượng là 855 J. Hãy tính nhiệt lượng (theo kJ) cần cung cấp để làm nóng 1kg ethanol từ 20,0 oC đến nhiệt độ sôi và hóa hơi hoàn toàn ở nhiệt độ đó. (Làm tròn đến số nguyên).
939
Câu 5: Phosgene là chất khí không màu, mùi cỏ mục, dễ hoá lỏng; khối lượng riêng 1,420 g/cm3 (ở 0 °C); ts = 8,2 °C. Phosgene ít tan trong nước; dễ tan trong các dung môi hữu cơ, bị thuỷ phân chậm bằng hơi nước; không cháy; là sản phẩm công nghiệp quan trọng; dùng trong tổng hợp hữu cơ để sản xuất sản phẩm nhuộm, chất diệt cỏ, polyurethane,... Phosgene là một chất độc. Ở nồng độ 0,005 mg/L đã nguy hiểm đối với người; trong khoảng 0,1 -0,3 mg/L, gây tử vong sau khoảng 15 phút.
Phosgene được điều chế bằng cách cho hỗn hợp CO và Cl2 đi qua than hoạt tính. Biết: Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl)= 339 kJ/mol; Eb(C=O) = 745 kJ/mol; Eb(C≡O) = 1075 kJ/mol. Hãy tính biến thiên enthalpy của phản ứng tạo thành phosgene từ CO và Cl2.
-105
Câu 6: Hydrazine (N2H4) bị phân hủy như sau:
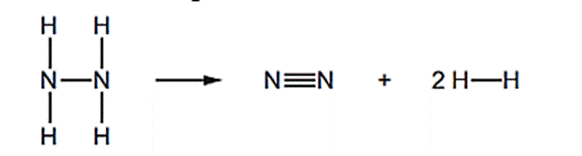
Biến thiên enthalpy chuẩn của phản ứng được xác định là –99 kJ/mol.
Năng lượng liên kết của liên kết N – N là bao nhiêu? Biết năng lượng liên kết của một số loại liên kết được cho trong bảng sau.
| Liên kết | Năng lượng liên kết (kJ/mol) |
| N≡N | 946 |
| N-H | 389 |
| H-H | 436 |
163
BÀI TẬP THAM KHẢO THÊM
Câu 1: Nhiệt tỏa ra hình hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) có được coi là nhiệt tạo thành chuẩn của Na2O(s) không? Giả sử Na tác dụng được với O3 thu được Na2O.
Trả lời: Không
Câu 2: Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam CH4(g) để cung cấp nhiệt cho phản ứng tạo 0,5 mol CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
Trả lời: 1,6 gam
Câu 3: Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) ![]() CO2(g) + 2H2O(l)
CO2(g) + 2H2O(l) ![]() = –890,3 kJ
= –890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là –393,5 và –285,8 kJ/mol. Hãy tính nhiệt tạo thành chuẩn của khí methane.
Trả lời: ![]()
Câu 4: Giá trị ∆r ![]() của phản ứng sau là bao nhiêu kilôJun?
của phản ứng sau là bao nhiêu kilôJun?
CH4 + 2O2 → CO2 + 2H2O
Trả lời: - 445,18 kJ
Trả lời: -1300,26 kJ
Câu 6: Cho phản ứng hydrogen hóa ethylene sau:
CH2=CH2(g) + H2(g) ![]() CH3–CH3(g)
CH3–CH3(g)
Biết năng lượng liên kết trong các chất cho trong bảng sau:
Liên kết | Phân tử | Eb (kJ/mol) | Liên kết | Phân tử | Eb (kJ/mol) |
C=C | C2H4 | 612 | C–C | C2H6 | 346 |
C–H | C2H4 | 418 | C–H | C2H6 | 418 |
H–H | H2 | 436 |
Tính biến thiên enthalpy (kJ/mol) của phản ứng trên
Trả lời: ………………………………………
Câu 7: Giá trị ∆r ![]() của phản ứng sau là bao nhiêu kilôJun?
của phản ứng sau là bao nhiêu kilôJun?
H2(g) + Cl2(g) → 2HCl(g)
Trả lời: ………………………………………
Câu 8: Phosgene là một chất độc. Ở nồng độ 0,005 mg/L đã nguy hiểm đối với người; trong khoảng 0,1 -0,3 mg/L, gây tử vong sau khoảng 15 phút.
Phosgene được điều chế bằng cách cho hỗn hợp CO và Cl2 đi qua than hoạt tính. Biết: Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl)= 339 kJ/mol; Eb(C=O) = 745 kJ/mol; Eb(C≡O) = 1075 kJ/mol.
Hãy tính biến thiên enthalpy của phản ứng tạo thành phosgene từ CO và Cl2.
Trả lời: ………………………………………
Câu 9: Cho dữ liệu sau:
- Phản ứng nhiệt nhôm là phản ứng tỏa nhiệt.
- Quang hợp là phản ứng tỏa nhiệt.
- Hô hấp là phản ứng thu nhiệt.
- Phản ứng trung hòa là phản ứng tỏa nhiệt.
Trả lời: ………………………………………
Câu 10: Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam CH4(g) để cung cấp nhiệt cho phản ứng tạo 1 mol CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
Trả lời: ………………………………………
Câu 11: Ở điều kiện chuẩn 2 mol nhôm tác dụng vừa đủ với khí chlorine tạo muối aluminium chloride và giải phóng một lượng nhiệt 1390,81kJ.
Tính lượng nhiệt được giải phóng khi 10 gam AlCl3 được tạo thành
Trả lời: ………………………………………
Câu 12: Có bao nhiêu phản ứng dưới đây cần phải cung cấp năng lượng trong quá trình phản ứng: phản ứng tạo gỉ kim loại, phản ứng quang hợp, phản ứng nhiệt phân, phản ứng đốt cháy.
Trả lời: ………………………………………
Câu 13: Cho các nhận định sau, có bao nhiêu nhận định sai?
- Phản ứng được xem là tỏa nhiệt khi ∆r
 < 0
< 0 - ∆r
 =
= 
(3) Muốn tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết phải viết công thức cấu tạo của tất cả các chất trong phản ứng để xác định số lượng liên kết.
Trả lời: ………………………………………
Câu 14: Cho các phản ứng
CaCO3(s) ![]() CaO(s) + CO2(g)
CaO(s) + CO2(g) ![]() = +178,49 kJ
= +178,49 kJ
C(graphite, s) + O2(g) ![]() CO2(g)
CO2(g) ![]() = –393,51 kJ
= –393,51 kJ
Khối lượng graphite cần dùng khi đốt cháy hoàn toàn đủ tạo lượng nhiệt cho quá trình nhiệt phân hoàn toàn 0,1 mol CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
Trả lời: ………………………………………
Câu 15: Trong một chu trình, công hệ nhận là 2 kcal. Tính nhiệt mà hệ trao đổi:
Trả lời: ………………………………………
Câu 16: Dựa vào phương trình nhiệt hóa học của phản ứng sau:
CO2 (g) → CO(g) + ![]() O2 (g)
O2 (g) ![]() 280 kJ
280 kJ
Giá trị ![]() của phản ứng 2CO + O2 (g) → 2CO2(g) là bao nhiêu kJ?
của phản ứng 2CO + O2 (g) → 2CO2(g) là bao nhiêu kJ?
Trả lời: ………………………………………
Câu 17: Một hộ gia đình mua than đá làm nhiên liệu đun nấu và trung bình mỗi ngày dùng hết 1,8 kg than. Giả thiết loại than đá trên chứa 90% carbon và 1,2% sulfur về khối lượng, còn lại là các tạp chất trơ.
Cho các phản ứng: ![]()
Nhiệt lượng cung cấp cho hộ gia đình từ quá trình đốt than trong một ngày tương đương bao nhiêu số điện (1 số điện = 1 kWh = 3600 kJ)?
Trả lời: ………………………………………
Câu 18: Một mẫu khí gas X chứa hỗn hợp propane và butane.
Cho các phản ứng: ![]()
Trả lời: ………………………………………
Câu 19: Cho phản ứng đốt cháy butane sau:
C4H10(g) + O2(g) ![]() CO2(g) + H2O(g) (1)
CO2(g) + H2O(g) (1)
Biết năng lượng liên kết trong các hợp chất cho trong bảng sau:
Liên kết | Phân tử | Eb (kJ/mol) | Liên kết | Phân tử | Eb (kJ/mol) |
C – C | C4H10 | 346 | C = O | CO2 | 799 |
C – H | C4H10 | 418 | O – H | H2O | 467 |
O = O | O2 | 495 |
Một bình gas chứa 12 kg butane có thể đun sôi bao nhiêu ấm nước? (Giả thiết mỗi ấm nước chứa 2 L nước ở 250C, nhiệt dung của nước là 4,2 J/g.K, có 40% nhiệt đốt cháy butane bị thất thoát ra ngoài môi trường).
Trả lời: ………………………………………
Câu 20: Một hộ gia đình mua than đá làm nhiên liệu đun nấu và trung bình mỗi ngày dùng hết 1,60 kg than. Giả thiết loại than đá trên chứa 90% carbon về khối lượng, còn lại là các tạp chất trơ. Cho phản ứng: C(s) + O2(g) → CO2(g) ![]()
Nhiệt lượng cung cấp cho hộ gia đình từ quá trình đốt than trong một ngày tương đương bao nhiêu số điện? Biết rằng 1 số điện = 1 kWh = 3600 kJ. Nguyên tử khối của carbon là 12. (kết quả làm tròn đến hàng đơn vị)
Trả lời: ………………………………………
Câu 21: Một bình gas sử dụng trong hộ gia đình X có chứa 12 kg khí hóa lỏng (LPG) gồm propane và butane với tỉ lệ mol tương ứng là 2: 3. Khi đốt cháy hoàn toàn, 1 mol propane tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí gas của hộ gia đình X là 10000 kJ/ngày và sau 45 ngày gia đình X dùng hết bình gas trên. Hiệu suất sử dụng nhiệt của hộ gia đình X là bao nhiêu.
Trả lời: ………………………………………
Câu 22: Ở điều kiện chuẩn, nhiệt lượng tỏa ra của phản ứng sau là 1035,88 kJ
2H2S(g) + 3O2(g) → 2SO2(g) + 2H2O(g)
Tính ![]() của H2S. (kết quả làm tròn đến hàng phần mười)
của H2S. (kết quả làm tròn đến hàng phần mười)
Cho biết:
Chất | O2(g) | SO2(g) | H2O(g) |
0 | -296,8 | -241,8 |
Trả lời: ………………………………………
Câu 23: Khí biogas (giả thiết chỉ chứa CH4) và khí gas (chứa 40% C3H8 và 60% C4H10 về thể tích) được dùng phổ biến làm nhiên liệu và đun nấu. Nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1 mol các chất như bảng sau:
Chất | CH4 | C3H8 | C4H10 |
Nhiệt tỏa ra (kJ) | 890 | 2220 | 2850 |
Nếu nhu cầu về năng lượng không đổi, hiệu suất sử dụng các loại nhiên liệu như nhau, khi dùng khí biogas để thay thế khí gas để làm nhiên liệu đốt cháy thì lượng khí CO2 thải ra môi trường sẽ giảm bao nhiêu %.
Trả lời: ………………………………………
Câu 24: Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
Liên kết | C–H | C–C | C=C |
Eb (kJ/mol) | 418 | 346 | 612 |
Biến thiên enthalpy của phản ứng: C3H8(g) → CH4(g) + C2H4(g) có giá trị bao nhiêu kJ?
Trả lời: ………………………………………
Câu 25: Xác định năng lượng của liên kết C – C trên cơ sở các dữ kiện sau :
– C2H6(g) + ![]() O2(g)
O2(g)![]() 2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l) ![]() = –1561 kJ
= –1561 kJ
– Cho enthalpy tạo thành chuẩn :
![]() = – 394 kJ / mol ;
= – 394 kJ / mol ; ![]() = – 285 kJ/mol.
= – 285 kJ/mol.
– Than chì ![]() C(g)
C(g) ![]() = 717 kJ / mol.
= 717 kJ / mol.
– Năng lượng liên kết : Eb (H– H) = 432 kJ/mol ; Eb (C – H) = 411 kJ/mol
Trả lời: ………………………………………
----------------------------------
----------------------- Còn tiếp -------------------------
=> Giáo án hóa học 10 cánh diều bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hoá học
