Giáo án điện tử hóa học 10 cánh diều bài 17: Nguyên tố và đơn chất halogen
Bài giảng điện tử hóa học 10 cánh diều. Giáo án powerpoint bài 17: Nguyên tố và đơn chất halogen. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 10 cánh diều (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét










Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 10 cánh diều
CHỦ ĐỀ 7: NGUYÊN TỐ NHÓM VIIA (NHÓM HALOGEN)
BÀI 17: NGUYÊN TỐ VÀ ĐƠN CHẤT HALOGEN
- KHỞI ĐỘNG
Vì sao nước chlorine được sử dụng phổ biến để khử trùng, sát khuẩn?
- NỘI DUNG BÀI HỌC
- Giới thiệu về nguyên tố nhóm VIA
- Đơn chất Halogen
III. PHẦN TRIỂN KHAI KIẾN THỨC
- Giới thiệu về nguyên tố nhóm VIA
Em hãy hoàn thành Phiếu học tập số 1
Làm việc nhóm: Em hãy hoàn thành Phiếu học tập số 1
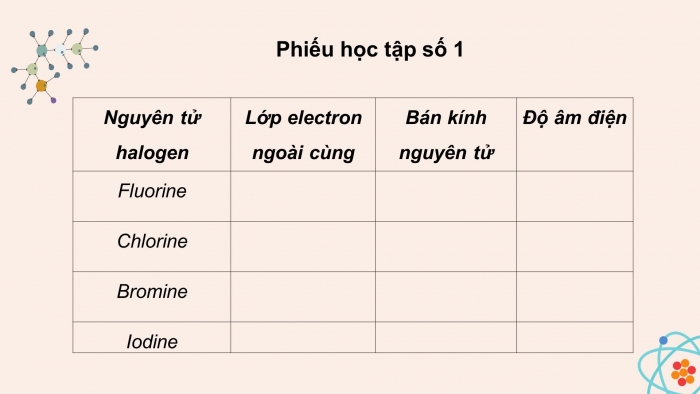
Phiếu học tập số 1
a. Giải thích tại sao nguyên tử có xu hướng nhận 1 e từ nguyên tử kim loại hoặc góp chung e với nguyên tử phi kim để hình thành liên kết b. Nêu và giải thích xu hướng biến đổi bán kính nguyên tử, độ âm điện của các nguyên tử halogen. Từ đó dự đoán xu hướng biến đổi tính oxi hóa từ F đến I. c. Dựa vào cấu hình electron lớp ngoài cùng và độ âm điện, giải thích tại sao nguyên tử fluorine chỉ có số oxi hóa -1 trong các hợp chất? |
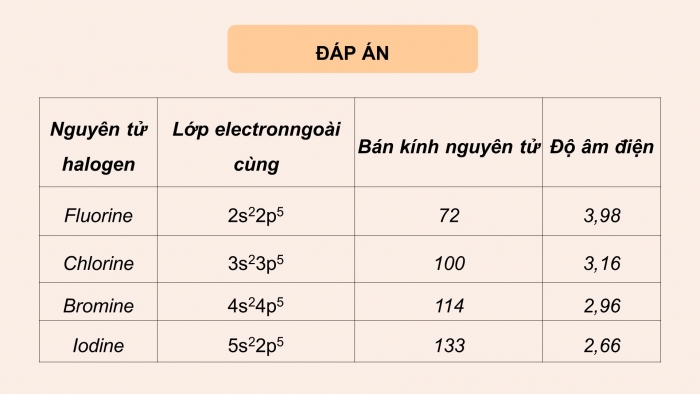
Đáp án:
Nguyên tử halogen | Lớp electron ngoài cùng | Bán kính nguyên tử | Độ âm điện |
Fluorine | 2s22p5 | 72 | 3,98 |
Chlorine | 3s23p5 | 100 | 3,16 |
Bromine | 4s24p5 | 114 | 2,96 |
Iodine | 5s22p5 | 133 | 2,66 |
a.
Nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron từ nguyên tử kim loại, hoặc góp chung 1 electron với nguyên tử phi kim để đạt được cấu hình electron bền cùng khí hiếm gần nhất.
b.
Đi từ F – I, bán kính nguyên tử tăng dần vì lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
Đi từ F – I, độ âm điện giảm dần vì số lớp electron tăng, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
⇒ Dự đoán: Tính oxi hóa giảm dần từ F > Cl > Br > I.
c.
- Nguyên tử fluorine có độ âm điện lớn nhất ⇒ có xu hướng hút electron về mình.
- Lớp ngoài cùng có 7 electron ⇒ nhận 1 electron về mình để đạt cấu hình electron bền vững của khí hiếm gần nó nhất (Ne).
⇒ Trong các hợp chất, fluorine chỉ có số oxi hóa là -1.
Em hãy đọc thông tin bảng 17.2 SGK, nêu một số dạng tồn tại trong tự nhiên của các nguyên tố halogen
BẢNG 17.2
- Đơn chất halogen
2.1. Xu hướng biến đổi một số tính chất vật lý
Em hãy hoàn thành Phiếu học tập số 2
Phiếu số 02: a, Nêu xu hướng biến đổi trạng thái, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi của các nguyên tố trong nhóm halogen? Giải thích b, Dựa vào xu hướng biến đổi tính chất của các đơn chất halogen trong bảng 17.3, hãy dự đoán về thể (trạng thái) của đơn chất astatine ở điều kiện thường. Giải thích. BẢNG 17.3 c, Trong điều kiện thường halogen nào ở thể rắn? Vì sao? |
Đáp án
a,
- Trạng thái: từ khí ® lỏng® rắn. Do xu hướng tăng khối lượng phân tử và sự tương tác giữa các phân tử.
- Màu sắc: đậm dần.
- Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần. Do tương tác van der Walls và sự tăng khối lượng phân tử
b,
- Từ bảng 17.3, xu hướng biến đổi trạng thái của các halogen: khí → lỏng → rắn
- Astatine đứng dưới cùng trong nhóm halogen
Astatine tồn tại ở thể rắn trong điều kiện thường
c,Trong điều kiện thường có Iodine (I2) là ở thể rắn
- Giải thích:
+ Khối lượng phân tử cao
+ Lực tương tác van der Waals giữa phân tử iodine mạnh.
- Orbital nguyên tử
Hoạt động nhóm: Hãy nêu các xu hướng tạo liên kết khi halogen phản ứng với các chất khác?
Đáp án
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 10 cánh diều
GIÁO ÁN WORD LỚP 10 - SÁCH CÁNH DIỀU
GIÁO ÁN POWERPOINT LỚP 10 - SÁCH CÁNH DIỀU
GIÁO ÁN CHUYÊN ĐỀ LỚP 10 - SÁCH CÁNH DIỀU
GIÁO ÁN LỚP 10 CÁC BỘ SÁCH KHÁC
Giáo án lớp 10 sách chân trời sáng tạo (bản word)
Giáo án lớp 10 sách chân trời sáng tạo (bản powrerpoint)
Giáo án lớp 10 sách kết nối tri thức (bản word)
Giáo án lớp 10 sách kết nối tri thức (bản powrerpoint)
Cách đặt mua:
Liên hệ Zalo: Fidutech - Nhấn vào đây
