Giáo án điện tử hóa học 10 cánh diều bài 5: Lớp, phân lớp và cấu hình electron
Bài giảng điện tử hóa học 10 cánh diều. Giáo án powerpoint bài 5: Lớp, phân lớp và cấu hình electron. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 10 cánh diều (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét










Xem video về mẫu Giáo án điện tử hóa học 10 cánh diều bài 5: Lớp, phân lớp và cấu hình electron
Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 10 cánh diều
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC NGÀY HÔM NAY
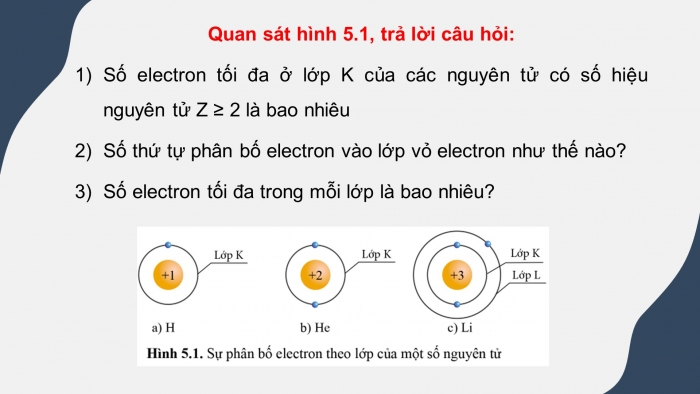
Quan sát hình 5.1, trả lời câu hỏi:
- Số electron tối đa ở lớp K của các nguyên tử có số hiệu nguyên tử Z ≥ 2 là bao nhiêu
- Số thứ tự phân bố electron vào lớp vỏ electron như thế nào?
- Số electron tối đa trong mỗi lớp là bao nhiêu?
Trong hình 5.1 có He (Z = 2) và Li (Z > 2), ta thấy lớp K của 2 nguyên tử này đều có 2 electron ⇒ số electron tối đa ở lớp K của các nguyên tử có số hiệu nguyên tử Z ≥ 2 là 2.
Thứ tự phân bố electron vào lớp vỏ nguyên tử: Các electron sẽ được phân bố lần lượt vào các lớp theo chiều từ gần hạt nhân ra ngoài.
Mỗi lớp có số electron đối đa xác định, như lớp thứ nhất có tối đa 2 electron, lớp thứ 2 có tối đa 8 electron,…
BÀI 5: LỚP, PHÂN LỚP VÀ CẤU HÌNH ELECTRON
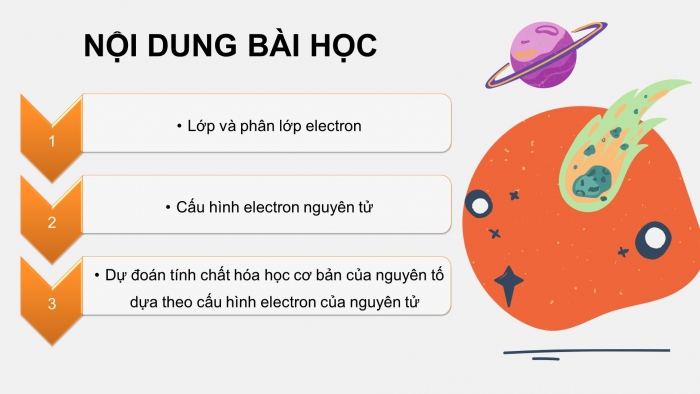
NỘI DUNG BÀI HỌC
- Lớp và phân lớp electron
- Cấu hình electron nguyên tử
- Dự đoán tính chất hóa học cơ bản của nguyên tố dựa theo cấu hình electron của nguyên tử
- Lớp và phân lớp electron
- Các electron trong lớp vỏ nguyên tử được phân bố dựa vào các lớp và phân lớp theo yếu tố nào?
- Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo yêu tố năng lượng của chúng.
Nhận xét về mức năng lượng của các electron trên mỗi lớp.
- Các electron thuộc cùng một lớp có năng lượng gần bằng
- Dựa vào bảng 5.1 sgk, nhận xét về mối quan hệ giữa số lượng AO và số electron tối đa trên mỗi lớp. Rút ra quy tắc xác định số electron và số AO trong lớp electron thứ n (n ≤ 4).
Câu trả lời:
- Lớp K n=1 có 1 AO với số electron tối đa là 2
- Lớp L n=2 có 4 AO với số electron tối đa là 8
- Lớp M n=3 có 9 AO với số electron tối đa là 9
- Lớp N có n=4 có 32 AO với số electron tối đa là 32
Nhận xét:
- Lớp AO thứ n có n2 AO
- Lớp thứ n có tối đa 2n2AO
Câu 1: Vì sao số AO trong một lớp luôn bằng một nửa số electron tối đa thuộc lớp đó.
Câu trả lời:
Vì mỗi AO có tối đa 2 electron nên số AO luôn bằng 1 nửa số electron tối đa thuộc lớp đó.
Câu hỏi luyện tập 1: Lớp electron ngoài cùng của nitrogen (Z = 7) có bao nhiêu electron, bao nhiêu AO?
Số hiệu nguyên tử (Z) = số electron
⇒ Nitrogen có 7 electron được phân bố vào 2 lớp:
+ Lớp thứ nhất chứa 2 electron, phân bố vào 1 AO.
+ Lớp thứ hai chứa 5 electron, phân bố vào 4 AO.
Như vậy lớp ngoài cùng của nitrogen chứa 5 electron, phân bố vào 4 AO.
- Phân lớp electron
Mỗi lớp electron được chia thành các phân lớp theo nguyên tắc nào?
Mỗi lớp electron (trừ lớp thứ nhất) được chia thành các phân lớp theo nguyên tắc: Các electron thuộc cùng một phân lớp có năng lượng bằng nhau.
Câu 2: Các ô (1), (2), (3), (4) trong hình dưới đây liên hệ với nội dung nào về cấu tạo lớp vỏ nguyên tử?
Câu trả lời:
Các ô (1), (2), (3), (4) trong hình liên hệ với số phân lớp electron trong một lớp electron.
- Lớp K, n =1 có 1 phân lớp,
- Lớp L, n = 2 có 2 phân lớp,
- Lớp M, n = 3 có 3 phân lớp,
- Lớp N, n = 4 có 4 phân lớp.
Hãy nêu số lượng và kí hiệu các phân lớp trong một phân lớp.
Câu trả lời:
Lớp electron thứ n có n phân lớp và được kí hiệu lần lượt là ns, np, nd, nf,... Cụ thể:
- Lớp K, n= 1: có 1 phân lớp, được kí hiệu là 1s.
- Lớp L, n=2: có 2 phân lớp được kí hiệu là 2s và 2p.
- Lớp M, n=3: có 3 phân lớp, được kí hiệu là 3s, 3p, 3d.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 10 cánh diều
GIÁO ÁN WORD LỚP 10 - SÁCH CÁNH DIỀU
GIÁO ÁN POWERPOINT LỚP 10 - SÁCH CÁNH DIỀU
GIÁO ÁN CHUYÊN ĐỀ LỚP 10 - SÁCH CÁNH DIỀU
GIÁO ÁN LỚP 10 CÁC BỘ SÁCH KHÁC
Giáo án lớp 10 sách chân trời sáng tạo (bản word)
Giáo án lớp 10 sách chân trời sáng tạo (bản powrerpoint)
Giáo án lớp 10 sách kết nối tri thức (bản word)
Giáo án lớp 10 sách kết nối tri thức (bản powrerpoint)
Cách đặt mua:
Liên hệ Zalo: Fidutech - Nhấn vào đây
