Giáo án điện tử hóa học 10 chân trời bài 16. Các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học
Bài giảng điện tử hóa học 10 chân trời. Giáo án powerpoint bài 16. Các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 10 chân trời sáng tạo (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét











Xem toàn bộ: Giáo án điện tử hoá học 10 chân trời sáng tạo
BÀI 16. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN TỐC ĐỘ PHẢN ỨNG HOÁ HỌC
- KHỞI ĐỘNG
Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn
HÌNH a
Khi nấu một loại thực phẩm bằng nồi áp suất sẽ nhanh chín hơn
HÌNH b
Bệnh nhân sẽ dễ hô hấp hơn khi dùng oxygen từ bình chứa khí oxygen so với từ không khí
HÌNH c
Những yếu tố nào ảnh hưởng đến tốc độ của các quá trình biến đổi trên?
- NỘI DUNG BÀI HỌC
- Ảnh hưởng của nồng độ
- Ảnh hưởng của nhiệt độ
- Ảnh hưởng của áp suất
- Ảnh hưởng của bề mặt tiếp xúc
- Ảnh hưởng của chất xúc tác
- Ý nghĩa thực tiễn của tốc độ phản ứng trong đời sống và sản xuất
III. PHẦN TRIỂN KHAI KIẾN THỨC
- Ảnh hưởng của nồng độ
Hoạt động nhóm: Tiến hành thí nghiệm 1: Ảnh hưởng của nồng độ đến tốc độ phản ứng
Hoá chất: Dung dịch Na2S2O3 0,15 M; H2SO4 0,10 M; nước cất
Dụng cụ: Cốc thuỷ tinh 100 ml, ống đong 50 mL
Tiến hành:
Bước 1: Pha loãng dung dịch Na2S2O3 0,15 M như Bảng 16.1
Hoá chất | Cốc 1 | Cốc 2 | Cốc 3 |
Dung dịch Na2S2O3 | 50 | 30 | 10 |
Nước cất (mL) | 0 | 20 | 40 |
Bước 2: Rót đồng thời 10 mL dung dịch H2SO4 0,1 M vào mỗi cốc và khuấy đều.
Phương trình hóa học của phản ứng
Na2S2O3(aq) + H2SO4(aq) à Na2SO4(aq) + S(s) +SO2(g) +H2O(l)
HÌNH 16.1
Em hãy trả lời Câu hỏi 1, 2, Luyện tập SGK trang 98, 99
- Nhận xét mối liên hệ giữa thể tích dung dịch Na2S2O3với thời gian xuất hiện kết tủa.
- Quan sát Hình 16.2 và phương trình hóa học của phản ứng, giải thích kết quả thí nghiệm 1.
Na2S2O3(aq) + H2SO4(aq) → Na2SO4(aq) + S(s) + SO2(g) + H2O(l)
HÌNH 16.2
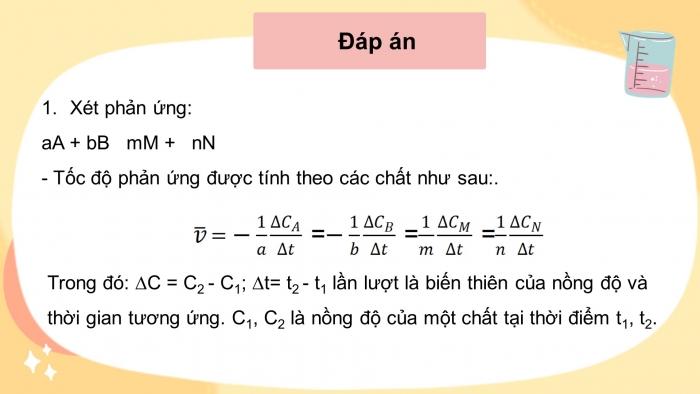
Đáp án
- Thể tích dung dịch Na2S2O3 càng lớn, thời gian phản ứng càng ngắn, tốc độ phản ứng nhanh.
2.
+ Theo định luật tác dụng khối lượng cho phản ứng, tại nhiệt độ xác định: v =k..à càng lớn, tốc độ phản ứng càng nhanh.
+ Theo lí thuyết va chạm, C (M) à nhiều va chạm hiệu quả hơn à tốc độ phản ứngà lượng S tạo ra càng nhanh sẽ làm mờ dấu thập phân.
Luyện tập. Giữ nguyên nồng độ dung dịch Na2S2O3 ban đầu, pha loãng dung dịch H2SO4 tương tự như cách pha loãng dung dịch Na2S2O3 theo Bảng 16.1, kết quả thí nghiệm sẽ thay đổi thế nào?
Đáp án
Ta có: v = k.., giữ nguyên và pha loãng H2SO4. Kết quả thí nghiệm không thay đổi, tốc độ phản ứng chậm dần từ cốc 1 đến 3.
Kết luận:
Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
- Ảnh hưởng của nhiệt độ
Hoạt động nhóm: Đọc Ví dụ 1 và thực hiện Câu hỏi 3, 4 SGK trang 99, 100
Ví dụ 1: Có 2 cốc thủy tinh, mỗi cốc đựng cùng một lượng hỗn hợp dung dịch oxalic acid (H2C2O4) và dung dịch H2SO4 loãng, tỉ lệ 2 : 1 về thể tích, cốc (1) được đun nóng, thêm đồng thời cùng một lượng dung dịch KmnO4 vào mỗi cốc (Hình 16.3a), nhận thấy màu của hỗn hợp phản ứng nhạt dần theo thời gian phản ứng (Hình 16.3b)
Phương trình hóa học của phản ứng:
2KmnO4(aq) + 5H2C2O4(aq) + 3H2SO4(aq) à 2MnSO4(aq) + 10CO2(g) + 8H2O(l)
HÌNH 16.3
- Quan sát Hình 16.3, nhận xét sự ảnh hưởng của nhiệt độ đến tốc độ phản ứng
- Quan sát Hình 16.4 và phương trình hóa học của phản ứng, giải thích vì sao tốc độ mất màu của KMnO4trong 2 cốc không giống nhau.
HÌNH 16.4
Đáp án
3.
Ở nhiệt độ cao hơn, tốc đô phản ứng xảy ra nhanh hơn
Khi đun nóng, các phân tử chất phản ứng chuyển động với vận tốc nhanh hơn, dẫn đến sự gia tăng của KMnO4 trong 2 cốc không giống nhau.
Kết luận:
+ Khi tăng nhiệt độ, tốc độ phản ứng tăng
+ Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hóa học được biểu diễn bằng công thức:
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 10 chân trời sáng tạo
