Giáo án điện tử hóa học 10 chân trời bài 2: Thành phần của nguyên tử
Bài giảng điện tử hóa học 10 chân trời. Giáo án powerpoint bài 2: Thành phần của nguyên tử. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 10 chân trời sáng tạo (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét











Xem video về mẫu Giáo án điện tử hóa học 10 chân trời bài 2: Thành phần của nguyên tử
Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 10 chân trời sáng tạo
CHÀO MỪNG CÁC EM ĐẾN VỚI TIẾT HỌC HÔM NAY!
Từ rất lâu, các nhà khoa học đã nghiên cứu các mô hình nguyên tử và cập nhật chúng thông qua việc thu thập những dữ liệu thực nghiệm. Nguyên tử gồm những hạt cơ bản nào? Cơ sở nào để phát hiện ra các hạt cơ bản đó và chúng có tính chất gì?
CHƯƠNG 1: CẤU TẠO NGUYÊN TỬ
BÀI 2: THÀNH PHẦN CỦA NGUYÊN TỬ
NỘI DUNG BÀI HỌC
Thành phần cấu tạo nguyên tử
Sự tìm ra electron
Sự khám phá hạt nhân nguyên tử
Cấu tạo hạt nhân nguyên tử
Kích thước và khối lượng nguyên tử
- Thành phần cấu tạo nguyên tử
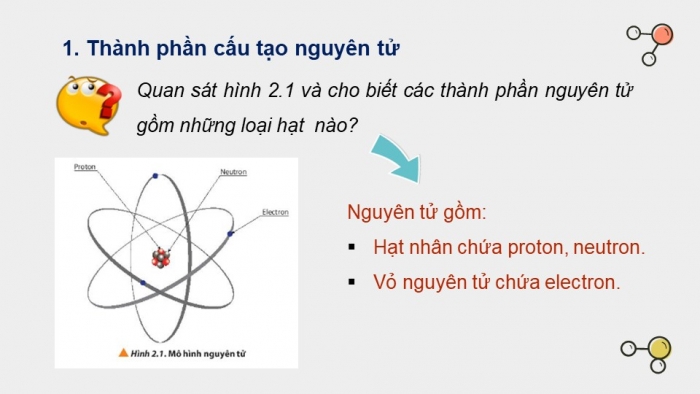
Quan sát hình 2.1 và cho biết các thành phần nguyên tử gồm những loại hạt nào?
Nguyên tử gồm:
- Hạt nhân chứa proton, neutron.
- Vỏ nguyên tử chứa electron.
- Sự tìm ra electron
Đọc thông tin SGK, tìm hiểu thí Hình 2.2 của Thomson và trả lời câu hỏi:
- Em hãy cho biết vai trò của màn huỳnh quang trong thí nghiệm.
- Quan sát hình 2.2, giải thích vì sao tia âm cực bị hút về cực dương của trường điện.
- Nết đặt một chong chóng nhẹ trên đường đi của tia âm cực thì chong chóng sẽ quay. Từ hiện tượng đó, hãy nêu kết luận về tính chất của tia âm cực?
- Vai trò của màn huỳnh quang: Dùng để hứng các tia phát ra từ cực âm
- Giải thích: Tia âm cực tích điện âm nên bị hút về cực dương của trường điện
- Kết luận về tính chất tia âm cực: Tia âm cực là một loại hạt có khối lượng và truyền theo đường thẳng.
KẾT LUẬN
- Trong nguyên tử tồn tại một loại hạt có khối lượng và mang điện tích âm, được gọi là electron (kí hiệu là e)
- Hạt electron có:
- Điện tích: C
- Khối lượng: g
- Người ta chưa phát hiện được điện tích nào nhỏ hơn C nên nó được dùng làm điện tích đơn vị, điện tích của electron được quy ước là -1.
Sau khi quan sát thí nghiệm, em hãy cho biết các hạt α có đường đi như thế nào? Giải thích?
Các hạt alpha hầu hết đều xuyên thẳng qua lá vàng. Do nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương có kích thước rất nhỏ so với kích thước nguyên tử nên các hạt alpha có thể đi xuyên qua.
Quan sát kết quả thí nghiệm của Rutherford và trả lời câu hỏi:
- Ở hình 2.4, kết quả thí nghiệm khám phá hạt ngân nguyên tử của Rutherford, nguyên tử oxygen có 8 electron. Em hãy cho biết hạt nhân của nguyên tử này có điện tích là bao nhiêu?
- Theo em, điện tích của hạt nhân nguyên tử do thành phần nào quyết định. Từ đó rút ra mối quan hệ giữa số đơn vị diện tích hạt nhân và số proton?
- Điện tích của hạt nhân nguyên tử do proton quyết định => Số đơn vị điện tích hạt nhân = số proton
KẾT LUẬN
Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở trung tâm và lớp vỏ ở các electron chuyển động xung quanh hạt nhân.
Nguyên tử trung hoà về điện: số đơn vị điện tích dương của hat nhân bằng số đơn vị điện tích âm của các electron trong nguyên tử.
- Cấu tạo hạt nhân nguyên tử
Đọc thông tin mục 4 SGK trang 16, 17 và trả lời câu hỏi:
- Hạt nhân gồm có những loại hạt nào? Các loại hạt đó mang điện tích gì?
- Nguyên tử natri (sodium) có điện tích hạt nhân là +11. Cho biết số proton và số electron trong nguyên tử này?
- Em hãy rút ra kết luận về khối lượng của proton và neutron?
KẾT LUẬN
- Hạt nhân nguyên tử gồm hai loại hạt là proton và neutron
- Proton mang điện tích dương (+1)
- Neutron không mang điện
- Proton và neutron có khối lượng gần bằng nhau.
- Kích thước và khối lượng nguyên tử
- So sánh kích thước nguyên tử và hạt nhân nguyên tử
Đọc thông tin mục 5 trang 17 SGK và trả lời câu hỏi:
Quan sát Hình 2.6, hãy lập tỉ lệ giữa đường kính nguyên tử và đường kính hạt nhân của nguyên tử carbon. Từ đó, rút ra nhận xét.
Tỉ lệ:
đường kính nguyên tử : đường kính hạt nhân = : =
nguyên
Để biểu thị kích thước nguyên tử, ta sử dụng đơn vị nào?
Đơn vị nanomet (nm) hay angstrom (Å)
1 nm = m; 1 Å = m; 1nm = 10 Å
KẾT LUẬN
Nếu xem nguyên tử như một quả cầu, trong đó các electron chuyển động rất nhanh xung quanh hạt nhân thì nguyên tử đó có đường kính khoảng m và đường kính hạt nhân khoảng m. Như vậy, đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10 000 lần.
- Tìm hiểu khối lượng của nguyên tử
Thảo luận cặp đôi:
Dựa vào Bảng 2.1, hãy lập tỉ lệ khối lượng của một proton với khối lượng của một electron. Kết quả này nói lên điều gì?
Tỉ lệ: = 1840 (lần)
Kết quả này cho thấy khối lượng của các hạt electron không đáng kể so với khối lượng của proton và neutron, do đó khối lượng của nguyên tử gần bằng khối lượng của hạt nhân.
Nguyên tử oxygen -16 có 8 proton 8 neutron và 8 electron. Tính khối lượng nguyên tử oxygen theo đơn vị gam và amu.
Giải
Khối lượng nguyên tử oxygen theo đơn vị gam là:
8 × 1,673 × + 8 × 1,675 × + 8 × 9,11 × ≈ 2,68 × (g)
Khối lượng nguyên tử oxygen theo đơn vị amu là:
8 × 1 + 8 × 1 + 8 × 0,00055 ≈ 16,0044 (amu)
KẾT LUẬN
Khối lượng của nguyên tử gần bằng khối lượng hạt nhân do khối lượng của các electron không đáng kể so với khối lượng của proton và neutron.
LUYỆN TẬP
Câu 1. Hãy cho biết dữ kiện nào trong thí nghiệm của Rutherford chứng minh nguyên tử có cấu tạo rỗng.
Hầu hết các hạt alpha đều xuyên thẳng qua lá vàng điều đó chứng tỏ nguyên tử có cấu tạo rỗng nên các hạt alpha có thể đi xuyên qua lá vàng.
Câu 2. Thông tin nào sau đây không đúng?
- Proton mang điện tích dương, nằm trong hạt nhân, khối lượng gần bằng 1 amu
- Electron mang điện tích âm, nằm trong hạt nhân, khối lượng gần bằng 0 amu
- Neutron không mang điện, khối lượng gần bằng 1 amu
- Nguyên tử trung hòa điệ, có kích thước lớn hơn nhiều so với hạt nhân, nhưng có khối lượng gần bằng khối lượng hạt nhân.
Câu 3. Mỗi phát biểu dưới đây mô tả loại hạt nào trong nguyên tử?
- Hạt mang điện tích dương
- Hạt được tìm thấy trong hạt nhân và không mang điện
- Hạt mang điện tích âm.
VẬN DỤNG
Bài 4 (SGK - tr.19)
- a) Cho biết 1g electron có bao nhiêu hạt ?
- b) Tính khối lượng của 1 mol electron (biết hằng số Avogadro có giá trị là 6,022 x )
Giải
- a) Vì 1 hạt electron nặng 9,11 × 10-28 g nên 1 g electron có số hạt là: = 1,098 × 1027 (hạt)
- b) 1 mol electron có chứa số hạt là 6,022 × 1023 hạt
Do đó 1 mol electron có khối lượng là:
6,022 × 1023 × 9,11 × 10-28 = 5,486 × 10-4 (g)
HƯỚNG DẪN VỀ NHÀ
Ghi nhớ các kiến thức đã học
Hoàn thành bài tập trong SBT
Đọc trước bài sau - Bài 3: Nguyên tố hóa học
CẢM ƠN CÁC EM ĐÃ LẮNG NGHE BÀI GIẢNG!
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 10 chân trời sáng tạo
