Giáo án điện tử hóa học 10 chân trời bài 11: Liên kết hydrogen và tương tác van der waals (2 tiết)
Bài giảng điện tử hóa học 10 chân trời. Giáo án powerpoint bài 11: Liên kết hydrogen và tương tác van der waals (2 tiết). Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 10 chân trời sáng tạo (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét









Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 10 chân trời sáng tạo
BÀI 11. LIÊN KẾT HYDROGEN VÀ TƯƠNG TÁC VAN DER WAALS
(2 tiết)
- KHỞI ĐỘNG
Câu hỏi: Các nhà hóa học đã nghiên cứu và kết luận rằng nếu không có liên kết hydrogen thì nước sẽ sôi ở -80 độ C. Như vậy, nếu trong điều kiện thường, nước sẽ tồn tại ở thể khí (hơi nước). Khi đó, trên Trái Đất sẽ chẳng có các đại dương, sông, hồ,… và cũng không bao giờ có mưa. Mọi sự sống sẽ không tồn tại. Trái Đất sẽ là một hành tinh chết nếu không có sự hiện diện của liên kết hydrogen.
Liên kết hydrogen giữa các phân tử nước được tạo thành như thế nào? Ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước ra sao?
Hình ảnh (1.Khởi động)
- NỘI DUNG BÀI HỌC
- Liên kết hydrogen
- Tương tác van der Waals
III. TRIỂN KHAI KIẾN THỨC
- Liên kết hydrogen
- Tìm hiểu về liên kết hydrogen
Hoạt động nhóm: Đọc thông tin SGK và trả lời câu hỏi:
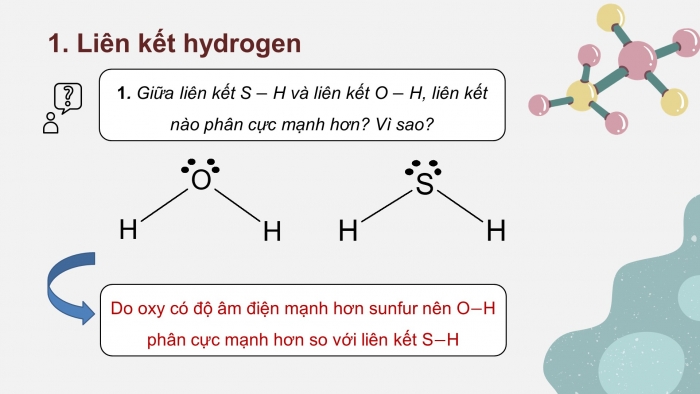
CH1. Giữa liên kết SH và liên kết OH, liên kết nào phân cực mạnh hơn? Vì sao?
Hình ảnh (2.Hình 11.1)
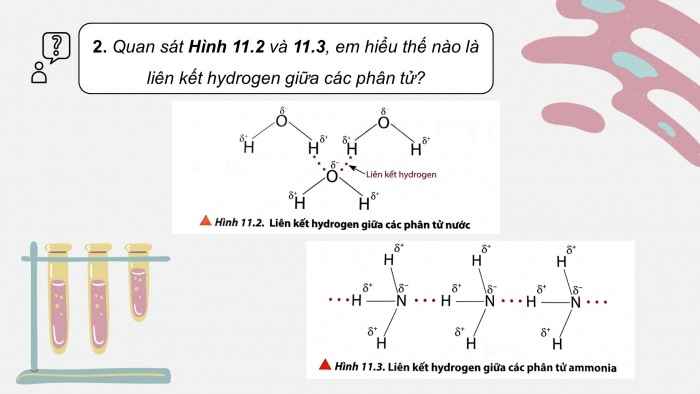
CH2. Quan sát hình 11.2 và 11.3, em hiểu thế nào là liên kết hydrogen giữa các phân tử?
Hình ảnh (3.Hình 11.2, 11.3)
CH3. So sánh độ bền của liên kết hydrogen với liên kết cộng hóa trị và liên kết ion.
Trả lời
CH1. Do oxy có độ âm điện mạnh hơn sunfur nên OH phân cực mạnh hơn so với liên kết SH.
CH2. Liên kết hydrogen giữa các phân tử là lực hút tĩnh điện giữa các nguyên tử H ở phân tử này với 1 nguyên tử phi kim mang điện tích âm lớn (F, O, N) còn cặp hóa trị chưa liên kết ở phân tử khác.
CH3. Lực hút tĩnh điện yếu giữa nguyên tử hydrogen tích một phần điện tích dương với một nguyên tử điện tích âm → liên kết hydro yếu hơn so với liên kết cộng hóa trị và liên kết ion.
à Kết luận: Liên kết hydrogen là một loại liên kết yếu, hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn ( thường là F,O,N) còn cặp electron hóa trị chưa tham gia liên kết.
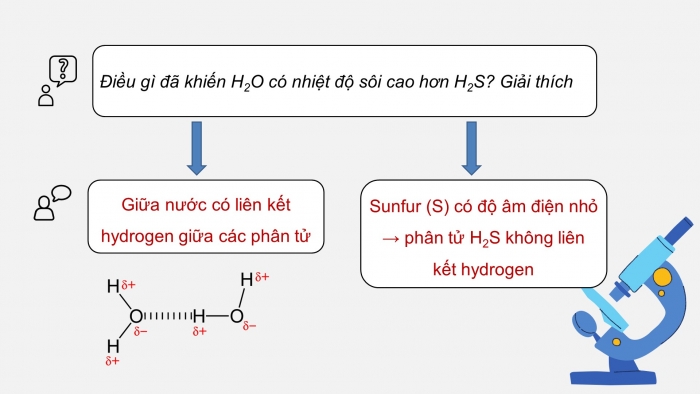
Câu hỏi luyện tập: Điều gì đã khiến H2O có nhiệt độ sôi cao hơn H2S? Giải thích.
Trả lời
Nước có nhiệt độ sôi cao hơn H2S do
+ Giữa nước có liên kết hydrogen giữa các phân tử.
+ Sunfur (S) có độ âm điện nhỏ → phân tử H2S không liên kết hydrogen
- Tìm hiểu vai trò, ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước.
Hoạt động nhóm: Cả lớp chia thành 2 nhóm, mỗi nhóm thực hiện 1 nhiệm vụ:
Nhiệm vụ 1: Nêu các tính chất vật lí của nước.
Nhiệm vụ 2: Nhận lấy đáp án của nhóm 1 và dùng những kiến thức đã học giải thích các tính chất vật lí đó.
Trả lời
Nhiệm vụ 1: Tính chất vật lí của nước:
- Nhiệt độ nóng chảy:
- Nhiệt độ sôi:
- Nước là dung môi tốt, hòa tan nhiều chất
Nhiệm vụ 2: Nước có liên kết hydrogen → nhiệt độ sôi, nhiệt độ nóng chảy cao hơn, phân tử dễ tan trong nước.
Hoạt động nhóm đôi: Quan sát hình 11.4 – 11.6 và trả lời câu hỏi:
Hình ảnh (4.Hình 11.4; 5.Hình 11.5; 6.Hình 11.6)
CH4. So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích.
CH5. Giải thích vì sao một phân tử nước có thể tạo được liên kết hydrogen tối đa với bốn phân tử nước khác.
Trả lời
CH4. Do chỉ NH3 tạo liên kết hydro với nước nên NH3 tan tốt trong nước so với CH4.
CH5. Mỗi phân tử nước có đúng 2 nguyên tử hydrogen và 2 cặp electron chưa liên kết trên oxygen. Do mỗi nguyên tử hydrogen và cặp electron trên oxygen đều có thể liên kết hydrogen → 1 phân tử nước liên kết hygrogen tối đa 4 phân tử nước khác như sau:
Hình ảnh (7.CH5)
à Kết luận: Nhờ liên kết hydrogen mà ở điều kiện thường, nước ở thể lỏng, có nhiệt độ sôi cao 100 độ C.
- Tương tác van der Waals
- Giới thiệu về tương tác van dẻ Waals (van đơ Van)
Hoạt động nhóm (5 nhóm): Quan sát hình 11.7, 11.8 và trả lời câu hỏi:
CH6. Quan sát hình 11.7, cho biết thế nào là một lưỡng cực tạm thời.
Hình ảnh (8.Hình 11.7)
CH7. Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút nào?
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 10 chân trời sáng tạo
