Giáo án điện tử hóa học 10 chân trời bài 12. Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống (3 tiết)
Bài giảng điện tử hóa học 10 chân trời. Giáo án powerpoint bài 12. Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống (3 tiết). Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 10 chân trời sáng tạo (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét











Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 10 chân trời sáng tạo
CHƯƠNG 4: PHẢN ỨNG OXI HÓA – KHỬ
BÀI 12. PHẢN ỨNG OXI HÓA – KHỬ VÀ ỨNG DỤNG TRONG CUỘC SỐNG (3 tiết)
- KHỞI ĐỘNG
Câu hỏi: Đom đóm có thể phát ra ánh sang, không tỏa nhiệt như ánh sáng nhân tạo. Cấu tạo bên trong da bụng của đom đóm là dãy các tế bào phát quang có chứa luciferin. Lucifein tác dụng với oxygen, cùng xúc tác emzyme, để tạo ra ánh sáng. Đây là phản ứng oxi hóa – khử.
Trong cuộc sống cũng như trong tự nhiên có nhiều hiện tượng mà nguyên nhân chính là do phản ứng oxi hóa – khử gây ra. Phản ứng oxi hóa khử là gì? Vai trò quan trọng của chúng trong cuộc sống như thế nào?
Hình ảnh (1.Khởi động)
- NỘI DUNG BÀI HỌC
- Số oxi hóa
- Phản ứng oxi hóa – khử
- Lập phương trình hóa học của phản ứng oxi hóa – khử
- Ý nghĩa của phản ứng oxi hóa – khử
III. TRIỂN KHAI KIẾN THỨC
- Số oxi hóa
- Tìm hiểu về số oxi hóa
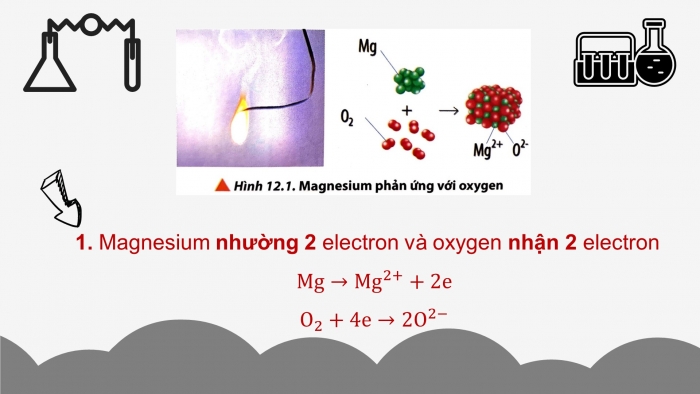
Hoạt động cặp đôi: Đọc thông tin SGK, quan sát hình 12.1, 12.2 và trả lời câu hỏi:
CH1. Quan sát hình 12.1, hãy viết quá trình nhường và nhận electron trong phản ứng giữa magnesium và oxygen.
Hình ảnh (2.Hình 12.1)
CH2. Quan sát hình 12.2a, hydrogen cháy trong chlorine với ngọn lửa sáng, tạo hợp chất hydrogen chloride (HCl). Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl (Hình 12.2b), hãy xác định điện tích của các nguyên tử trong phân tử HCl.
Hình ảnh (3.Hình 12.2)
Trả lời
CH1. Magnesium nhường 2 electron và oxygen nhận 2 electron.
CH2. Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl khi đó có thể coi Cl nhận 1 electron và H nhường 1 electron
Cl mang điện tích -1 và H mang điện tích +1.
à Kết luận:
- Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn.
- Cách biểu diễn số oxi hóa: Số oxi hóa được đặt ở phía trên kí hiệu nguyên tố.
Hình ảnh (4.Kết luận)
- Xác định số oxi hóa của nguyên tử các nguyên tố
Hoạt động cá nhân: Em hãy đọc thông tin SGK và trình bày 4 quy tắc xác định số oxi hóa.
Trả lời: Quy tắc xác định số oxi hóa:
Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0.
Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0.
Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó.
Quy tắc 4: Trong đa số các hợp chất:
- Số oxi hóa của hydrogen bằng +1, trừ các hydride kim loại (như NaH, CaH2 …).
- Số oxi hóa của oxygen bằng -2, trừ OF2 và các peroxide, superoxide (như H2O2, Na2O2, KO2 …).
- Kim loại kiềm ( nhóm IA) luôn có số oxi hóa là +1.
- Kim loại kiềm thổ (nhóm IIA) có số oxi hóa là +2.
- Nhôm (Aluminium) có số oxi hóa là +3
- Số oxi hóa của nguyên tử nguyên tố fluorine trong các hợp chất bằng -1.
Hoạt động nhóm 4: Dựa vào các quy tắc đã nêu và ví dụ SGK, trả lời câu hỏi:
VD2. Số oxi hóa của các nguyên tử trong đơn chất Na, O2, O3, Hg,… đều bằng 0.
VD3. Tổng số oxi hóa của các nguyên tử trong phân tử NH3 là: .
VD4. Số oxi hóa của nguyên tử Na, Cl trong Na+, Cl- lần lượt bằng ; số oxi hóa của nguyên tử C và O trong lần lượt bằng và .
VD5. Tính số oxi hóa của S trong các hợp chất ion sau: .
|
Đặt x là số oxi hóa của S.
|
Trong : → Kí hiệu
Trong : → Kí hiệu
|
|
Trong : → Kí hiệu
Trong : → Kí hiệu
CH3. Nêu điểm khác nhau giữa kì hiệu số oxi hóa và kí hiệu điện tích của ion M trong hình sau:
Hình ảnh (5.CH3)
CH4. Dự đoán số oxi hóa của các nguyên tử trong nhóm IA, IIA, IIIA trong các hợp chất. Giải thích.
à Kết luận
Xác định số oxi hóa | Số oxi hóa |
Đơn chất | |
Phân tử | Tổng số oxi hóa bằng |
Ion đơn nguyên tử | Điện tích của ion |
Ion đa nguyên tử | Tổng số oxi hóa các nguyên tử bằng điện tích của ion |
Ion fluoride | |
Oxygen trong hợp chất (trừ OF2 và các peroxide, superoxide) | |
Hydrogen trong hợp chất (trừ các hydride) |
Luyện tập. Hãy xác định số oxi hóa của các nguyên tử trong các đơn chất, hợp chất và ion sau: .
Vận dụng. Xác định số oxi hóa dựa vào công thức cấu tạo: Tính điện tích các nguyên tử trong hợp chất với giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn.
Ví dụ: Methane có công thức cấu tạo là:
Hình ảnh (6.Vận dụng)
Trong các liên kết , mỗi nguyên tử góp chung 1 electron. Khi giả định cặp electron chung thuộc hẳn về nguyên tử , vì có 4 liên kết nên số oxi hóa của là , của là .
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 10 chân trời sáng tạo
