Giáo án điện tử hóa học 10 chân trời bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài giảng điện tử hóa học 10 chân trời. Giáo án powerpoint bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 10 chân trời sáng tạo (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét










Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 10 chân trời sáng tạo
CHỦ ĐỂ 6: TỐC ĐỘ PHẢN ỨNG HOÁ HỌC
BÀI 15: PHƯƠNG TRÌNH TỐC ĐỘ PHẢN ỨNG VÀ HẰNG SỐ TỐC ĐỘ PHẢN ỨNG
- KHỞI ĐỘNG
Trong tự nhiên có những phản ứng xảy ra rất nhanh, như phản ứng nổ của pháo hoa, phản ứng cháy của que diêm,… nhưng cũng có những phản ứng xảy ra chậm hơn, như quá trình oxi hóa các kim loại sắt, đồng trong khí quyển, sự ăn mòn vỏ tàu biển làm bằng thép,…
HÌNH ẢNH PHÁO HOA NỔ
HÌNH ẢNH ĂN MÒN TÀU BIỂN LÀM BẰNG THÉP
Để đánh giá mức độ nhanh hay chậm của một phản ứng hóa học cần dùng đại lượng nào? Cách tính ra sao?
- NỘI DUNG BÀI HỌC
- Tốc độ phản ứng
- Biểu thức tốc độ phản ứng
III. PHẦN TRIỂN KHAI KIẾN THỨC
- Tốc độ phản ứng
Thảo luận nhóm: Trả lời các câu hỏi dưới đây:
Câu 1: Quan sát hình ảnh trong phần khởi động, nhận xét về mức độ nhanh chậm của phản ứng hóa học xảy ra trong đám cháy lá cây khô và thân tàu biển bị oxi hóa trong điều kiện tự nhiên.
Câu 2: Trong tự nhiên và cuộc sống, ở cùng điều kiện, nhiều chất khác nhau sẽ biến đôi hóa học nhanh, chậm khác nhau; với cùng một chất, trong điều kiện khác nhau cũng biến đổi hóa học nhanh chậm khác nhau. Hãy tìm các ví dụ minh họa cho 2 nhận định trên.
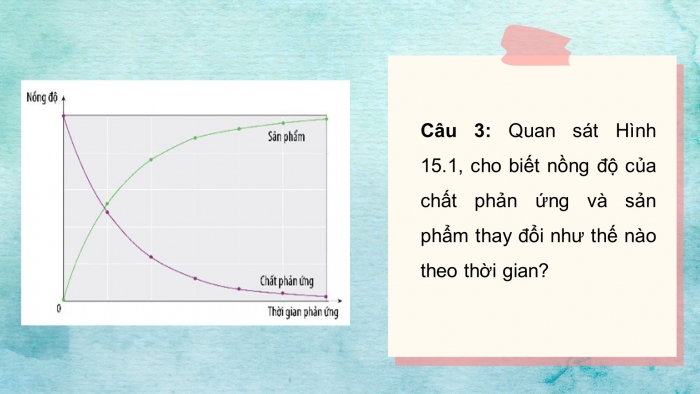
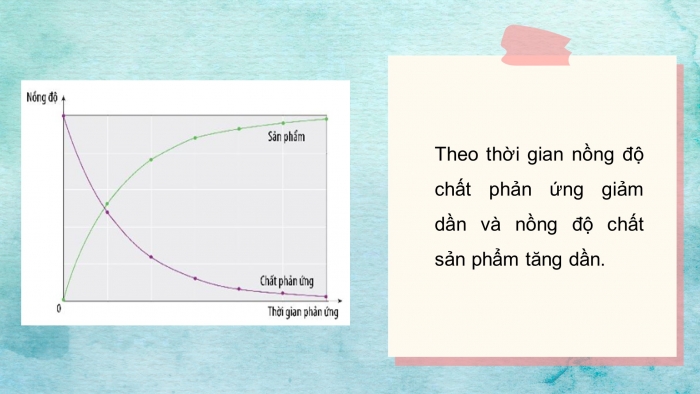
Câu 3: Quan sát Hình 15.1, cho biết nồng độ của chất phản ứng và sản phẩm thay đổi như thế nào the thời gian?
HÌNH 15.1
Đáp án
Câu 1:
- Trong đám cháy của lá cây khô: Phản ứng hóa học xảy ra nhanh. Các lá cây nhanh chóng bị cháy và chuyển thành tro
- Thân tàu biển bị oxi hóa trong điều kiện tự nhiên: Phản ứng hóa học xảy ra chậm. Vỏ tàu biển làm bằng thép mất thời gian rất lâu mới bị gỉ (bị oxi hóa)
Câu 2:
+ Ở cùng điều kiện, nhiều chất hóa học biến đổi nhanh chậm khác nhau: Đốt cháy 1 chiếc lá và đốt cháy 1 miếng sắt.
+ Với cùng một chất, trong các điều kiện khác nhau, biến đổi hóa học nhanh chậm khác nhau: 2 miếng sắt như nhau, ngâm vào nước và ngâm vào dung dịch acid.
Câu 3: Theo thời gian, nồng độ chất tham gia phản ứng ( đường màu tím)
Em hãy rút ra kết luận về khái niệm tốc độ phản ứng hoá học
Kết luận:
+ Tốc độ phản ứng hóa học dùng để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng.
+ Tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trung cho sự biến thiên sản phẩm phản ứng trong một đơn vị thời gian.
- Công thức cho phản ứng tổng quát
aA+ bB → cC+dD
= =
Trong đó:
: tốc độ trung bình của phản ứng
+ ∆C = C2 – C1: Biến thiên nồng độ
+ ∆t = t2 – t1: Biến thiên thời gian.
C1,C2 là nồng độ cỏa một chất tại 2 thời điểm tương ứng t1,t2
Hoạt động nhóm: Trả lời câu Luyện tập trang 95:
Xét phản ứng phân hủy N2O5 ở 45oC
N2O5(g) → N2O4(g) + O2(g)
Sau 184 giây đầu tiên, nồng độ của N2O4 là 0,25M. Tính tốc độ trung bình của phản ứng theo N2O4 trong khoảng thời gian trên
Đáp án:
= = 1,36.10-3 (M/s)
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 10 chân trời sáng tạo
