Giáo án điện tử hóa học 10 chân trời bài 13: Enthalpy tạo thành và sự biến thiên enthalpy của phản ứng hóa học (4 tiết)
Bài giảng điện tử hóa học 10 chân trời. Giáo án powerpoint bài 13: Enthalpy tạo thành và sự biến thiên enthalpy của phản ứng hóa học (4 tiết). Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 10 chân trời sáng tạo (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét











Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 10 chân trời sáng tạo
CHƯƠNG 5: NĂNG LƯỢNG HÓA HỌC
BÀI 13. ENTHALPY TẠO THÀNH VÀ SỰ BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG HÓA HỌC (4 tiết)
- KHỞI ĐỘNG
Câu hỏi: Viên pháo hoa được bắn lên, thuốc súng phát nổ trong không khí, tạo ra âm thanh và một lượng nhiệt rất lớn. Lượng nhiệt này đốt cháy muối kim loại trong viên pháo hoa tạo ra ánh sáng đa sắc màu.
Hình ảnh (1.Khởi động; 2.Khởi động)
Trong cuộc sống, có rất nhiều phản ứng xảy ra với sự thay đổi năng lượng như ví dụ trên. Theo em, phản ứng có kèm theo sự thay đổi năng lượng dưới dạng nhiệt năng có vai trò gì trong đời sống?
Đáp án: Có rất nhiều phản ứng kèm theo sự thay đổi năng lượng dưới dạng nhiệt năng có vai trò quan trọng trong đời sống.
Ví dụ:
- Các loại nhiên liệu cung cấp năng lượng cho con người: than, củi, xăng, dầu,..
- Gói làm lạnh khẩn cấp (cool park). Khi dùng cần bóp thật chặt, tinh thể NH4Cl nhào trộn với nước. Gói làm lạnh nhanh, giúp giảm đau, hộ trợ chấn thương hiệu quả,
- …
- NỘI DUNG BÀI HỌC
- Phản ứng tỏa nhiệt
- Phản ứng thu nhiệt
- Biến thiên enthalpy chuẩn của phản ứng
- Enthalpy tạo thành (nhiệt tạo thành)
- Ý nghĩa của dấu và giá trị
III. PHẦN TRIỂN KHAI KIẾN THỨC
- Phản ứng tỏa nhiệt
- Tìm hiểu phản ứng tỏa nhiệt
Em hãy quan sát videp hàn tàu và và trả lời câu hỏi 1 SGK tr.80.
CH1. Viết phương trình hóa học của phản ứng xảy ra ở hìn 13.1 và nêu nhận xét về sự thay đổi nhiệt của phản ứng đó.
Hình ảnh (3.Hình 13.1)
https://www.youtube.com/watch?v=E6UDKulryZ8
Trả lời
Phản ứng cháy mãnh liệt và tỏa nhiệt rất cao, tăng nhiệt độ của phản ứng làm nóng chảy kim loại.
Hoạt động nhóm 4: Sử dụng dụng cụ và hóa chất cần thiết, em hãy tiến hành thí nghiệm sau.
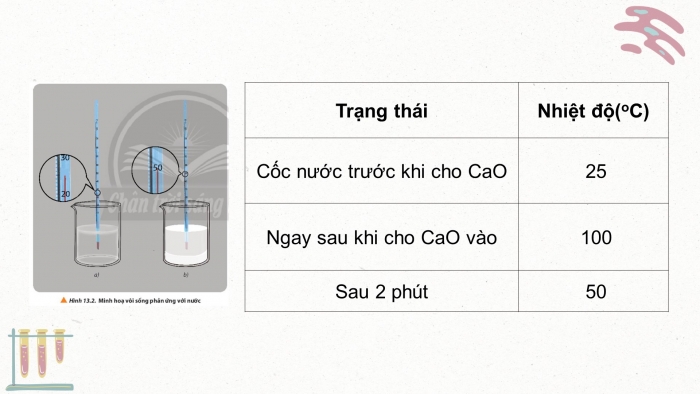
Thí nghiệm 1: Sự thay đổi nhiệt độ khi vôi sống phản ứng với nước
Dụng cụ và thiết bị: Cốc chịu nhiệt 50 ml, cân, nhiệt kế, đũa thủy tinh, giá đỡ nhiệt kế.
Hóa chất: Vôi sống (CaO), nước cất.
Tiến hành:
Bước 1: Cho khoảng 25 ml nước cất vào cốc chịu nhiệt, đặt bầu nhiệt kế vào trong long chất lỏng (hình 13.2a), ghi nhận giá trị nhiệt độ.
Bước 2: Cân khoảng 5g CaO. Cho nhanh CaO vào cốc, bắt đầu bấm giờ và ghi nhân nhiệt độ, đồng thời dùng đũa thủy tinh khuấy nhẹ (hình 13.2b).
Hình ảnh (4.Hình 13.2)
Bước 3: Ghi nhận giá trị nhiệt độ sau 2 phút.
CH2. Thực hiện thí nghiệm 1. Nêu hiện tượng xảy ra. Rút ra kết luận về sự thay đổi nhiệt độ chất lỏng trong cốc. Giải thích.
Bảng quan sát
| Nhiệt độ (oC) |
Cốc nước trước khi cho CaO |
|
Ngay sau khi cho CaO vào |
|
Sau 2 phút |
|
Trả lời
Hiện tượng xảy ra: CaO tác dụng với nước, tan một phân và phản ứng tỏa nhiệt.
PTHH:
Ghi nhận sự thay đổi nhiệt độ theo thời gian phản ứng:
| Nhiệt độ (oC) |
Cốc nước trước khi cho CaO | 25 |
Ngay sau khi cho CaO vào | … |
Sau 2 phút | … |
Kết luận: Phản ứng xảy ra có sự tăng về nhiệt độ.
Giải thích: Phản ứng tỏa nhiệt, tạo hỗn hợp màu trắng. CaO tan dần trong nước.
à Kết luận: Phản ứng tỏa nhiệt là phản ứng trong đó có sự giải phóng nhiệt năng ra môi trường.
Luyện tập. Hãy nêu hiện tượng của các quá trình: đốt cháy than, ethanol trong không khí. Nhiệt độ môi trường xung quanh thay đổi như thế nào?
Trả lời
- Hiện tượng: 2 quá trình đều xuất hiện khí bay ra.
- Phương trình hóa học:
+ Đốt cháy than:
+ Đốt cháy ethanol:
- 2 quá trình đều làm nhiệt độ môi trường xung quanh tăng lên.
- Phản ứng thu nhiệt
- Tìm hiểu phản ứng thu nhiệt
Hoạt động cặp đôi: Em hãy quan sát hình 13.3 và trả lời câu hỏi:
Hình ảnh (5.Hình 13.3)
CH3. Khi thả viên vitamin C sủi vào cốc nước như hình 13.3, em hãy dự đoán sự thay đổi nhiệt độ của nước trong cốc.
CH4. Trong phản ứng nung đá vôi (CaCO3), nếu ngừng cung cấp nhiệt, phản ứng có tiếp tục xảy ra không?
Trả lời
CH3. Hiện tương sủi bọt, viên thuốc tan dần. Viên sủi có muối carbonate và acid hữu cơ → tiếp xúc nước → 2 thành phần trên tiếp xúc nhau → lượng lớn CO2 → viên sủi tan nhanh, giảm nhiệt độ xung quanh cốc nước
CH4. Phản ứng phân hủy đá vôi (CaCO3) cần phải cung cấp năng lượng liên tục. Nếu ngừng cung cấp nhiệt, phản ứng không thể tiếp tục xảy ra.
Hoạt động nhóm 4: Em hãy sử dụng dụng cụ và hóa chất thích hợp để tiến hành thí nghiệm sau.
Thí nghiệm 2: Nhiệt phân potassium chlorate.
Dụng cụ và thiết bị: Đèn cồn, ống nghiệm chịu nhiệt, nút cao su có gắn ống dẫn khí, chậu thuỷ tỉnh, bình tam giác, giá sắt.
Hoá chất: Potassium chlorate (KC]O,), manganese dioxide (MnO2).
Tiến hành:
Bước 1: Trộn đều khoảng 4 g tỉnh thể KCIO, đã được nghiền nhỏ với 1 g MnO2. Cho hỗn hợp vào ống nghiệm chịu nhiệt, khô. Đậy ống nghiệm bằng nút có gắn ống dẫn khí. Lắp hệ thống như Hình 13.4. Quan sát hiện tượng.
Bước 2: Dùng đèn cồn hơ nóng đều nửa đáy ống nghiệm, sau đó đun tập trung ở phần có chứa hoá chất. Quan sát hiện tượng.
Hình ảnh (6.Hình 13.4)
Chú ý: Trước khi ngừng đun phải đưa ống dẫn khí ra khỏi chậu nước rồi mới tắt đèn cồn.
CH5. Thực hiện thí nghiệm 2. Nêu hiện tượng tượng trước và sau khi đốt nóng hỗn hợp. Nếu ngừng đốt nóng thì phản ứng có xảy ra không?
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 10 chân trời sáng tạo
