Giáo án và PPT Hoá học 10 cánh diều Bài 5: Lớp, phân lớp và cấu hình electron
Đồng bộ giáo án word và powerpoint (ppt) Bài 5: Lớp, phân lớp và cấu hình electron. Thuộc chương trình Hoá học 10 cánh diều. Giáo án được biên soạn chỉnh chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word










Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 10 cánh diều
BÀI 5. LỚP, PHÂN LỚP VÀ CẤU HÌNH ELECTRON
HOẠT ĐỘNG KHỞI ĐỘNG
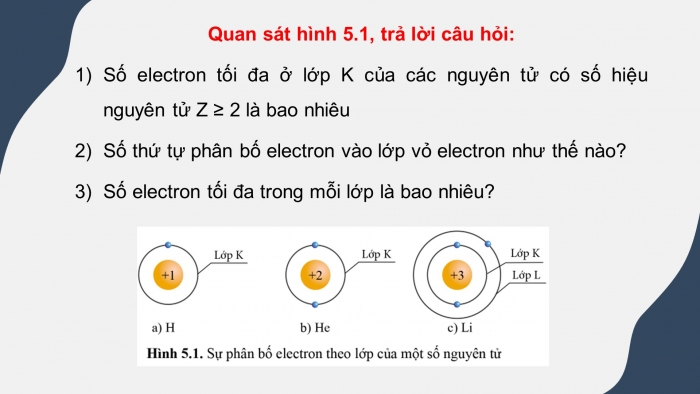
GV sử dụng hình 5.1 sgk trang 26, yêu cầu HS quan sát và trả lời câu hỏi:
Số electron tối đa ở lớp K của các nguyên tử có số hiệu nguyên tử Z ≥ 2 là bao nhiêu
Số thứ tự phân bố electron vào lớp vỏ electron như thế nào?
Số electron tối đa trong mỗi lớp là bao nhiêu?
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
I. LỚP VÀ PHÂN LỚP ELECTRON
Hoạt động 1. Lớp electron
GV yêu cầu HS hoạt động nhóm 4 trả lời câu hỏi:
Các electron trong lớp vỏ nguyên tử được phân bố dựa vào các lớp và phân lớp theo yếu tố nào?
Nhận xét về mức năng lượng của các electron trên mỗi lớp.
Dựa vào bảng 5.1 sgk, nhận xét về mối quan hệ giữa số lượng AO và số electron tối đa trên mỗi lớp. Rút ra quy tắc xác định số electron và số AO trong lớp electron thứ n (n ≤ 4).
Câu hỏi 1 sgk trang 26: Vì sao số AO trong một lớp luôn bằng một nửa số electron tối đa thuộc lớp đó.
Sản phẩm dự kiến:
(1) Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo yêu tố năng lượng của chúng.
(2) Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
(3)
Lớp K n=1 có 1 AO với số electron tối đa là 2
Lớp L n=2 có 4 AO với số electron tối đa là 8
Lớp M n=3 có 9 AO với số electron tối đa là 9
Lớp N có n=4 có 32 AO với số electron tối đa là 32
=> Nhận xét: Lớp AO thứ n có n2 AO
Lớp thứ n có tối đa 2n2AO
(4) Trả lời câu hỏi 1 sgk trang 26: Vì mỗi AO có tối đa 2 electron nên số AO luôn bằng 1 nửa số electron tối đa thuộc lớp đó.
(5) Trả lời câu luyện tập 1 sgk trang 27:
Số hiệu nguyên tử (Z) = số electron ⇒ Nitrogen có 7 electron được phân bố vào 2 lớp:
+ Lớp thứ nhất chứa 2 electron, phân bố vào 1 AO.
+ Lớp thứ hai chứa 5 electron, phân bố vào 4 AO.
Như vậy lớp ngoài cùng của nitrogen chứa 5 electron, phân bố vào 4 AO.
Hoạt động 2. Phân lớp electron
GV yêu cầu học sinh chia nhóm hoạt động trả lời câu hỏi:
Mỗi lớp electron được chia thành các phân lớp theo nguyên tắc nào?
Hãy nêu số lượng và kí hiệu các phân lớp trong một phân lớp.
Hãy nêu số lượng AO trong mỗi phân lớp s, p, d, f.
Cho ví dụ: Kí hiệu 1s2 cho biết phân lớp 1s có 2 electron. Do phân lớp 1s chỉ có 1 Ao nên phân lớp này chứa tối đa 2 electron, 1s2 được gọi là phân lớp bão hòa. Từ ví dụ này em hãy rút ra cách biểu diễn số electron tối đa trong mỗi phân lớp.
Hãy biểu diễn số electron tối đa cho các phân lớp sau: 3p, 4s, 5d, 6f.
Sản phẩm dự kiến:
(6) Mỗi lớp electron (trừ lớp thứ nhất) được chia thành các phân lớp theo nguyên tắc: Các electron thuộc cùng một phân lớp có năng lượng bằng nhau.
- Trả lời câu hỏi 2 sgk trang 27: Các ô (1), (2), (3), (4) trong hình liên hệ với số phân lớp electron trong một lớp electron.
Lớp K, n =1 có 1 phân lớp,
Lớp L, n = 2 có 2 phân lớp,
Lớp M, n = 3 có 3 phân lớp,
Lớp N, n = 4 có 4 phân lớp.
(7) Lớp electron thứ n có n phân lớp và được kí hiệu lần lượt là ns, np, nd, nf,... Cụ thể:
Lớp K, n= 1: có 1 phân lớp, được kí hiệu là 1s.
Lớp L, n=2: có 2 phân lớp được kí hiệu là 2s và 2p.
Lớp M, n=3: có 3 phân lớp, được kí hiệu là 3s, 3p, 3d.
- Trả lời câu hỏi 3 sgk trang 27:
Lớp electron thứ tư (n = 4) có 4 phân lớp. Kí hiệu là 4s, 4p, 4d và 4f.
(8) Số lượng AO trong mỗi phân lớp:
Phân lớp ns chỉ có 1 AO
Phân lớp np có 3 AO
Phân lớp nd có 5 AO
Phân lớp nf có 7 AO.
- Trả lời câu hỏi 4 sgk trang 27: Vì mỗi AO chứa 2 electron nên ta có:
Phân lớp | ns | np | nd | nf |
Số AO | 1 | 3 | 5 | 7 |
Số electron bão hòa | 2 | 6 | 10 | 14 |
(9) Số electron trong mỗi phân lớp được biểu diễn bằng chỉ số phía trên, bên trái kí hiệu phân lớp. Phân lớp nào đã có tối đa electron thì được gọi là phân lớp bão hòa.
(10) 3p6, 4s2, 5d10, 6f14.
II. CẤU HÌNH ELECTRON NGUYÊN TỬ.
Hoạt động 1. Cách viết cấu hình electron nguyên tử
GV đưa ra câu hỏi: Nêu cách viết và thứ tự viết cấu hình electron nguyên tử.
Sản phẩm dự kiến:
(1) Trả lời luyện tập 2 sgk trang 28:
Cấu hình electron của các nguyên tố có số hiệu nguyên tử từ 1 đến 20:
Số hiệu nguyên tử | Cấu hình electron |
1 | 1s1 |
2 | 1s2 |
3 | 1s22s1 |
4 | 1s22s2 |
5 | 1s22s22p1 |
6 | 1s22s22p2 |
7 | 1s22s22p3 |
8 | 1s22s22p4 |
9 | 1s22s22p5 |
10 | 1s22s22p6 |
11 | 1s22s22p63s1 |
12 | 1s22s22p63s2 |
13 | 1s22s22p63s23p1 |
14 | 1s22s22p63s23p2 |
15 | 1s22s22p63s23p3 |
16 | 1s22s22p63s23p4 |
17 | 1s22s22p63s23p5 |
18 | 1s22s22p63s23p6 |
19 | 1s22s22p63s23p64s1 |
20 | 1s22s22p63s23p64s2 |
(2) Cấu hình electron cho biết thứ tự mức năng lượng các electron giữa các phân lớp. Năng lượng của electron trong mỗi phân lớp tăng theo chiều từ trái qua phải.
Ví dụ: Trong nguyên tử Li, năng lượng của electron thuộc phân lớp 2s cao hơn electron thuộc phân lớp 1s.
Hoạt động 2. Biểu diễn cấu hình electron theo ô orbital.
GV đặt câu hỏi yêu cầu học sinh suy nghĩ trả lời: Vì sao hai electron trong cùng một AO sẽ đẩy nhau?
Sản phẩm dự kiến:
(3) Electron mang điện tích âm nên hai electron trong cùng một AO sẽ đẩy nhau, vì vật chúng có xu hướng tách nhau ra chiếm hai AO khác nhau.
(4) Trả lời câu luyện tập 3 sgk trang 29:
Biểu diễn cấu hình electron theo ô orbital ( chỉ lớp ngoài cùng) các nguyên tử có Z từ 1 đến 20. Xác định số electron độc thân của mỗi nguyên tử.
Số hiệu nguyên tử | Orbital lớp ngoài cùng | Số electron độc thân | |||||
1 |
1s1 | 1 | |||||
2 |
1s2 | 0 | |||||
3 |
2s1 | 1 | |||||
4 |
2s2 | 0 | |||||
5 |
2s2 2p1 | 1 | |||||
6 |
2s2 2p2 | 2 | |||||
7 |
2s2 2p3 | 3 | |||||
8 |
2s2 2p4 | 2 | |||||
9 |
2s2 2p5 | 1 | |||||
10 |
2s2 2p6 | 0 | |||||
11 |
3s1 | 1 | |||||
12 |
3s2 | 0 | |||||
13 |
3s2 3p1 | 1 | |||||
14 |
3s2 3p2 | 2 | |||||
15 |
3s2 3p3 | 3 | |||||
16 |
3s2 3p4 | 2 | |||||
17 |
3s2 3p5 | 1 | |||||
18 |
3s2 3p6 | 0 | |||||
19 |
4s1 | 1 | |||||
20 |
4s2 | 0 |
…..
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 7 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là?
A. 7.
B. 9
C. 15
D. 17.
Câu 2: Cấu hình electron nguyên tử ở trạng thái cơ bản nào là đúng cho nguyên tử có số hiệu nguyên tử là 16?
A. 1s2 2s2 2p6 3s2 3p3 4s1
B. 1s2 2s2 2p6 3s2 3p4.
C. 1s2 2s2 2p6 3s1.
D. 1s2 2s2 2p2 3p2 4p2 5p1.
Câu 3: Cấu hình nào sau đây vi phạm nguyên lí Pauli?
A. 1s22s22p3.
B. 1s22s22p4.
C. 1s22s22p63s3.
D. 1s2.
Câu 4: Nguyên tử của nguyên tố X có sự sắp xếp electron trên các orbital của nguyên tử như hình dưới đây. X là nguyên tố nào?
A. Carbon (Z = 6).
B. Nitrogen (Z = 7).
C. Oxygen (Z = 8).
Sản phẩm dự kiến:
Câu 1: D
Câu 2: B
Câu 3: C
Câu 4: C
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Các electron của nguyên tố X được phân bố trên 2 lớp, lớp thứ 2 có 7 electron. Số hiệu nguyên tử của nguyên tố X là bao nhiêu?
Câu 2: Nguyên tử của nguyên tố hoá học A (Z = 20). Viết cấu hình electron ở lớp ngoài cùng.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Hệ thống có đầy đủ các tài liệu:
- Giáo án word (300k)
- Giáo án Powerpoint (350k)
- Trắc nghiệm theo cấu trúc mới (150k)
- Đề thi cấu trúc mới: ma trận, đáp án, thang điểm..(200k)
- Phiếu trắc nghiệm câu trả lời ngắn (150k)
- Trắc nghiệm đúng sai (150k)
- Lý thuyết bài học và kiến thức trọng tâm (150k)
- File word giải bài tập sgk (150k)
- Phiếu bài tập để học sinh luyện kiến thức (150k)
- .....
Nâng cấp lên VIP đê tải tất cả ở tài liệu trên
- Phí nâng cấp VIP: 1050k
=> Chỉ gửi 500k. Tải về dùng thực tế. Nếu hài lòng, 1 ngày sau mới gửi phí còn lại
Cách tải hoặc nâng cấp:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB(QR)
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 10 cánh diều
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 KẾT NỐI TRI THỨC
Soạn giáo án Hoá học 10 kết nối tri thức theo công văn mới nhất
Giáo án điện tử hoá học 10 kết nối tri thức
Giáo án chuyên đề Hóa học 10 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 kết nối tri thức
Trò chơi khởi động Hoá học 10 kết nối tri thức
Trắc nghiệm Hóa học 10 kết nối tri thức
Đề thi hóa học 10 kết nối tri thức
File word đáp án hóa học 10 kết nối tri thức
Bài tập file word Hóa học 10 kết nối tri thức
Kiến thức trọng tâm hóa học 10 kết nối tri thức
Câu hỏi tự luận Hóa học 10 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 10 kết nối tri thức
Phiếu học tập theo bài Hoá học 10 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 10 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 CHÂN TRỜI SÁNG TẠO
Soạn giáo án Hoá học 10 chân trời sáng tạo theo công văn mới nhất
Giáo án điện tử hoá học 10 chân trời sáng tạo
Giáo án chuyên đề Hóa học 10 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 chân trời sáng tạo
Trò chơi khởi động Hoá học 10 chân trời sáng tạo
Trắc nghiệm hoá học 10 chân trời sáng tạo
Đề thi hóa học 10 chân trời sáng tạo
File word đáp án hóa học 10 chân trời sáng tạo
Bài tập file word Hóa học 10 chân trời sáng tạo
Kiến thức trọng tâm hóa học 10 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 10 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 10 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 10 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 CÁNH DIỀU
Soạn giáo án Hoá học 10 cánh diều theo công văn mới nhất
Giáo án điện tử hoá học 10 cánh diều
Giáo án chuyên đề Hóa học 10 cánh diều đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 cánh diều
Trò chơi khởi động Hoá học 10 cánh diều
Trắc nghiệm hoá học 10 cánh diều
Đề thi hóa học 10 cánh diều
File word đáp án hóa học 10 cánh diều
Bài tập file word Hóa học 10 cánh diều
Kiến thức trọng tâm hóa học 10 cánh diều
Đề kiểm tra 15 phút Hoá học 10 cánh diều
Phiếu học tập theo bài Hoá học 10 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 10 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 cánh diều cả năm
