Giáo án và PPT Hoá học 10 cánh diều Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hoá học
Đồng bộ giáo án word và powerpoint (ppt) Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hoá học. Thuộc chương trình Hoá học 10 cánh diều. Giáo án được biên soạn chỉnh chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word









Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 10 cánh diều
BÀI 15. Ý NGHĨA VÀ CÁCH TÍNH BIẾN THIÊN ENTHALPY PHẢN ỨNG HOÁ HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
Cho hai phản ứng đốt cháy:
- C(s) + O2(g) → CO2 (g) ∆rH0298 = -393,5 kJ
- 2Al (s) +
 O2 (g) → Al2O3(s) ∆rH0298= -1675,7 kJ
O2 (g) → Al2O3(s) ∆rH0298= -1675,7 kJ
Ở điều kiện chuẩn, cùng với một khối lượng C và Al, chất nào khi cháy tỏa ra nhiều nhiệt hơn?
B.HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu về lớp và phân lớp electron
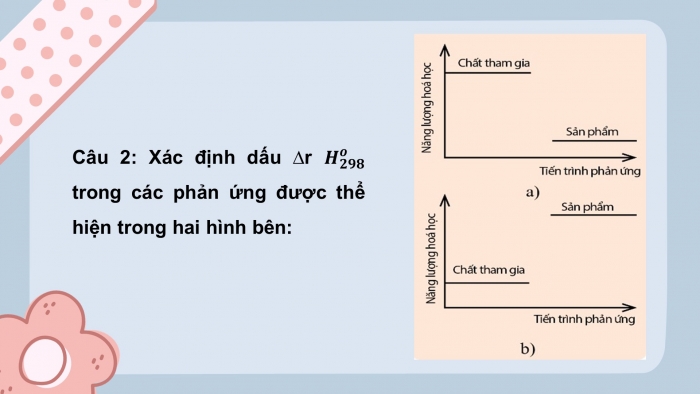
- Trình bày ý nghĩa về dấu và giá trị của biến thiên enthalpy phản ứng?
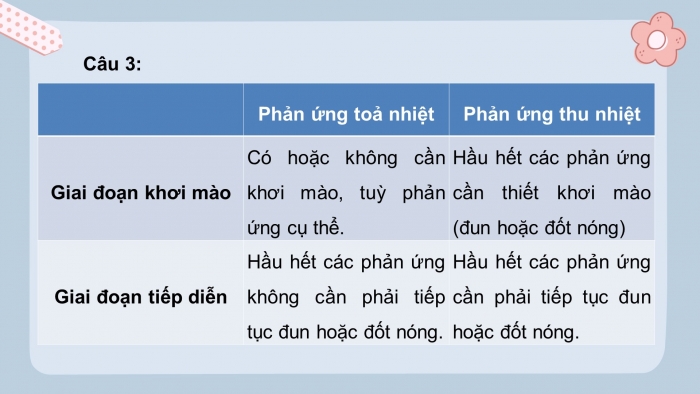
- So sánh phản ứng tỏa nhiệt và phản ứng thu nhiệt?
Sản phẩm dự kiến:
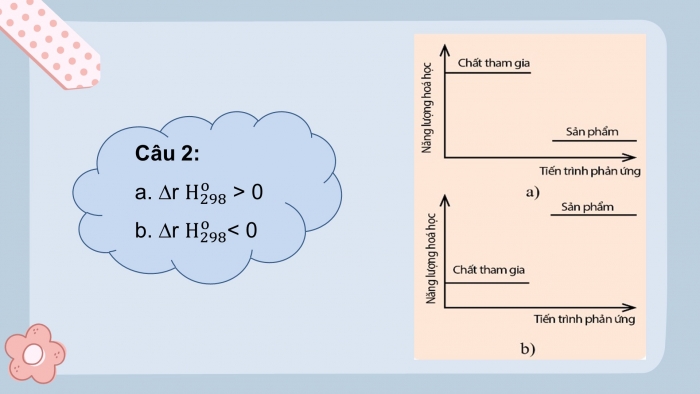
- Ý nghĩa:
+ Biến thiên enthalpy chuẩn của phản ứng, có giá trị âm![]() rHo298 < 0. Giá trị càng âm, phản ứng toả ra càng nhiều nhiệt
rHo298 < 0. Giá trị càng âm, phản ứng toả ra càng nhiều nhiệt
+ Biến thiên enthalpy chuẩn của phản ứng, có giá trị dương![]() rHo298 > 0. Giá trị càng dương, phản ứng thu vào càng nhiều nhiệt
rHo298 > 0. Giá trị càng dương, phản ứng thu vào càng nhiều nhiệt
- So sánh:
| Phản ứng toả nhiệt | Phản ứng thu nhiệt | |
| Giai đoạn khơi mào | Có thể có ,có thể không cần khơi mào tuỳ phản ứng cụ thể | Hầu hết các phản ứng cần thiết khơi mào( đun hoặc đốt nóng |
| Giai đoạn tiếp diễn | Hầu hết các phản ứng không cần phải tiếp tục đun hoặc đốt nóng | Hầu hết các phản ứng cần phải tiếp tục đun hoặc đốt nóng |
Hoạt động 2: Tìm hiểu về cách tính biến thiên enthalpy phản ứng
- Biên thiên enthalpy chuẩn của phản ứng được tính như thế nào?
- Việc xác định biến thiên enthalpy có mục đích gì?
Sản phẩm dự kiến:
- Công thức tính:
Giả sử có phản ứng tổng quát:
aA + bB → mM + nN
Biên thiên enthalpy chuẩn của phản ứng này tính được theo công thức
∆rHo298= m.∆fHo298(M) + n.∆fHo298(N)
– a.∆fHo298 (A) – b.∆fHo298(B)
- Mục đích: Xác định biến thiên enthalpy để xác định được phản ứng hoá học đó xảy ra thuận lợi hay không thuận lợi , ứng dụng của phản ứng trong đời sống.
C. HOẠT ĐỘNG LUYỆN TẬP
GV yêu cầu HS thực hiện bài tập trắc nghiệm.
Câu 1: Hydrogen phản ứng với chlorine để tạo thành hydrogen chloride theo phương trình
![]() (g) +
(g) + ![]() (g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng có giá trị là
(g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng có giá trị là
(Biết năng lượng liên kết E(H-H) = 436 kJ/mol, E(Cl-Cl) = 243 kJ/mol, E(H-Cl) = 432kJ/mol).
A. + 185kJ/mol.
B. −185 kJ/mol.
C. −92,5 kJ/mol.
D. + 92,5kJ/mol.
Câu 2: Propane (![]() ) là một hydrocarbon phổ biến thường được dùng làm nhiên liệu do quá trình cháy giải phóng lượng nhiệt lớn. Khi đốt cháy 1 mol propane thì giải phóng −2219,2 kJ nhiệt lượng. Nhiệt tạo thành chuẩn của propane là (biết nhiệt tạo thành chuẩn của
) là một hydrocarbon phổ biến thường được dùng làm nhiên liệu do quá trình cháy giải phóng lượng nhiệt lớn. Khi đốt cháy 1 mol propane thì giải phóng −2219,2 kJ nhiệt lượng. Nhiệt tạo thành chuẩn của propane là (biết nhiệt tạo thành chuẩn của ![]() O (l) = −285,8 kJ/ mol;
O (l) = −285,8 kJ/ mol; ![]() (g) = −393,5 kJ/mol).
(g) = −393,5 kJ/mol).
A. +212,2 kJ.
B. +1539,9 kJ.
C. -104,5 kJ.
D. –1539,9 kJ.
Câu 3: Hydrogen bromide bị phân hủy tạo thành hydrogen và bromine theo phương trình
2HBr(g) → ![]() (g) +
(g) + ![]() (g). Năng lượng liên kết của các liên kết được cho trong bảng sau. Biến thiên entahlpy của phản ứng là
(g). Năng lượng liên kết của các liên kết được cho trong bảng sau. Biến thiên entahlpy của phản ứng là
Loại liên kết | Năng lượng liên kết (kJ/mol) |
Br-Br | +193 |
H-Br | +366 |
H-H | +436 |
A. +263 kJ/mol.
B. +103 kJ/mol.
C. -263 kJ/mol.
D. -103 kJ/mol.
Câu 4: Khi đốt cháy glucose (![]() ) thấy giải phóng -2816 kJ/mol nhiệt lượng ở 25oC. Enthalpy tạo thành chuẩn của
) thấy giải phóng -2816 kJ/mol nhiệt lượng ở 25oC. Enthalpy tạo thành chuẩn của ![]() nhận giá trị là (biết enthalpy tạo thành chuẩn của C
nhận giá trị là (biết enthalpy tạo thành chuẩn của C![]() (g) và
(g) và ![]() O(l) lần lượt là -393,5 kJ/mol và - 285,9 kJ/mol).
O(l) lần lượt là -393,5 kJ/mol và - 285,9 kJ/mol).
A. +1260,4 kJ.
B. -2136,6 kJ.
C. -1260,4 kJ.
D. +2136,6 kJ.
Câu 6: Tiến hành đốt cháy 1 mol benzene ở điều kiện chuẩn, phản ứng sinh ra C![]() (g),
(g), ![]() O (l) đồng thời giải phóng 3267 kJ nhiệt lượng. Enthalpy tạo thành chuẩn của benzene nhận giá trị là(biết enthalpy tạo thành chuẩn của C
O (l) đồng thời giải phóng 3267 kJ nhiệt lượng. Enthalpy tạo thành chuẩn của benzene nhận giá trị là(biết enthalpy tạo thành chuẩn của C![]() (g) và
(g) và ![]() O (l) lần lượt là -393,5 kJ/mol; -285,83 kJ/mol).
O (l) lần lượt là -393,5 kJ/mol; -285,83 kJ/mol).
A. -48,51 kJ/mol.
B. +24,5 kJ/mol.
C. +48,51 kJ/mol.
D. -24,5 kJ/mol.
Gợi ý đáp án:
1 | 2 | 3 | 4 | 5 |
B | C | B | C | C |
D. HOẠT ĐỘNG VẬN DỤNG
GV yêu cầu HS hoạt động hoàn thành bài tập trong sgk.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 10 cánh diều
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 KẾT NỐI TRI THỨC
Giáo án Hoá học 10 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 10 kết nối tri thức
Giáo án chuyên đề Hóa học 10 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 kết nối tri thức
Trò chơi khởi động Hoá học 10 kết nối tri thức
Video AI khởi động Hoá học 10 kết nối tri thức hấp dẫn
Trắc nghiệm Hóa học 10 kết nối tri thức
Đề thi hóa học 10 kết nối tri thức
File word đáp án hóa học 10 kết nối tri thức
Bài tập file word Hóa học 10 kết nối tri thức
Kiến thức trọng tâm hóa học 10 kết nối tri thức
Câu hỏi tự luận Hóa học 10 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 10 kết nối tri thức
Phiếu học tập theo bài Hoá học 10 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 10 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 CHÂN TRỜI SÁNG TẠO
Giáo án Hoá học 10 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 10 chân trời sáng tạo
Giáo án chuyên đề Hóa học 10 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 chân trời sáng tạo
Trò chơi khởi động Hoá học 10 chân trời sáng tạo
Video AI khởi động Hoá học 10 chân trời sáng tạo hấp dẫn
Trắc nghiệm hoá học 10 chân trời sáng tạo
Đề thi hóa học 10 chân trời sáng tạo
File word đáp án hóa học 10 chân trời sáng tạo
Bài tập file word Hóa học 10 chân trời sáng tạo
Kiến thức trọng tâm hóa học 10 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 10 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 10 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 10 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 CÁNH DIỀU
Giáo án Hoá học 10 cánh diều đủ cả năm
Giáo án điện tử hoá học 10 cánh diều
Giáo án chuyên đề Hóa học 10 cánh diều đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 cánh diều
Trò chơi khởi động Hoá học 10 cánh diều
Video AI khởi động Hoá học 10 cánh diều hấp dẫn
Trắc nghiệm hoá học 10 cánh diều
Đề thi hóa học 10 cánh diều
File word đáp án hóa học 10 cánh diều
Bài tập file word Hóa học 10 cánh diều
Kiến thức trọng tâm hóa học 10 cánh diều
Đề kiểm tra 15 phút Hoá học 10 cánh diều
Phiếu học tập theo bài Hoá học 10 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 10 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 cánh diều cả năm
