Giáo án và PPT Hoá học 11 chân trời Bài 4: Ammonia và một số hợp chất ammonium
Đồng bộ giáo án word và powerpoint (ppt) Bài 4: Ammonia và một số hợp chất ammonium. Thuộc chương trình Hoá học 11 chân trời sáng tạo. Giáo án được biên soạn chỉnh chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét








Giáo án ppt đồng bộ với word










Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 chân trời sáng tạo
BÀI 4: AMMONIA VÀ MỘT SỐ HỢP CHẤT AMMONNIUM
HOẠT ĐỘNG KHỞI ĐỘNG
GV yêu cầu HS thảo luận và trả lời:
Yếu tố nào khi sử dụng không làm cho cân bằng của phản ứng giữa nitrogen và hydrogen chuyển dịch mà chỉ làm tăng tốc độ phản ứng?
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
Hoạt động 1: Cấu tạo phân tử Ammonia
HS thảo luận trả lời câu hỏi:
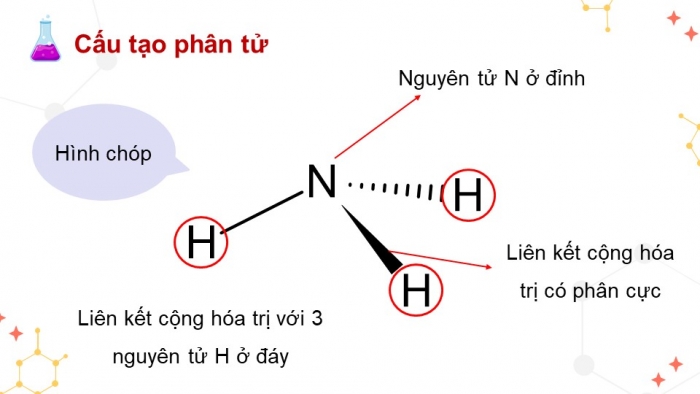
Quan sát hình 4.1, mô tả cấu tạo của phân tử Ammonia. Dự đoán tính tan (trong nước) và tính oxi hóa - khử của ammonia. Giải thích?

Sản phẩm dự kiến:
- Cấu tạo phân tử của NH3 là hình chóp với nguyên tử N ở đỉnh liên kết cộng hóa trị với 3 nguyên tử H ở đáy tam giác (3 liên kết N – H đều là liên kết cộng hóa trị có phân cực).
- Theo công thức Lewis, nguyên tử Nitrogen trong phân tử NH3 còn 1 cặp electron tự do chưa liên kết hoá học nên NH3 có khả năng hoạt động hoá học mạnh
- Phân tử NH3 phân cực mạnh và tạo được liên kết hydrogen với nước do đó có thể dự đoán NH3 dễ tan trong nước (dung môi phân cực)
Hoạt động 2: Tính chất của ammonia
Gv yêu cầu HS trao đổi theo nhóm:
- Quan sát hình 4.2 giải thích hiện tượng thí nghiệm từ đó cho biết tại sao không thu khí ammonia bằng phương pháp đẩy nước?

- Tính tỉ khối của NH3 so với không khí. Từ kết quả đó hãy giải thích vì sao có thể thu khí NH3 bằng phương pháp đẩy không khí (úp ngược bình)
- Từ sự kết hợp giữa NH3 và nước. nhận xét tính acid - base của NH3 trong dung dịch. Nêu cách nhận biết khí NH3 bằng quỳ tím. Giải thích
Sản phẩm dự kiến:
* Tìm hiểu tính chất vật lí của ammonia
- Hiện tượng: nước trong chậu phun vào bình thành những tia màu hồng.
=>Giải thích: Khí ammonia tan nhiều trong nước là giảm áp suất trong bình đột ngột, nước trong chậu bị hút vào bình qua ống thuỷ tinh vuốt nhọn kết hợp với phenolphtalein và phun thành các tia nước màu màu hồng.
- Tỉ khối của NH3 so với không khí:
dNH3/kk = ![]() < 1
< 1
Vậy NH3 nhẹ hơn không khí → có thể thu được bằng phương pháp đẩy không khí (úp ngược bình)
* Tìm hiểu tính chất hóa học của ammonia
- Theo thuyết Bronsted - Lowry, khi tác dụng với nước, NH3 đóng vai trò là base tạo ra ion OH−, làm cho dung dịch có tính base
- Có thể dùng giấy quỳ tím ẩm (nhúng nước) để nhận biết khí NH3. Nước trong quỳ tím ẩm sẽ hoà tan NH3 thành dung dịch NH3 có tính base, làm quỳ tím chuyển xanh.
Hoạt động 3: Tổng hợp Ammonia
HS thảo luận và trả lời câu hỏi:
- Dựa vào nguyên lí chuyển dịch cân bằng Le Chatelier, hãy cho biết để tăng hiệu suất tổng hợp NH3, cần điều chỉnh nhiệt độ và áp suất như thế nào. Điều đó có gây trở ngại gì cho phản ứng tổng hợp NH3 trên thực tế hay không? Vì sao?
- Phản ứng tổng hợp Ammonia từ nitrogen và hydrogen trong quá trình Haber diễn ra như thế nào? Điều kiện là gì?
Sản phẩm dự kiến:
- Theo nguyên lí chuyển dịch cân bằng Le Chatelier, để tăng hiệu suất quá trình tổng hợp NH3, cần phải hạ nhiệt độ và tăng áp suất.
- Tuy nhiên, trên thực tế nếu thực hiện các điều kiện trên sẽ gây trở ngại cho phản ứng tổng hợp NH3 vì khi nhiệt độ quá thấp thì phản ứng xảy ra rất chậm và khi áp suất quá cao thì đòi hỏi thiết bị cồng kềnh, phức tạp.
- Phản ứng tổng hợp Ammonia từ nitrogen và hydrogen trong quá trình Haber: N2 (g) + 3H2 (g) ⇄ 2NH3 (g)
Điều kiện:
+ Tỉ lệ mol N2 và H2 là 1: 3
+Nhiệt độ: 380oC - 450oC
+Áp suất ≈ 200 bar
+Xúc tác: Fe
Hoạt động 4: Muối ammonium
HS thảo luận và trả lời câu hỏi:
- Quan sát hình 4.5, cho biết trạng thái màu sắc của muối ammonium Chloride và đặc tính liên kết của phân tử.

- Muối ammonium (NH4+) là gì?
- Quan sát thí nghiệm, nêu hiện tượng xảy ra. Giải thích. Viết phương trình hóa học khi cho NH4Cl, NH4NO3, (NH4)2SO4 tác dụng với dung dịch NaOH.
- Đun nóng NH4Cl hình 4.6 thấy có hiện tượng khói trắng trong ống nghiệm. Giải thích.

Sản phẩm dự kiến:
* Tìm hiểu tính chất vật lí của muối ammonium
- Muối ammonium chloride dạng tinh thể, màu trắng, tan nhiều trong nước
+ Phân tử có liên kết ion giữa NH4+ và Cl-, trong đó ion NH4+ gồm 3 liên kết cộng hoá trị N - H và 1 liên kết cho nhận N → H

+Thực nghiệm cho thấy 4 liên kết này là đồng nhất (tính không phân biệt) nên có thể biểu diễn ion NH4+ như sau:

- Muối ammonium (NH4+) là những chất tinh thể ion.
* Tìm hiểu tính chất hóa học của ammonium
- Hiện tượng: khi đun nóng, sau một thời gian thấy có khí mùi khai thoát ra, đặt mẩu giấy quỳ tím ẩm lên miệng ống nghiệm thì quỳ tím chuyển màu xanh.
- Giải thích: Khí thoát ra là NH3. Khi gặp quỳ tím ẩm, NH3 kết hợp với nước tạo thành ion OH-, dung dịch này có tính base làm quỳ tím chuyển màu xanh.
Các PTHH:
NH4Cl + NaOH → NH3 ↑+ H2O + NaCl
NH4NO3 + NaOH → NaNO3 + NH3 ↑ + H2O
(NH4)2SO4 + 2NaOH → Na2SO4↑+ 2NH3 + 2H2O
- Khi đun nóng ống nghiệm chứa ammonium chloride (NH,Cl) trên ngọn lửa đèn cồn, NH4Cl bị phân huỷ tạo thành khí NH3 và HCl bay lên miệng ống nghiệm.
Hỗn hợp khí gặp nhiệt độ thấp hơn ở đầu ống nghiệm hoá hợp lại với nhau tạo tinh thể NH4Cl màu trắng bám lên thành ống, tạo nên hiện tượng “khói” trắng.
Hoạt động 5: Ứng dụng
HS thảo luận và trả lời câu hỏi:
- Tìm hiểu thông tin và nêu một số ứng dụng của ammonia trong đời sống và sản xuất.
- Muối ammonium chủ yếu được sử dụng làm gì?
Sản phẩm dự kiến:
* Tìm hiểu ứng dụng ammonia
- Trong công nghiệp:
+ Ammonia là chất được sử dụng trong các hệ thống làm lạnh.
+Ammonia cũng được sử dụng trong quy trình sản xuất hóa chất nitricacid.
+ Phân bón: Phần lớn ammonia được dùng trong sản xuất phân bón (phân đạm), rất cần thiết cho sự phát triển của cây trống.
+Dùng làm thuốc tẩy: Dung dịch ammonia trong hộ gia đình được sử dụng làm chất tẩy rửa bề mặt như được dùng làm sạch thuỷ tinh, đổ sứ, thép không gỉ, lò nướng,...
+ Xử lý môi trường khí thải: Ammonia lỏng được sử dụng để loại bỏ các chất
như NOx, SOx trong các khí thải, khí đốt, …
+ Dùng làm chất chống khuẩn trong thực phẩm: Ammonia là một chất khử mạnh, được dùng để chống nhiễm khuẩn thịt bò.
+ Trong công nghiệp chế biến gỗ: Ammonia lỏng được sử dụng trong chế biến gỗ, làm cho màu sắc bề mặt thành phẩm đậm hơn.
* Tìm hiểu ứng dụng của muối ammonium
- Muối ammonium chủ yếu được sử dụng làm phân bón như phân đạm, phân phức hợp, …
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Liên kết hóa học trong phân tử NH3 là liên kết
A. cộng hóa trị phân cực. B. ion.
C. cộng hóa trị không phân cực. D. kim loại.
Câu 2. Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một khí khí đó là
A. NH3. B. H2. C. NO2. D. NO.
Câu 3. Trong các phát biểu sau về tính chất vật lí của ammonia, phát biểu nào không đúng?
A. Là chất khí không màu B. Mùi khai và xốc
C. Nhẹ hơn không khí D. Ít tan trong nước
Sản phẩm dự kiến:
Câu 1: A
Câu 2: A
Câu 3: D
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Viết phương trình hóa học khi cho dung dung dịch (NH4)2CO3 tác dụng với các dung dịch KOH, HCl, Ba(OH)2, CaCl2.
Câu 2: Hãy giải thích vì sao các loại phân bón như: NH4Cl, NH4NO3, (NH4)2SO4 không thích hợp bón cho đất chua.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 chân trời sáng tạo
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 KẾT NỐI TRI THỨC
Giáo án hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 11 kết nối tri thức
Giáo án chuyên đề Hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 kết nối tri thức
Trò chơi khởi động Hoá học 11 kết nối tri thức
Video AI khởi động Hoá học 11 kết nối tri thức hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 kết nối tri thức
Đề thi hóa học 11 kết nối tri thức
File word đáp án hóa học 11 kết nối tri thức
Bài tập file word Hóa học 11 kết nối tri thức
Kiến thức trọng tâm hóa học 11 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 11 kết nối tri thức
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 kết nối tri thức
Phiếu học tập theo bài Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CHÂN TRỜI SÁNG TẠO
Giáo án hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 11 chân trời sáng tạo
Giáo án chuyên đề Hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 11 chân trời sáng tạo
Trò chơi khởi động Hoá học 11 chân trời sáng tạo
Video AI khởi động Hoá học 11 chân trời sáng tạo hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 chân trời sáng tạo
Đề thi hóa học 11 chân trời sáng tạo
File word đáp án hóa học 11 chân trời sáng tạo
Bài tập file word hóa học 11 chân trời sáng tạo
Kiến thức trọng tâm hóa học 11 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 11 chân trời sáng tạo
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CÁNH DIỀU
Giáo án hoá học 11 cánh diều đủ cả năm
Giáo án điện tử hoá học 11 cánh diều
Giáo án chuyên đề Hóa học 11 cánh diều đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 cánh diều
Trò chơi khởi động Hoá học 11 cánh diều
Video AI khởi động Hoá học 11 cánh diều hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 cánh diều
Đề thi hóa học 11 cánh diều
Bài tập file word Hóa học 11 cánh diều
File word đáp án hóa học 11 cánh diều
Kiến thức trọng tâm hóa học 11 cánh diều
Đề kiểm tra 15 phút Hoá học 11 cánh diều
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 cánh diều
Phiếu học tập theo bài Hoá học 11 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 11 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 cánh diều cả năm
