Giáo án và PPT Hoá học 11 chân trời Bài 7: Sulfuric acid và muối sulfate
Đồng bộ giáo án word và powerpoint (ppt) Bài 7: Sulfuric acid và muối sulfate. Thuộc chương trình Hoá học 11 chân trời sáng tạo. Giáo án được biên soạn chỉnh chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word







Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 chân trời sáng tạo
BÀI 7: SULFURIC ACID VÀ MUỐI SULFATE
HOẠT ĐỘNG KHỞI ĐỘNG
GV yêu cầu HS thảo luận và trả lời:
Sulfuric acid là hóa chất hàng đầu trong nhiều ngành sản xuất, được mệnh danh là gì của các ngành công nghiệp?
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
Hoạt động 1: Sulfuric acid
HS thảo luận trả lời câu hỏi:
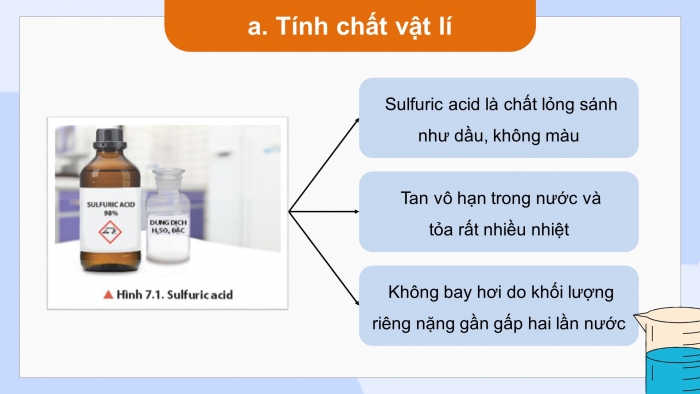
- Quan sát hình 7.1 (hoặc mẫu vật thật) nhận xét màu, trạng thái của sulfuric acid ở điều kiện thường và cho biết tại sao sulfuric acid lại không bay hơi ?
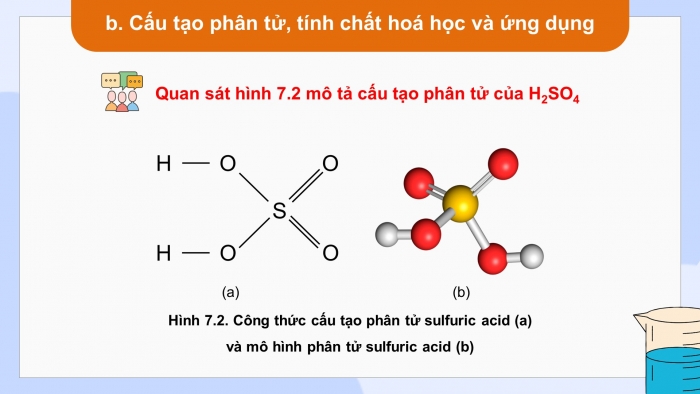
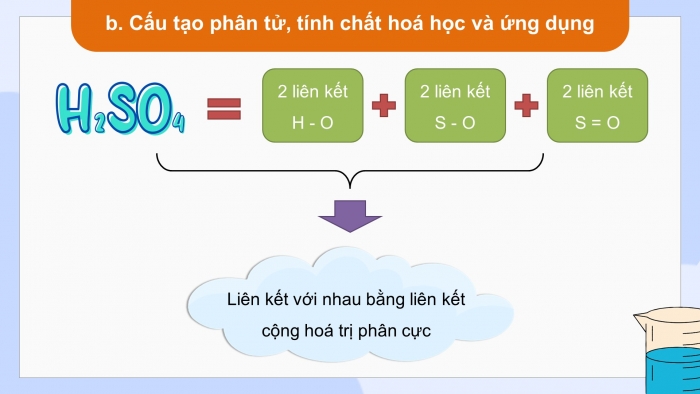
- Quan sát hình 7.2 mô tả cấu tạo phân tử của H2SO4

- Quan sát hình 7.3, nêu hiện tượng và viết phương trình hóa học xảy ra (nếu có).

- Nêu một số ứng dụng của H2SO4
- Quan sát hình 7.5 Mô tả cách pha loãng sulfuric acid. Giải thích.
- Hãy giải thích vì sao ở giai đoạn tạo ra SO3 người ta phải chọn điều kiện phản ứng ở nhiệt độ cao 450oC – 500oC.
Sản phẩm dự kiến:
* Tìm hiểu tính chất vật lí của sulfuric acid
- Sulfuric acid là chất lỏng sánh như dầu, không màu
- Tan vô hạn trong nước và tỏa rất nhiều nhiệt.
- Sulfuric acid lại không bay hơi do khối lượng riêng của nó nặng gần gấp hai lần nước.
* Tìm hiểu cấu tạo phân tử, tính chất hóa học và ứng dụng của sulfuric acid
- Phân tử H2SO4 có 2 liên kết H - O, 2 liên kết S - O, 2 liên kết S = O liên kết với nhau bằng liên kết cộng hoá trị phân cực
- Hiện tượng và viết phương trình hóa học:
+ Hiện tượng: ở ống nghiệm (a) có kết tủa trắng
+ PTHH: Ba(OH)2 + H2SO4 → 2H2O + BaSO4↓
+ Hiện tượng: ở ống nghiệm (b) sủi bọt khí
H2SO4 + Na2CO3 → H2O + Na2SO4 + CO2 ↑
- Ứng dụng: Sulfuric acid được dùng để sản xuất phân bón, thuốc trừ sâu, chất giặt rửa tổng hợp, tơ sợi hoá học, chất dẻo, sơn màu, phẩm nhuộm, dược phẩm, chế biến dầu mỏ...
* Tìm hiểu cách bảo quản sử dụng và nguyên tắc xử lý sơ bộ khi bị bỏng acid
- Cách pha loãng sulfuric acid:
+ Bước 1: Cho nước tinh khiết vào cốc thí nghiệm. Cho sulfuric acid vào một cốc khác. Tï lệ thể tích acid/nước phụ thuộc vào độ loäng của dung dịch.
+ Bước 2: Đặt chiếc đũa thuỷ tinh đứng thẳng, rét từ từ H2SO4 dọc theo thân đũa. Sau đó khuấy đều cho tới khi tan hết.
=>Giải thích: H2SO4 tan trong nước và tỏa lượng nhiệt rất lớn. H2SO4 cũng rất háo nước, khi đổ H2SO4 vào nước sẽ bắn các giọt dung dịch với nhiệt độ cao gảy bỏng acid rất nguy hiểm. Do đó, bắt buộc phải rớt từ từ H2SO4 vào nước, tuyệt đối không được làm ngược lại.
* Tìm hiểu quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc
- Chọn điều kiện phản ứng ở nhiệt độ cao 450oC – 500oC vì: Tăng nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều nghịch, làm giảm hiệu suất phản ứng. Nhưng nếu nhiệt độ quá thấp thì phản ứng khó xảy ra. Do đó, người ta chọn điều kiện phản ứng ở nhiệt độ 450oC – 500oC, xúc tác Vanadium oxide (V2O5) để tối ưu hoá hiệu suất phản ứng.
Hoạt động 2: Muối sulfate
Gv yêu cầu HS trao đổi theo nhóm:
- Nêu ứng dụng trong đời sống sản xuất một số muối sulfate mà em biết.
- Quan sát hình 7.6, trình bày cách nhận biết ion SO42 -, nêu hiện tượng xảy ra, viết phương trình hóa học.
Sản phẩm dự kiến:
- Ngoài các muối trong SGK có thể mở rộng:
+ Sodium sulfate (Na2SO4) được sử dụng trong sản xuất xà phòng và chất tẩy rửa, các sản phẩm dệt may, giấy, bột giấy và thuỷ tỉnh.
+ Copper(II) sulfate (CuSO4) được sử dụng trong nông nghiệp để diệt nấm, làm thuốc trừ sâu, thuốc diệt cỏ, làm chất tổng hợp hữu cơ, chất phân tích trong phòng thí nghiệm,...
+ Zinc sulfate (ZnSO4) được sử dụng trong sản xuất thức ăn gia súc, phân bón vi lượng, sản xuất mực in, thuốc nhuộm, thuốc khử trùng,...
+ Aluminium sulfate (Al2(SO4)3) được sử dụng để lọc tẩy chất cặn bẩn công nghiệp, chất gắn màu trong ngành công nghiệp dệt nhuộm và in ấn, chất chống thâm hiệu quả.
+Potassium sulfate (K2SO4) thường được sử dụng phổ biến làm phân bón,...
- Để nhận biết ion SO42- ta sử dụng các dung dịch muối của barium (Ba2+), ví dụ như BaCl2, Ba(NO3)2… hoặc Barium hydroxide Ba(OH)2.
+ Hiện tượng: Phản ứng sẽ cho kết tủa trắng không tan trong nước và acid mạnh.
+Tổng quát: SO42- + Ba2+ → BaSO4(↓ trắng)
+Phương trình hóa học minh họa:
Na2SO4 + BaCl2 → BaSO4(↓ trắng) + 2NaCl
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Cách pha loãng H2SO4 đặc an toàn là
A. Rót từ từ acid vào nước và khuấy đều
B. Rót nhanh acid vào nước và khuấy đều
C. Rót từ từ nước vào acid và khuấy đều
D. Rót nhanh nước vào acid và khuấy đều
Câu 2: Để nhận biết sự có mặt của ion sulfate trong dung dịch, người ta thường dùng
A. Dung dịch chứa ion Ba2+
B. Thuốc thử duy nhất là Ba(OH)2
C. Quỳ tím
D. Dung dịch muối Mg2+
Câu 3: Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
A. Al
B. Mg
C. Na
D. Cu
Sản phẩm dự kiến:
Câu 1: A
Câu 2: A
Câu 3: D
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Viết phương trình hóa học khi cho dung dịch H2SO4 đặc tác dụng với KBr, C. Cho biết sản phẩm khử duy nhất là SO2.
Câu 2: Hãy cho biết giai đoạn nào trong quá trình sản xuất H2SO4 là có nguy cơ cao gây ô nhiễm môi trường. Giải thích.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 chân trời sáng tạo
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 KẾT NỐI TRI THỨC
Giáo án hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 11 kết nối tri thức
Giáo án chuyên đề Hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 kết nối tri thức
Trò chơi khởi động Hoá học 11 kết nối tri thức
Video AI khởi động Hoá học 11 kết nối tri thức hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 kết nối tri thức
Đề thi hóa học 11 kết nối tri thức
File word đáp án hóa học 11 kết nối tri thức
Bài tập file word Hóa học 11 kết nối tri thức
Kiến thức trọng tâm hóa học 11 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 11 kết nối tri thức
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 kết nối tri thức
Phiếu học tập theo bài Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CHÂN TRỜI SÁNG TẠO
Giáo án hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 11 chân trời sáng tạo
Giáo án chuyên đề Hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 11 chân trời sáng tạo
Trò chơi khởi động Hoá học 11 chân trời sáng tạo
Video AI khởi động Hoá học 11 chân trời sáng tạo hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 chân trời sáng tạo
Đề thi hóa học 11 chân trời sáng tạo
File word đáp án hóa học 11 chân trời sáng tạo
Bài tập file word hóa học 11 chân trời sáng tạo
Kiến thức trọng tâm hóa học 11 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 11 chân trời sáng tạo
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CÁNH DIỀU
Giáo án hoá học 11 cánh diều đủ cả năm
Giáo án điện tử hoá học 11 cánh diều
Giáo án chuyên đề Hóa học 11 cánh diều đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 cánh diều
Trò chơi khởi động Hoá học 11 cánh diều
Video AI khởi động Hoá học 11 cánh diều hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 cánh diều
Đề thi hóa học 11 cánh diều
Bài tập file word Hóa học 11 cánh diều
File word đáp án hóa học 11 cánh diều
Kiến thức trọng tâm hóa học 11 cánh diều
Đề kiểm tra 15 phút Hoá học 11 cánh diều
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 cánh diều
Phiếu học tập theo bài Hoá học 11 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 11 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 cánh diều cả năm
