Giáo án điện tử Hoá học 11 chân trời Bài 4: Ammonia và một số hợp chất ammonium
Bài giảng điện tử Hoá học 11 chân trời sáng tạo. Giáo án powerpoint Bài 4: Ammonia và một số hợp chất ammonium. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt, tạo hứng thú học tập cho học sinh. Thầy, cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 11 chân trời sáng tạo
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét










Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 11 chân trời sáng tạo
CHÀO MỪNG CẢ LỚP ĐẾN VỚI BÀI HỌC HÔM NAY!
KHỞI ĐỘNG
TRÒ CHƠI Ô CHỮ
Luật chơi:
- Có 7 từ hàng ngang tương ứng với 7 câu hỏi gợi ý bất kỳ.
- Các em dựa vào gợi ý và tìm từ hàng ngang tương ứng với số ô chữ của mỗi hàng.
- Sau khi lật mở hết từ hàng ngang, em hãy đọc từ hàng dọc xuất hiện trong trò chơi.
Ô số 1 (4 chữ cái): Dung dịch base làm quỳ tím chuyển thành màu gì?
Ô số 2 (7 chữ cái): So sánh khả năng phản ứng của N2 ở nhiệt độ cao và ở nhiệt độ thường?
Ô số 3 (6 chữ cái): Trong phản ứng: N2 + 6Li → 2Li3N, nitrogen thể hiện tính chất gì?
Ô số 4 (9 chữ cái): Phản ứng điều chế nitrogen trong phòng thí nghiệm thuộc loại phản ứng gì?
Ô số 5 (12 chữ cái): Nitrogen tác dụng với oxygen ở 3000oC tạo ra hợp chất có tên là gì?
Ô số 6 (5 chữ cái): Yếu tố nào khi sử dụng không làm cho cân bằng của phản ứng giữa nitrogen và hydrogen chuyển dịch mà chỉ làm tăng tốc độ phản ứng?
Ô số 7 (10 chữ cái): Phương pháp chưng cất phân đoạn không khí lỏng là phương pháp điều chế nitrogen ở đâu?
BÀI 4: AMMONIA VÀ MỘT SỐ HỢP CHẤT AMMONIUM
NỘI DUNG BÀI HỌC
CẤU TẠO PHÂN TỬ CỦA AMMONIA
TÍNH CHẤT CỦA AMMONIA
TỔNG HỢP AMMONIA
MUỐI AMMONIA
ỨNG DỤNG
- CẤU TẠO PHÂN TỬ CỦA AMMONIA
HOẠT ĐỘNG NHÓM
Câu hỏi 1 (SGK tr.24)
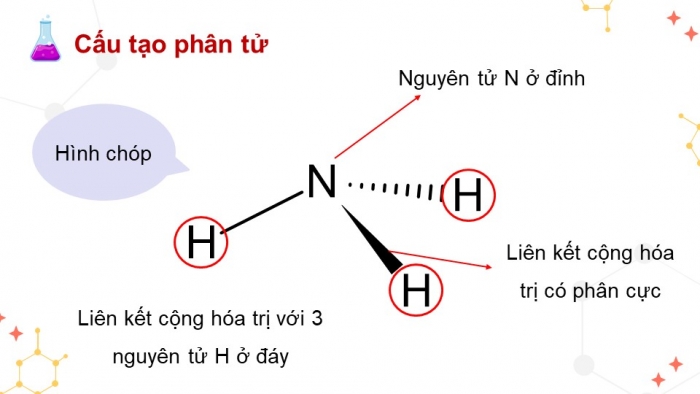
Quan sát hình 4.1, mô tả cấu tạo của phân tử Ammonia. Dự đoán tính tan (trong nước) và tính oxi hóa - khử của ammonia. Giải thích
Cấu tạo phân tử
Hình chóp
Nguyên tử N ở đỉnh
Liên kết cộng hóa trị có phân cực
Liên kết cộng hóa trị với 3 nguyên tử H ở đáy
- Theo công thức Lewis, nguyên tử Nitrogen trong phân tử NH3 còn 1 cặp electron tự do chưa liên kết hoá học ® NH3 có khả năng hoạt động hoá học mạnh.
- Phân tử NH3 phân cực mạnh và tạo được liên kết hydrogen với nước do đó có thể dự đoán NH3 dễ tan trong nước (dung môi phân cực)
KẾT LUẬN
Phân tử NH3 có cấu trúc chóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác có các đỉnh là nguyên tử Hydrogen.
- TÍNH CHẤT CỦA AMMONIA
Tính chất vật lí
Xem thí nghiệm Tính tan của ammonia trong nước và hình 4.2, trả lời câu hỏi 2, 3 (SGK tr.25):
Quan sát hình 4.2 giải thích hiện tượng thí nghiệm từ đó cho biết tại sao không thu khí ammonia bằng phương pháp đẩy nước?
Tính tỉ khối của NH3 so với không khí. Từ kết quả đó hãy giải thích vì sao có thể thu khí NH3 bằng phương pháp đẩy không khí (úp ngược bình)
Hiện tượng: nước trong chậu phun vào bình thành những tia màu hồng
Khí ammonia tan nhiều trong nước
Áp suất trong bình giảm đột ngột, nước trong chậu bị hút vào bình
+ phenolphtalein
Phun thành các tia nước màu hồng
Hiện tượng: nước trong chậu phun vào bình thành những tia màu hồng
NH3 hoà tan nhiều trong nước ® Không thể thu khí NH3 bằng phương pháp đẩy nước
Câu hỏi 3.
dNH3/kk = < 1
Vậy NH3 nhẹ hơn không khí → Có thể thu được bằng phương pháp đẩy không khí (úp ngược bình)
KẾT LUẬN
Ammonia là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí.
Tan nhiều trong nước tạo thành dung dịch Ammonia.
Dung dịch Ammonia đậm đặc nồng độ 25%.
Tính chất hoá học
Nhóm 1, 2: Trả lời câu hỏi 4
Nhóm 3, 4: Trả lời câu hỏi 5
Nhóm 5, 6: Trả lời câu hỏi 6
Câu hỏi 4. Từ sự kết hợp giữa NH3 và nước. nhận xét tính acid - base của NH3 trong dung dịch. Nêu cách nhận biết khí NH3 bằng quỳ tím. Giải thích.
Theo thuyết Bronsted - Lowry, khi tác dụng với nước, NH3 đóng vai trò là base tạo ra ion OH−, làm cho dung dịch có tính base
Có thể dùng giấy quỳ tím ẩm để nhận biết khí NH3. Nước trong quỳ tím ẩm sẽ hoà tan NH3 thành dung dịch NH3 có tính base, làm quỳ tím chuyển xanh.
Câu hỏi 5. Chuẩn bị hai đầu đũa thủy tinh quấn bông. Đũa nhúng vào dung dịch HCl đặc vào dung dịch và NH3 đặc, sau đó đưa lại gần nhau (Hình 4.3) Quan sát và nêu hiện tượng xảy ra từ đó đề xuất phương pháp nhận biết Ammonia bằng dung dịch HCl đặc.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 11 chân trời sáng tạo
ĐẦY ĐỦ GIÁO ÁN CÁC BỘ SÁCH KHÁC
GIÁO ÁN WORD LỚP 11 CHÂN TRỜI SÁNG TẠO
GIÁO ÁN POWERPOINT LỚP 11 CHÂN TRỜI SÁNG TẠO
GIÁO ÁN CHUYÊN ĐỀ 11 CHÂN TRỜI SÁNG TẠO
GIÁO ÁN DẠY THÊM 11 CHÂN TRỜI SÁNG TẠO
CÁCH ĐẶT MUA:
Liên hệ Zalo: Fidutech - nhấn vào đây
