Giáo án điện tử hóa học 10 kết nối bài 11: Liên kết ion
Bài giảng điện tử hóa học 10 kết nối tri thức. Giáo án powerpoint bài 11: Liên kết ion. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 10 kết nối tri thức (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét









Xem video về mẫu Giáo án điện tử hóa học 10 kết nối bài 11: Liên kết ion
Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 10 kết nối tri thức
NHIỆT LIỆT CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC
KHỞI ĐỘNG
Hợp chất NaCl nóng chảy ở nhiệt độ cao và có khả năng dẫn điện khi nóng chảy hoặc khi hòa tan trong dung dịch. Yếu tố nào trong phân tử NaCl gây ra các tính chất trên?
BÀI 11: LIÊN KẾT ION
NỘI DUNG BÀI HỌC
SỰ TẠO THÀNH ION
SỰ TẠO THÀNH LIÊN KẾT ION
TINH THỂ ION
SỰ TẠO THÀNH ION
Trả lời câu hỏi
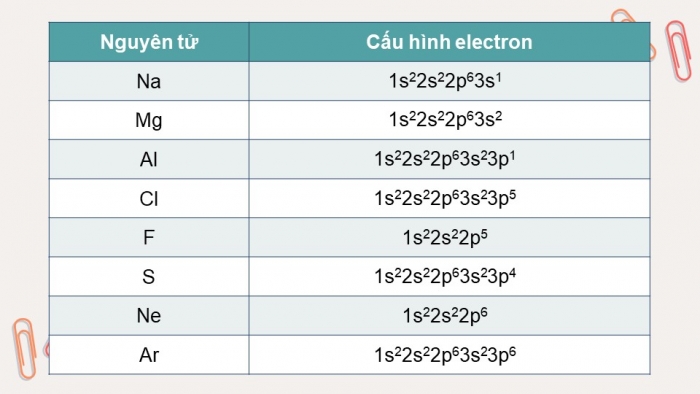
- Viết cấu hình electron của các nguyên tử Na, Mg, Al, Cl, F, S, Ne, Ar
- So sánh độ bền cấu hình electron của Na, Mg, Al, F với Ne; S và Cl với Ar.
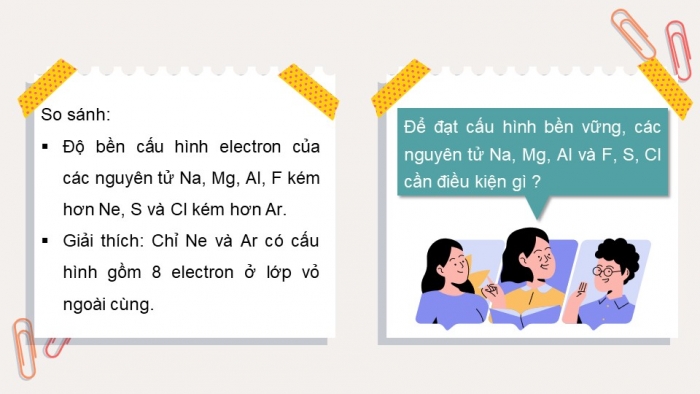
So sánh:
- Độ bền cấu hình electron của các nguyên tử Na, Mg, Al, F kém hơn Ne, S và Cl kém hơn Ar.
- Giải thích: Chỉ Ne và Ar có cấu hình gồm 8 electron ở lớp vỏ ngoài cùng.
Nhận xét
Để đạt cấu hình bền vững, các nguyên tử nhường electron tạo thành ion dương (cation) hoặc nhận thêm electron tạo thành ion âm (anion) để đạt cấu hình khí hiếm gần nhất.
- Điện tích cation bằng số electron mà nguyên tử đã nhường.
- Điện tích anion bằng số electron mà nguyên tử đã nhận.
Nhận xét điện tích của mỗi ion, viết sơ đồ quá trình tạo thành ion cho Mg, Al, F, S dựa theo ví dụ sau:
- VD1: Na nhường 1 electron tạo ion dương (cation) Na+ có cấu hình khí hiếm.
Nhận xét điện tích của mỗi ion, viết sơ đồ quá trình tạo thành ion cho Mg, Al, F, S dựa theo ví dụ sau:
VD2: Cl nhận 1 electron tạo thành ion âm (anion) Cl- có cấu hình khí hiếm.
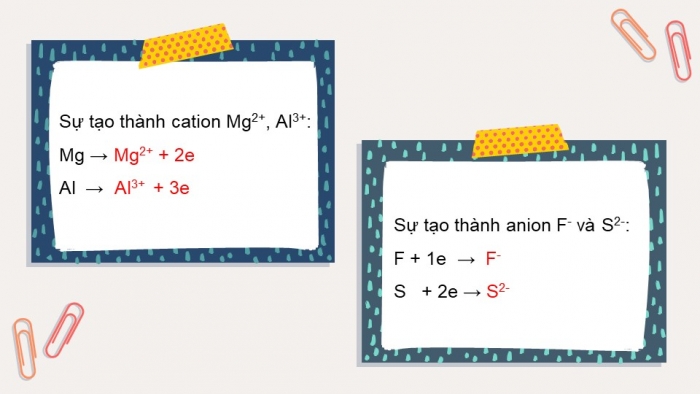
Sự tạo thành cation Mg2+, Al3+:
Mg → Mg2+ + 2e
Al → Al3+ + 3e
Sự tạo thành anion F- và S2-:
F + 1e → F-
S + 2e → S2-
HOẠT ĐỘNG NHÓM
Chia lớp thành 3 nhóm, thảo luận và thực hiện nhiệm vụ:
- Nhóm 1: Câu hỏi 1 (SGK tr.52)
- Nhóm 2: Câu hỏi 2 (SGK tr.52)
- Nhóm 3: Câu hỏi 3 (SGK tr.52)
CH1 (SGK tr.52). Hoàn thành các sơ đồ tạo thành ion sau:
- a) Li → Li+ + ?
- b) Be → ? + 2e
- c) Br + ? → Br–
- d) O + 2e → ?
CH2 (SGK tr.52): Viết cấu hình electron của các ion K+, Mg2+, F, S2-. Mỗi cấu hình đó giống với cấu hình electron của nguyên tử khí hiếm nào?
SỰ TẠO THÀNH LIÊN KẾT ION
Trả lời câu hỏi
Có phải tất cả các ion chúng ta biết sẽ hút nhau?
Trong các ion Na+, Mg2+, Cl-, O2-, những ion nào sẽ hút nhau?
Nêu nhận xét bản chất của liên kết ion?
- Không phải tất cả các ion đều sẽ hút nhau.
- Lực hút tĩnh điện giữa các ion điện tích trái dấu trong phân tử hay tinh thể tạo ra liên kết ion.
- Thường được hình thành giữa kim loại điển hình và phi kim điển hình.
HOẠT ĐỘNG NHÓM
- Đề xuất một số ion và sự hình thành ion theo quy tắc octet.
- Đưa ra một số nguyên tử.
- Dự đoán khả năng tạo thành cation/anion giữa hai nguyên tử.
- Dự đoán có khả năng tạo thành liên kết ion hay không?
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 10 kết nối tri thức
