Giáo án điện tử hóa học 10 kết nối bài 20: Ôn tập chương 6
Bài giảng điện tử hóa học 10 kết nối. Giáo án powerpoint bài 20: Ôn tập chương 6. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 10 kết nối tri thức (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét




Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 10 kết nối tri thức
CHÀO MỪNG CÁC EM ĐẾN VỚI TIẾT HỌC HÔM NAY!
KHỞI ĐỘNG
Trò chơi
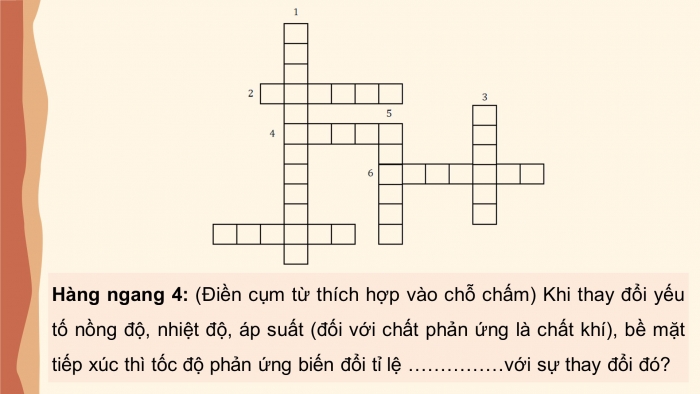
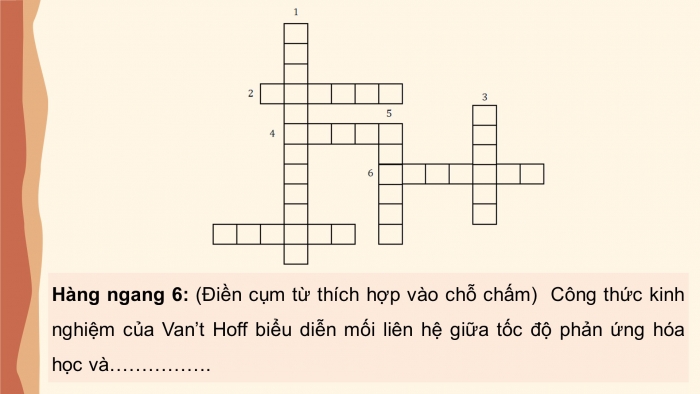
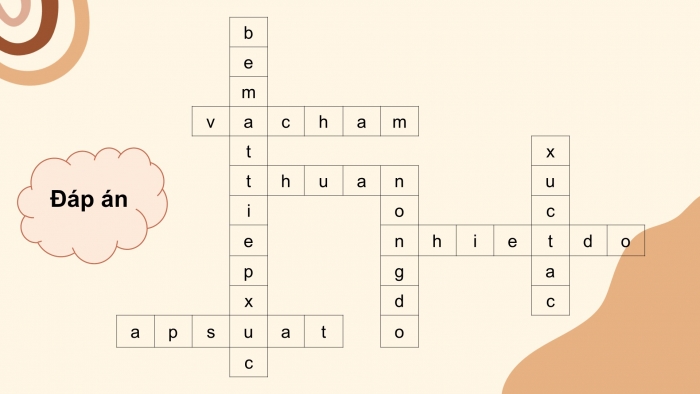
Giải ô chữ
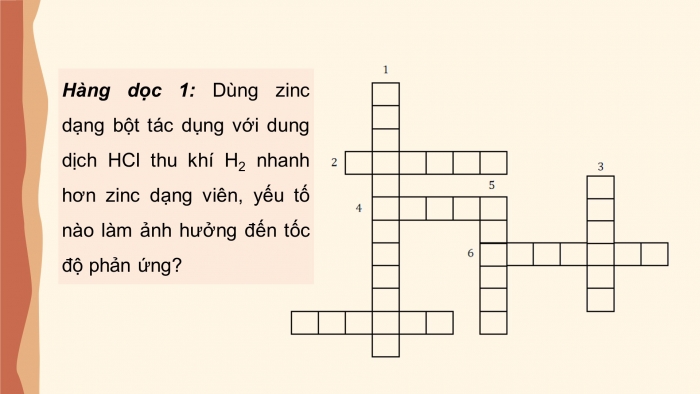
Hàng dọc 1: Dùng zinc dạng bột tác dụng với dung dịch HCl thu khí H2 nhanh hơn zinc dạng viên, yếu tố nào làm ảnh hưởng đến tốc độ phản ứng?
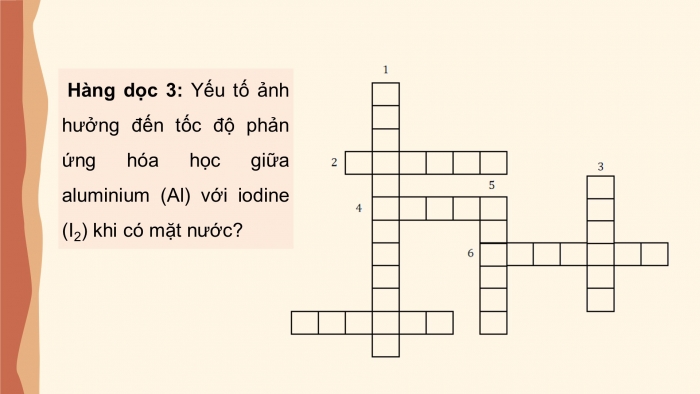
Hàng dọc 3: Yếu tố ảnh hưởng đến tốc độ phản ứng hóa học giữa aluminium (Al) với iodine (I2) khi có mặt nước?
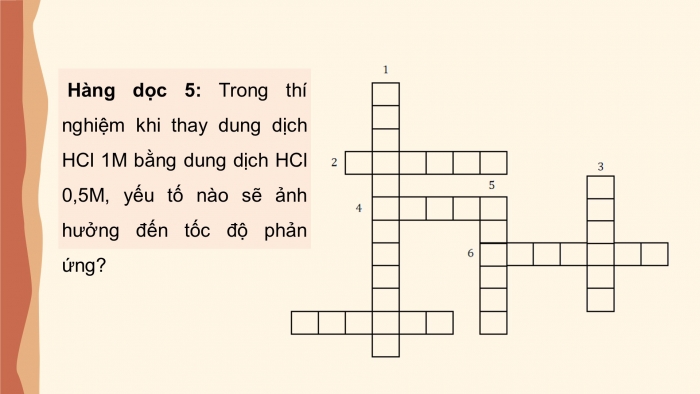
Hàng dọc 5: Trong thí nghiệm khi thay dung dịch HCl 1M bằng dung dịch HCl 0,5M, yếu tố nào sẽ ảnh hưởng đến tốc độ phản ứng?
Hàng ngang 2: (Điền cụm từ thích hợp vào chỗ chấm) Để xảy ra một phản ứng hóa học, các chất tham gia cần tiếp xúc với nhau, khi đó các phân tử chất phản ứng …………….. với nhau phá vỡ các liên kết cũ và hình thành các liên kết mới, sinh ra các chất mới gọi là sản phẩm của phản ứng hóa học.
Hàng ngang 4: (Điền cụm từ thích hợp vào chỗ chấm) Khi thay đổi yếu tố nồng độ, nhiệt độ, áp suất (đối với chất phản ứng là chất khí), bề mặt tiếp xúc thì tốc độ phản ứng biến đổi tỉ lệ ……………với sự thay đổi đó?
Hàng ngang 6: (Điền cụm từ thích hợp vào chỗ chấm) Công thức kinh nghiệm của Van’t Hoff biểu diễn mối liên hệ giữa tốc độ phản ứng hóa học và…………….
Hàng ngang 7: Trong phản ứng hóa học có sự tham gia của chất khí, yếu tố nào có thể ảnh hưởng trực tiếp đến tốc độ phản ứng?
BÀI 20: ÔN TẬP CHƯƠNG 6
NỘI DUNG BÀI HỌC
Hệ thống hoá kiến thức
Luyện tập
- Hệ thống hoá kiến thức
Hoàn thành các nội dinh còn thiếu sau:
Tốc độ phản ứng: Xét phản ứng hoá học dạng tổng quát:
Aa + bB → cC + dD
Biểu thức tốc độ trung bình của phản ứng: vtb = ..(1)..
Nếu phản ứng trên là một phản ứng đơn giản thì biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng: v = ..(2)..
Đáp án
1)
2) v = k
(3) Nồng độ
(4) Áp suất
(5) Nhiệt độ
(6) Diện tích tiếp xúc
(7) Chất xúc tác
Kết luận
- Tốc độ phản ứng được xác định bằng sự thay đổi lượng chất ban đầu hoặc sản phẩm trong một đơn vị thời gian.
- Biểu thức tốc độ phản ứng phụ thuộc vào hằng số tốc độ chỉ áp dụng cho các phản ứng đơn giản.
- Tốc độ phản ứng phụ thuộc vào nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác.
LUYỆN TẬP
PHIẾU HỌC TẬP 1
BT1. Cho phản ứng: A+ 2B → CNồng độ ban đầu các chất: CA= 0,3M; CB= 0,5M. Hằng số tốc độ k = 0,4. Tính tốc độ phản ứng lúc ban đầu?
BT2. Tốc độ của phản ứng tăng bao nhiêu lần nếu tăng nhiệt độ từ 200oC đến 240oC, biết rằng khi tăng 10oC thì tốc độ phản ứng tăng 2 lần?
PHIẾU HỌC TẬP 2
BT3: Cho phản ứng:
X(khí) + 2Y(khí) → Z(khí) + T(khí)
Nếu tăng nồng độ chất Y lên 4 lần và nồng độ chất X giảm đi 2 lần thì tốc độ phản ứng tăng hay giảm bao nhiêu lần?
BT4. Cho phản ứng:
2X(khí) + Y(khí) → Z(khí) + T(khí)
Nếu áp suất của hệ tăng 3 lần thì tốc độ phản ứng tăng hay giảm bao nhiêu lần?
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 10 kết nối tri thức
