Giáo án điện tử hóa học 10 kết nối bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài giảng điện tử hóa học 10 kết nối tri thức. Giáo án powerpoint bài 3: Cấu trúc lớp vỏ electron nguyên tử. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 10 kết nối tri thức (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét








Xem video về mẫu Giáo án điện tử hóa học 10 kết nối bài 3: Cấu trúc lớp vỏ electron nguyên tử
Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 10 kết nối tri thức
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC NGÀY HÔM NAY!
KHỞI ĐỘNG
Câu 1: Số hiệu nguyên tử cho biết thông tin nào sau đây?
- Số proton
- Số neutron.
- Số khối
- Nguyên tử khối
Câu 2: Kí hiệu nào sau đâu gồm các đồng vị của cùng một nguyên tố hóa học?
Câu 3: Kí hiệu nguyên tử nào sau đây viết đúng?
Câu 5: Nitrogen có hai đồng vị bền. Oxygen có hai đồng vị bền. Số hợp chất NO2 tạo thành từ các đồng vị trên là:
- 3
- 9
- 5
- 12
Em có thấy sự tương đồng giữa chuyển động của electron xung quanh hạt nhân với các hành tinh trong hệ mặt trời?
BÀI 3
CẤU TRÚC LỚP VỎ ELECTRON NGUYÊN TỬ
NỘI DUNG BÀI HỌC
Chuyển động của electron trong nguyên tử
Lớp và phân lớp electron
Cấu hình electron trong nguyên tử
I.Chuyển động của electron trong nguyên tử.
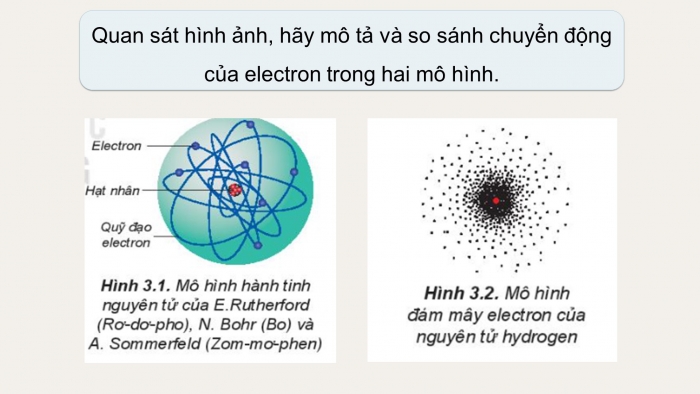
Quan sát hình ảnh, hãy mô tả và so sánh chuyển động của electron trong hai mô hình.
Theo mô hình hiện đại: electron chuyển động hỗn loạn không có quỹ đạo xác định quanh hạt nhân.
- Hình dạng orbital nguyên tử
Câu hỏi 2 sgk: Orbital S có dạng:
- hình tròn
- hình số 8 nổi
- hình cầu
- hình bầu dục
Câu hỏi 3 sgk: Quan sát Hình 3.3 và nêu sự định hướng của AO p trong không gian
AO p gồm 3 orbital, có dạng hình số 8 nổi:
- AO px định hướng theo trục x.
- AO py định hướng theo trục y.
- AO pz định hướng theo trục z.
- Ô orbital
- Mỗi AO được biểu diễn bằng một ô vuông ⬜ chứa tối đa 2 mũi tên chiều quay được nhau đại diện cho 2 electron.
- Nếu orbital có 1 electron, ta biểu diễn bằng mũi tên đi lên.
Em hãy thưc hành viết một số kiểu hình dạng orbital với:
a, 1 electron
b, 2 electron
c, 3 electron
Các electron được điền từ trái qua phải và có xu hướng điền vào các ô orbital sao cho nhiều electron độc thân nhất.
Mô tả sắp xếp 2 electron vào các ô orbital p nào dưới đây là đúng?
- Lớp và phân lớp electron
Trong nguyên tử, các electron sắp xếp thành từng lớp và phân lớp theo các mức năng lượng từ thấp đến cao.
- Lớp electron
Hãy gọi tên của các lớp electron và so sánh năng lượng của các electron trong cùng 1 lớp.
- Lớp electron: n = 1,2,3,4,… tương ứng K,L,M,N,…
- Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau.
- Phân lớp electron
- Phân lớp electron kí hiệu: s, p, d, f,…
- Số phân lớp bằng số thứ tự của lớp (n ≤ 4)
- Lớp electron được chia ra thành các phân lớp. Các phân lớp đó có tên là gì ? Mỗi lớp có bao nhiêu phân lớp ?
- Lớp thứ nhất có một phân lớp, được kí hiệu là 1s.
- Lớp thứ hai có 2 phân lớp kí hiệu là 2s và 2p.
- Lớp thứ ba có 3 phân lớp kí hiệu là 3s, 3p, 3d.
- Lớp thứ 4 có 4 phân lớp kí hiệu là 4s, 4p, 4d, 4f.
Năng lượng của electron trong cùng một lớp gần bằng nhau nhưng cùng một phân lớp là cùng mức năng lượng.
→ Các phân lớp có năng lượng khác nhau
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 10 kết nối tri thức
