Giáo án điện tử hóa học 10 kết nối bài 14: Ôn tập chương 3
Bài giảng điện tử hóa học 10 kết nối. Giáo án powerpoint bài 14: Ôn tập chương 3. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt tạo hứng thú học tập cho học sinh. Thầy cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 10 kết nối tri thức (bản word)
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét







Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 10 kết nối tri thức
BÀI 14: ÔN TẬP CHƯƠNG 3
- KHỞI ĐỘNG
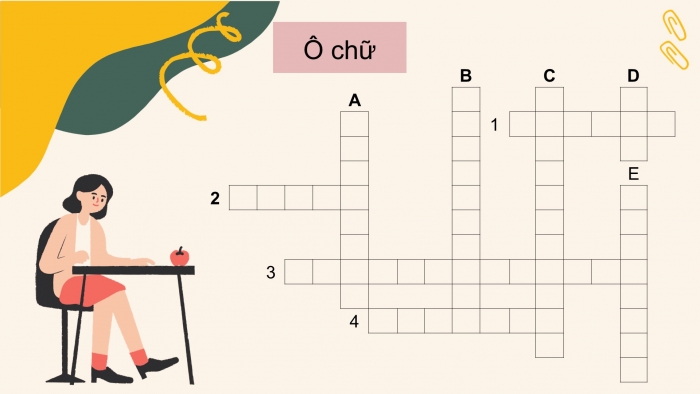
Trò chơi: Ô chữ Hoá học
Có 5 từ khóa hàng dọc và 4 từ hóa hàng ngang. Mỗi từ khóa là đáp án của 1 câu hỏi. HS giơ tay để được quyền chọn và trả lời câu hỏi. Trả lời chính xác từ khóa sẽ được 1 phần quà. Nếu trả lời sai, cơ hội sẽ giành cho các bạn học sinh khác.
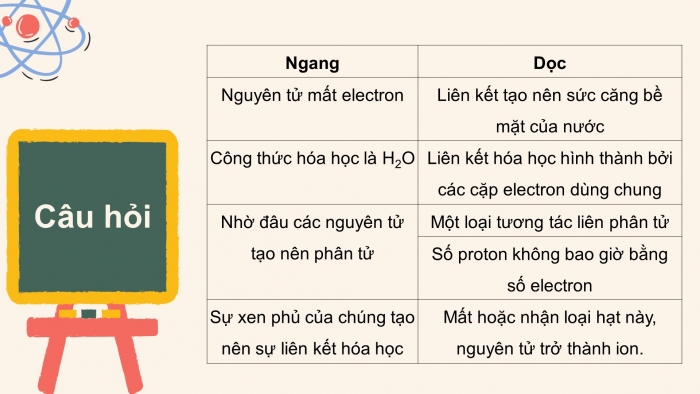
Các câu hỏi trong trò chơi:
Ngang | Dọc |
1. Nguyên tử mất electron | A. Liên kết tạo nên sức căng bề mặt của nước |
2. Công thức hóa học là H2O | B. Liên kết hóa học hình thành bởi các cặp electron dùng chung |
3. Nhờ đâu các nguyên tử tạo nên phân tử | C. Một loại tương tác liên phân tử |
D. Số proton không bao giờ bằng số electron | |
4. Sự xen phủ của chúng tạo nên sự liên kết hóa học | E. Mất hoặc nhận loại hạt này, nguyên tử trở thành ion. |
- Ô chữ Hoá học:
Ô chữ trong file ppt
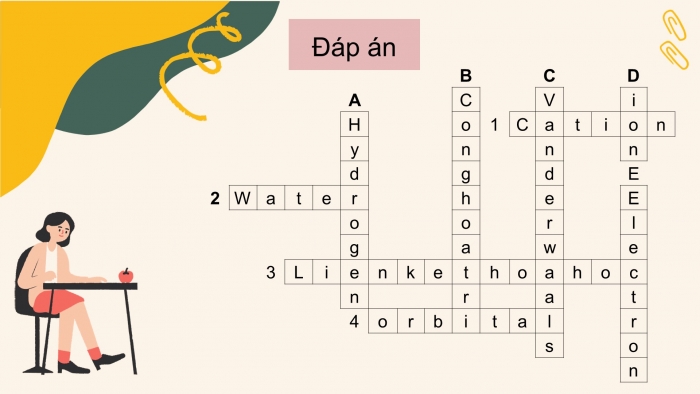
Đáp án:
- Cation
- Water
- Liên kết hóa học
- Orbital
- Hydrogen
- Cộng hóa trị
- Van der Waals
- Ion
- Electron
- NỘI DUNG BÀI HỌC
- Hệ thống hoá kiến thức
- Luyện tập
III. PHẦN TRIỂN KHAI KIẾN THỨC
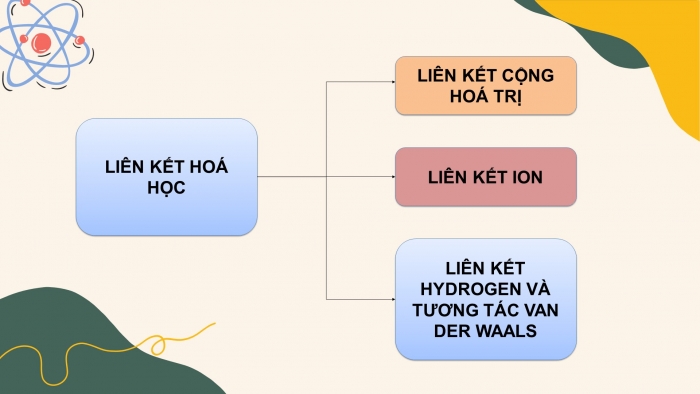
- Hệ thống hoá kiến thức
Em hãy hoàn thành sơ đồ hệ thống hoá kiến thức SGK trang 68.
Sơ đồ hệ thống hoá kiến thức trong ppt
Đáp án
(1) một hay nhiều cặp electron dùng chung.
(2) không phân cực
(3) phân cực
(4) cho nhận
(5) không bị hút lệch về phía nguyên tử nào
(6) Cl2, Br2, …
(7) lệch về phía nguyên tử có độ âm điện lớn hơn.
(8) H2O, CO, NH3, …
(9) là do một nguyên tử đóng góp.
(10) SO2, HNO3,…
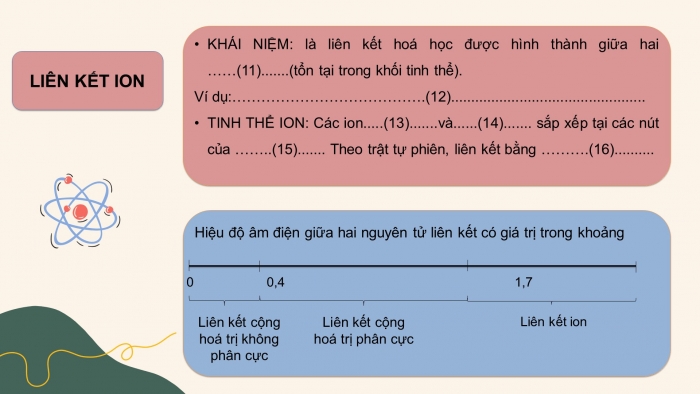
(11) ion mang điện tích trái dấu.
(12) NaCl, NaF, CaCl2, …
(13) Các ion âm và dương sắp xếp tại các nút của mạng tinh thể theo trật tự luân phiên, liên kết bằng lực hút tĩnh điện của chúng.
(14) phân tử (hay nguyên tử).
(15) tăng
- Luyện tập
Em hãy trả lời câu 1, 2, 3 SGK trang 69.
Câu 1: Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết ion?
- Cl2, Br2, I2, HCl.
- Na2O, KCl, BaCl2, Al2O3.
- HCl, H2S, NaCl, N2O.
- MgO, H2SO4, H3PO4, HCl.
Đáp án: B
Câu 2: Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hoá trị không phân cực?
A N2, CO2, Cl2, H2.
- N2, Cl2, H2, HCl.
- N2, Hl, Cl2, CH4.
- Cl2, O2, N2, F2.
Đáp án: D
Câu 3: Viết công thức cấu tạo và công thức Lewis của các phân tử sau PH3, H2O, C2H6. Trong phân tử nào có liên kết phân cực mạnh nhất.
Đáp án
| Công thức cấu tạo | Công thức Lewis |
PH3 | ||
H2O | ||
C2H6 |
Các nguyên tử O, P, N đều tạo liên kết phân cực với H, trong đó nguyên tử O có độ âm điện lớn hơn cả nên liên kết O – H sẽ phân cực nhất
Hoạt động nhóm: trả lời câu 4, 5, 6 SGK trang 69
Câu 4: Dựa vào giá trị đó âm điện của các nguyên tử trong Bảng 6.2, xác định loại liên kết trong phân tử các chất CH4, CaCl2, HBr, NH3.
Đáp án:
Phân tử | Hiệu độ âm điện | Loại liên kết |
CH4 | 2,55 - 2,2 <0,4 | Cộng hóa trị không phân cực |
CaCl2 | 3,16 - 1,0 >1,7 | Ion |
HBr | 2,96 – 2,2 > 0,4 | Cộng hóa trị phân cực |
NH3 | 3,04 – 2,2 > 0,4 | Cộng hóa trị phân cực |
Câu 5: Cho dãy các oxide sau Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
- a) Độ phân cực của các liên kết trong dãy các oxide trên thay đổi thế nào?
- b) Dựa vào giá trị độ âm điện của các nguyên tố trong Bảng 6.2, cho biết loại liên kết (ion, cộng hoá trị phân cực, cộng hóa trị không phân cực) trong từng phân tử oxide.
Đáp án:
a, Độ phân cực trong dãy oxide giảm dần theo chiều từ trái qua phải: Na2O, MgO, Al2O3, SiO2, P2O5, SO3 và Cl2O7.
Do hiệu độ âm điện giảm dần.
b, Liên kết ion: Na2O, MgO, Al2O3.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 10 kết nối tri thức
