Giáo án điện tử Hoá học 11 chân trời Bài 7: Sulfuric acid và muối sulfate
Bài giảng điện tử Hoá học 11 chân trời sáng tạo. Giáo án powerpoint Bài 7 Sulfuric acid và muối sulfate. Giáo án thiết kế theo phong cách hiện đại, nội dung đầy đủ, đẹp mắt, tạo hứng thú học tập cho học sinh. Thầy, cô giáo có thể tham khảo.
Xem: => Giáo án hóa học 11 chân trời sáng tạo
Click vào ảnh dưới đây để xem 1 phần giáo án rõ nét







Các tài liệu bổ trợ khác
Xem toàn bộ: Giáo án điện tử hoá học 11 chân trời sáng tạo
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
KHỞI ĐỘNG
Chất được nhắc đến trong video là gì? Nêu hiểu biết của em về chất đó.
BÀI 7.
SULFURIC ACID VÀ MUỐI SUNFATE
NỘI DUNG BÀI HỌC
SULFURIC ACID
MUỐI SULFATE
SULFURIC ACID
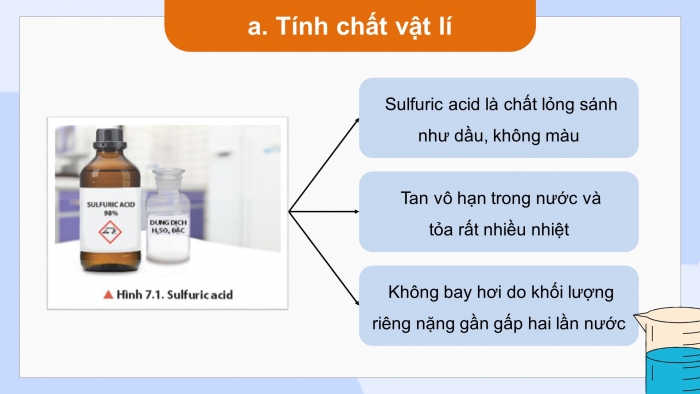
- Tính chất vật lí
Quan sát hình 7.1 (hoặc mẫu vật thật):
Nhận xét màu, trạng thái của sulfuric acid ở điều kiện thường và cho biết tại sao sulfuric acid lại không bay hơi?
Sulfuric acid là chất lỏng sánh như dầu, không màu
Tan vô hạn trong nước và
tỏa rất nhiều nhiệt
Không bay hơi do khối lượng riêng nặng gần gấp hai lần nước
KẾT LUẬN
Sulfuric acid (H2SO4) là:
- Chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp 2 lần nước (H2SO4 98% có D = 1,84 g/cm3)
- Tan vô hạn trong nước và tỏa nhiệt rất nhiều nhiệt.
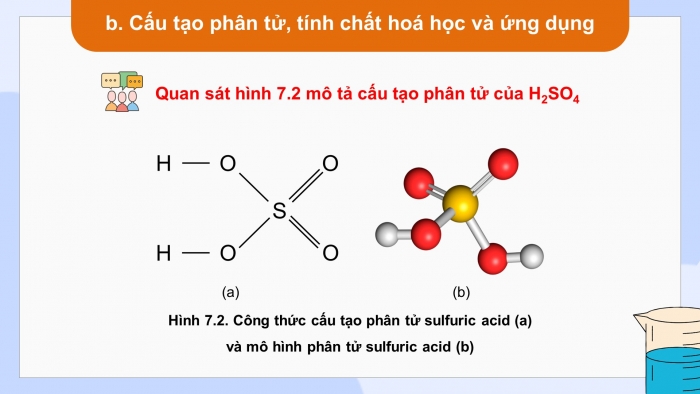
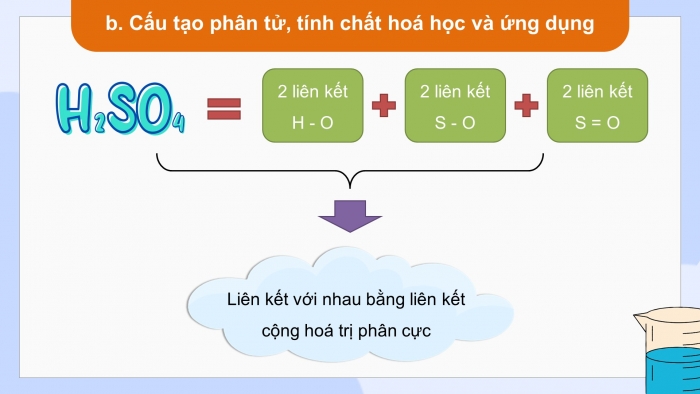
- Cấu tạo phân tử, tính chất hoá học và ứng dụng
Quan sát hình 7.2 mô tả cấu tạo phân tử của H2SO4
Dựa vào CTCT xác định số OXH của S trong acid, viết phương trình điện li của H2SO4 và dự đoán tính chất hoá học của H2SO4
- Số OXH của S là +6 cao nhất
- Chỉ có xu hướng giảm số OXH khi tham gia phản ứng hoá học.
- Có tính oxi hoá.
- Phương trình điện li
H2SO4 → H + + HSO4-
HSO4- ⇄ H+ + SO42- (Ka ≈ 10-2)
→ H2SO4 là acid mạnh
Tính acid
H2SO4 loãng có đầy đủ tính chất của một acid mạnh
Làm đổi màu quỳ tím thành đỏ.
Tác dụng với nhiều kim loại (Mg, Al, Zn, Fe,...) tạo thành muối sulfate và giải phóng khí H2.
H2SO4(loãng) + Mg → MgSO4 + H2 (↑)
Tác dụng với oxide base, base, muối của các acid yếu → muối sulfate:
H2SO4 + CuO → CuSO4 + H2O
Tính acid
- Hiện tượng: ở ống nghiệm (a) có kết tủa trắng.
- PTHH: Ba(OH)2 + H2SO4 → 2H2O + BaSO4↓
- Hiện tượng: ở ống nghiệm (b) sủi bọt khí
- PTTH: H2SO4 + Na2CO3 → H2O + Na2SO4 + CO2 ↑
Tính oxi hoá
Thí nghiệm 1: Phản ứng của dung dịch H2SO4 đặc, nóng với Cu
- Ống nghiệm, bông, kẹp ống nghiệm, đèn cồn, H2SO4 đặc, dd NaOH, mảnh đồng.
- Cần phải cẩn thận khi sử dụng acid H2SO4 đặc vì khí sinh ra độc.
- Khi đốt chú ý nút kín bình chứa bằng bông tẩm NaOH, hướng miệng ống nghiệm về phía không có người, đeo khẩu trang khi làm thí nghiệm.
- Hiện tượng: Mảnh đồng tan dần, xuất hiện, bọt khí mạnh và tạo dung dịch màu xanh.
- PTHH:
- Cu + 2H2SO4đ → CuSO4 + SO2↑+ 2H2O
Câu hỏi 4. Viết phương viết quá trình oxi hóa và quá trình khử trong phản ứng của dung dịch H2SO4 đặc với Cu ở thí nghiệm 1
Quá trình khử: S+6 + 2e → S+4
Quá trình oxi hoá: Cu0 → Cu+2 + 2e
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Giáo án điện tử hoá học 11 chân trời sáng tạo
ĐẦY ĐỦ GIÁO ÁN CÁC BỘ SÁCH KHÁC
GIÁO ÁN WORD LỚP 11 CHÂN TRỜI SÁNG TẠO
GIÁO ÁN POWERPOINT LỚP 11 CHÂN TRỜI SÁNG TẠO
GIÁO ÁN CHUYÊN ĐỀ 11 CHÂN TRỜI SÁNG TẠO
GIÁO ÁN DẠY THÊM 11 CHÂN TRỜI SÁNG TẠO
CÁCH ĐẶT MUA:
Liên hệ Zalo: Fidutech - nhấn vào đây
