Giáo án hóa học 8 VNEN soạn theo công văn 5512
Giáo án hay còn gọi là kế hoạch bài dạy(KHBD). Dưới đây là giáo án giảng dạy môn Hóa học 8 VNEN theo mẫu giáo án mới của Bộ Giáo dục - 5512. Bộ giáo án kenhgiaovien.com gửi tới thầy cô có đầy đủ tất cả các bài, các tiết. Thao tác tải về rất đơn giản, tài liệu file word có thể chỉnh sửa dễ dàng, mời quý thầy cô tham khảo bài demo. GA hoa 8 vnen cv 5512
Click vào ảnh dưới đây để xem giáo án rõ










Một số tài liệu quan tâm khác
Phần trình bày nội dung giáo án
Tuần:
Ngày soạn:
Ngày dạy:
Tiết:
Bài 3: OXI – KHÔNG KHÍ
- Mục tiêu
Sau khi học xong, HS có thể:
- Kiến thức
- Nêu được tính chất vật lí và tính chất hóa học của oxi
- Phát biểu được khái niệm sự oxi hóa, sự cháy, phản ứng hóa hợp, phản ứng phân hủy.
- Nêu được nguồn cung cấp oxi trong tự nhiên và phương pháp điều chế oxi trong phòng thí nghiệm
- Trình bày được thực trạng ô nhiễm môi trường, nguyên nhân và tác hại của ô nhiễm không khí.
- Nêu được trách nhiệm của công dân và của bản thân trong công việc thực hiện chính sách bảo vệ môi trường, chống ô nhiễm không khí.
- Kĩ năng
- Thông qua quan sát thí nghiệm, xác định được thành phần hóa học của không khí.
- Thái độ
- Đề xuất được các biện pháp phòng chống ô nhiễm không khí và có ý thức bảo vệ bầu khí quyển
- Ý thức bảo vệ môi trường, chống ô nhiễm môi trường.
- Định hướng năng lực – phẩm chất
- Năng lực chung: Năng lực tự học; Năng lực giải quyết vấn đề; Năng lực sáng tạo; Năng lực tự quản lý; Năng lực giao tiếp; Năng lực hợp tác; Năng lực sử dụng công nghệ thông tin và truyền thông;
- Năng lực chuyên biệt: Năng lực sử dụng ngôn ngữ hoá học; Năng lực thực hành hoá học; Năng lực tính toán hóa học; Năng lực giải quyết vấn đề thông qua môn hoá học; Năng lực vận dụng kiến thức hoá học vào cuộc sống.
- Phẩm chất: Nhân ái, khoan dung; Trung thực, tự trọng, chí công vô tư; Tự lập, tự tin, tự chủ và có tinh thần vượt khó; Có trách nhiệm với bản thân, cộng đồng, đất nước, nhân loại và môi trường tự nhiên.
- Chuẩn bị của GV - HS
- GV
- KHGD, Máy chiếu, PHT
a, Dụng cụ:
- Giá thí nghiệm cải tiến
- Ống nghiệm dày
- Ống dẫn cao su, ống dẫn thủy tinh, ống vuốt nhọn
- Đèn cồn
- Chậu thủy tinh
- Lọ thủy tinh có nút nhám
- Bông, diêm.
- Bình điện phân nước.
b, Hóa chất: KMnO4, Lọ đựng khí oxi được điều chế sẵn ( 3 lọ); bột S; bột P; dây sắt....
c, Bảng phụ: 2 cái
- HS
- Ôn tập một số thông tin về nguyên tố oxi.
- Nghiên cứu trước nội dung bài học.
- Ôn tập về viết PTHH, tính theo PTHH.
III. Phương pháp – kỹ thuật dạy học
- Phương pháp
- PP trò chơi;
- PP dạy học nhóm,
- PP giải quyết vấn đề;
- PP thuyết trình,
- PP thực hành thí nghiệm.
- Kỹ thuật:
- Kỹ thuật giao nhiệm vụ,
- KT đặt câu hỏi,
- Kỹ thuật động não,
- KT 321,
- KT phòng tranh.
- Tiến trình lên lớp
- Ổn định lớp (1p)
- Kiểm tra bài cũ
- Bài mới
Hoạt động của GV - HS | Nội dung cần đạt |
A. HOẠT ĐỘNG KHỞI ĐỘNG 1. Phương pháp: dạy học nhóm 2. Kĩ thuật: KT khăn chải bàn. 3. Năng lực: Năng lực tự quản lý; Năng lực giao tiếp; Năng lực hợp tác | |
GV: Yêu cầu HS hoạt động nhóm theo kỹ thuật khăn chải bàn trả lời 2 câu hỏi SHD: + Tại sao các nhà leo núi hoặc những người thợ lặn phải đeo các bình dưỡng khí hoặc các thiết bị đặc biệt? + Tại sao động vật sống dưới nước dễ gặp phải tình trạng thiếu oxi hơn động vật sống trên cạn? HS: Hoạt động cá nhân. Sau đó, thảo luận nhóm, thống nhất ý kiến và báo cáo kết quả. | A. Hoạt động khởi động + Khi leo núi: thì cơ thể phải hoạt động nhiều nên nhu cầu về oxi cao, lên cao thì không khí loãng... do đó thiếu oxi cung cấp cho cơ thể. + Con người không thở được dưới nước... + Trong nước oxi ít hơn so với trên cạn. |
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC 1. Phương pháp: PP dạy học nhóm; PP giải quyết vấn đề, PP thuyết trình, PP thực hành thí nghiệm. 2. Kĩ thuật: KT giao nhiệm vụ; KT đặt câu hỏi; KT động não; KT khăn chải bàn; KT phòng tranh. 3. Năng lực: Năng lực tự học; Năng lực sáng tạo; Năng lực tự quản lý; Năng lực giao tiếp; Năng lực hợp tác; Năng lực sử dụng ngôn ngữ hoá học; Năng lực thực hành hoá học; Năng lực giải quyết vấn đề thông qua môn hoá học; Năng lực vận dụng kiến thức hoá học vào cuộc sống. | |
GV: Cho cả lớp quan sát lọ đựng khí oxi. Yêu cầu HS thảo luận cặp đôi: + Đọc nội dung thông tin SHDH trang 15 và hoàn thành nội dung bảng 3.1. HS: Đọc nội dung trong tài liệu: + Thảo luận nhóm thống nhất ý kiến. + Đại diện các nhóm báo cáo. GV: nhận xét, chuẩn kiến thức | B. Hoạt động hình thành kiến thức I. TÍNH CHẤT CỦA OXI 1. Tính chất vật lí của oxi KHHH của nguyên tố oxi: O CTHH của đơn chất oxi : O2 NTK: 16 PTK: 32 Tính chất vật lí: + Trạng thái: oxi là chất khí + Màu sắc: không màu + Mùi vị: Không mùi + Khí oxi ít tan trong nước. + Nặng hơn không khí vì dO2/KK = 32/29. |
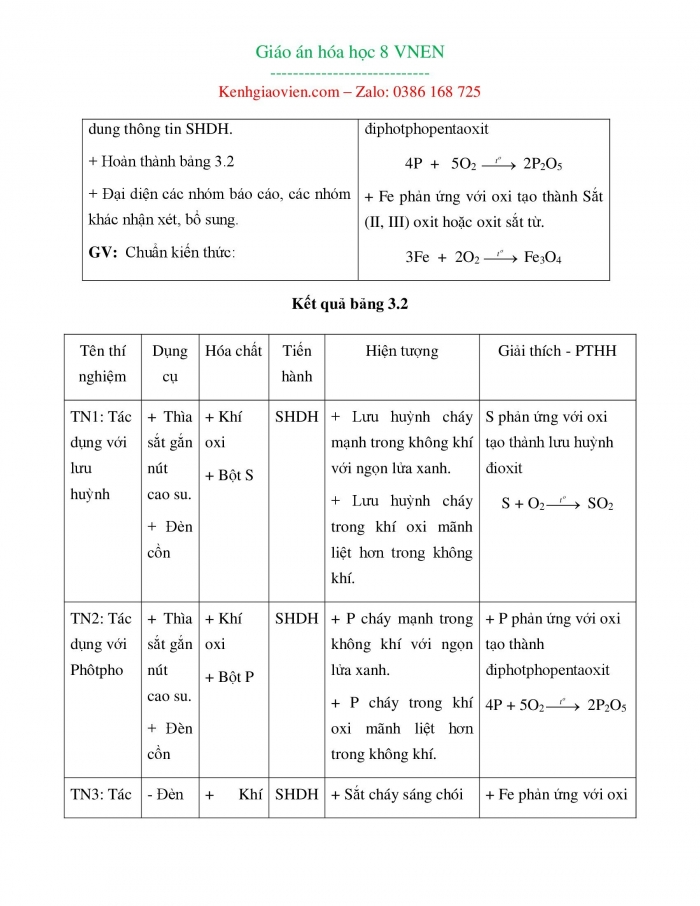
GV: Yêu cầu hs thảo luận nhóm nghiên cứu thông tin SHDH: + Chuẩn bị dụng cụ, hóa chất tiến hành thí nghiệm 1, 2, 3. + Hoàn thành phiếu học tập 3.2 + Đại diện các nhóm báo cáo. HS: Thảo luận nhóm, nghiên cứu nội dung thông tin SHDH. + Hoàn thành bảng 3.2 + Đại diện các nhóm báo cáo, các nhóm khác nhận xét, bổ sung. GV: Chuẩn kiến thức: | 2. Tính chất hóa học của oxi: a. Oxi tác dụng với phi kim và Kim loại + S phản ứng với oxi tạo thành lưu huỳnh đioxit S + O2 SO2 + P phản ứng với oxi tạo thành điphotphopentaoxit 4P + 5O2 2P2O5 + Fe phản ứng với oxi tạo thành Sắt (II, III) oxit hoặc oxit sắt từ. 3Fe + 2O2 Fe3O4 |
Kết quả bảng 3.2
Tên thí nghiệm | Dụng cụ | Hóa chất | Tiến hành | Hiện tượng | Giải thích - PTHH |
TN1: Tác dụng với lưu huỳnh | + Thìa sắt gắn nút cao su. + Đèn cồn | + Khí oxi + Bột S
| SHDH | + Lưu huỳnh cháy mạnh trong không khí với ngọn lửa xanh. + Lưu huỳnh cháy trong khí oxi mãnh liệt hơn trong không khí. | S phản ứng với oxi tạo thành lưu huỳnh đioxit S + O2 SO2 |
TN2: Tác dụng với Phôtpho | + Thìa sắt gắn nút cao su. + Đèn cồn | + Khí oxi + Bột P
| SHDH | + P cháy mạnh trong không khí với ngọn lửa xanh. + P cháy trong khí oxi mãnh liệt hơn trong không khí. | + P phản ứng với oxi tạo thành điphotphopentaoxit 4P + 5O2 2P2O5 |
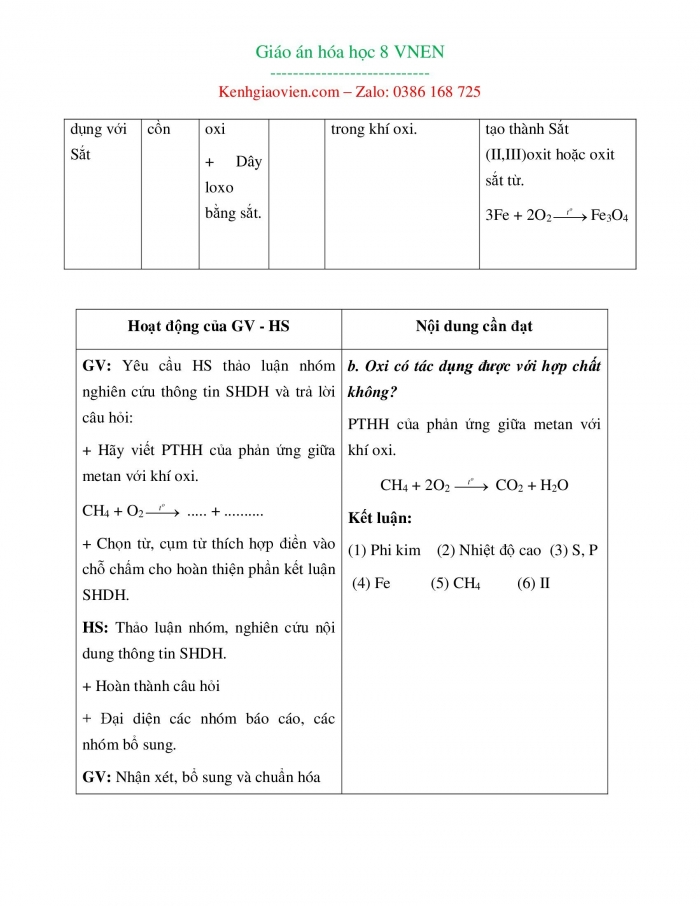
TN3: Tác dụng với Sắt | - Đèn cồn | + Khí oxi + Dây loxo bằng sắt.
| SHDH | + Sắt cháy sáng chói trong khí oxi.
| + Fe phản ứng với oxi tạo thành Sắt (II,III)oxit hoặc oxit sắt từ. 3Fe + 2O2Fe3O4 |
Hoạt động của GV - HS | Nội dung cần đạt |
GV: Yêu cầu HS thảo luận nhóm nghiên cứu thông tin SHDH và trả lời câu hỏi: + Hãy viết PTHH của phản ứng giữa metan với khí oxi. CH4 + O2 ..... + .......... + Chọn từ, cụm từ thích hợp điền vào chỗ chấm cho hoàn thiện phần kết luận SHDH. HS: Thảo luận nhóm, nghiên cứu nội dung thông tin SHDH. + Hoàn thành câu hỏi + Đại diện các nhóm báo cáo, các nhóm bổ sung. GV: Nhận xét, bổ sung và chuẩn hóa kiến thức. | b. Oxi có tác dụng được với hợp chất không? PTHH của phản ứng giữa metan với khí oxi. CH4 + 2O2 CO2 + H2O Kết luận: (1) Phi kim (2) Nhiệt độ cao (3) S, P (4) Fe (5) CH4 (6) II
|
GV: Yêu cầu HS thảo luận nhóm nghiên cứu thông tin SHDH và trả lời câu hỏi: + Sự oxi hóa một chất là gì? + Hoàn thành bài tập điền từ. HS: Hoạt động cá nhân nghiên cứu nội dung thông tin SHDH. + Hoạt động nhóm hoàn thành câu hỏi + Đại diện các nhóm báo cáo, các nhóm khác bổ sung. GV: Nhận xét và chuẩn kiến thức. | II. SỰ OXI HÓA – PHẢN ỨNG HÓA HỢP 1. Sự oxi hóa Sự oxi hóa là sự tác dụng của oxi với một chất (chất đó có thể là đơn chất hoặc hợp chất) |
GV: Yêu cầu HS thảo luận nhóm nghiên cứu thông tin SHDH : + Hãy nhận xét, ghi số chất phản ứng và số chất sản phẩm trong các phản ứng hóa học sau đây (Bảng 1 số PƯHH) và trả lời câu hỏi sau: + So sánh điểm giống và khác nhau về số chất tham gia phản ứng và số chất sản phẩm trong các phản ứng hóa học trên? + Phản ứng hóa hợp là gì? HS: Hoạt động cá nhân đọc thông tin SHDH + Hoạt động nhóm chia sẻ, trả lời câu hỏi. + Đại diện nhóm trình bày câu trả lời, các nhóm khác nhận xét và góp ý bổ sung. GV: Nhận xét và chuẩn kiến thức. GV: Yêu cầu học sinh đọc kĩ phần lưu ý (SHDH trang 26) | 2. Phản ứng hóa hợp
Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất được tạo thành từ hai hay nhiều chất ban đầu. |
Bảng 1 PƯHH
Phản ứng hóa học | Số chất PƯ | Số chất SP |
4P + 5O2 2P2O5 | 2 | 1 |
3Fe + 2O2 Fe3O4 | 2 | 1 |
CaO + H2O Ca(OH)2 | 2 | 1 |
CO2 + H2O + CaCO3 Ca(HCO3)2 | 3 | 1 |
Hoạt động của GV - HS | Nội dung cần đạt | ||||||||||||||||||
GV: Yêu cầu HS hoạt động cá nhân, thảo luận nhóm và thực hiện một trong hai nhiệm vụ SHD trang 18, 19. Nhóm 1, 2: Thực hiện nhiệm vụ 1 Nhóm 3, 4: Thực hiện nhiệm vụ 2. · Nhiệm vụ 1 Nhóm 1, 2 HS: Hoạt động cá nhân đọc thông tin và trả lời câu hỏi. + Hoạt động nhóm chia sẻ kết quả hoạt động cá nhân + Đại diện nhóm trình bày kết quả, các nhóm khác nhận xét, bổ sung GV: Tổng kết, chuẩn hóa kiến thức
· Nhiệm vụ 2 | III. ỨNG DỤNG CỦA OXI Nhiệm vụ 1 Câu 1: Ứng dụng của oxi: Dùng cho sự hô hấp và sự đốt nhiên liệu Câu 2: Khí oxi được cơ thể lấy vào để oxi hóa chất dinh dưỡng trong cơ thể người và động vật. Sự oxi hóa này diễn ra liên tục trong suốt quá trình sống, sinh ra khí cacbonic và năng lượng. Nguồn năng lượng này dùng để duy trì sự sống của cơ thể. Không có oxi người và động vật không sống được. Câu 3: Biện pháp giữ gìn và bảo vệ hệ hô hấp: + Cần tích cực xây dựng môi trường sống và làm việc bầu không khí trong sạch, ít ô nhiễm bằng các biện pháp như: trồng nhiều cây xanh, không xả rác bừa bãi, không hút thuốc lá…. + Đeo khẩu trang chống bụi khi làm vệ sinh hay khi hoạt động ở môi trường nhiều bụi. + Cần tích cực rèn luyện để có một hệ hô hấp khỏe mạnh bằng luyện tập thể dục thể thao phối hợp tập thở sâu và giảm nhịp thở thường xuyên, từ bé. Nhiệm vụ 2 Câu 1: Vai trò của oxi trong sự cháy: Oxi hóa nhiên tỏa ra nhiều nhiệt Câu 2: Các ứng dụng sử dụng quá trình đốt cháy nhiên liệu trong đời sống: + Đèn xì oxi- axetilen; + Phá đá bằng hỗn hợp nổ chứa oxi lỏng; + Oxi lỏng dùng để đốt nhiên liệu tên lửa và tàu vũ trụ; + Lò luyện gang dùng không khí giàu oxi….. Câu 3: Nhiên liệu cháy thải ra môi trường lượng khí thải (CO2, SO2, khói bụi...) lớn gây ô nhiễm môi trường.
| ||||||||||||||||||
GV nêu câu hỏi cho HS thảo luận: + Những chất như thế nào có thể được dùng làm nguyên liệu để điều chế oxi trong PTN. + Hãy kể tên những chất mà trong thành phần có nguyên tố oxi. Trong những chất trên những chất nào kém bền và dễ bị phân huỷ. HS: Thảo luận và trả lời câu hỏi. GV: Giới thiệu nguyên liệu, sản lượng và giá thành và cách điều chế khí oxi trong phòng thí nghiệm. GV làm thí nghiệm: Điều chế khí oxi bằng cách đun nóng KMnO4 và KClO3 có chất xúc tác là MnO2. + Gọi 1 HS viết PTPƯ + Biết khí oxi nặng hơn không khí và tan ít trong nước, có thể thu khí oxi bằng những cách nào? HS: Quan sát GV làm thí nghiệm và trả lời câu hỏi GV: Tổng kết và chuẩn hóa kiến thức. | IV. ĐIỀU CHẾ OXI – PHẢN ỨNG PHÂN HỦY 1. Điều chế khí oxi trong phòng thí nghiệm: Nguyên liệu: + Hợp chất giàu oxi. + Dễ bị phân huỷ ở nhiệt độ cao: KMnO4, KClO3….
Thí nghiệm: + PTHH: 2KMnO4 K2MnO4 + MnO2 + O2. 2KClO3 2KCl + 3O2. Cách thu khí oxi: + Bằng cách đẩy không khí. + Bằng cách đẩy nước. Kết luận: Trong PTN, khí oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân huỷ ở nhiệt độ cao như: KMnO4và KClO3. | ||||||||||||||||||
GV: Cho HS nhận xét các PƯHH có trong bài và điền vào chổ còn trống. HS: Hoạt động cá nhân. Điền từ/cụm từ thích hợp vào chỗ chấm (Tài liệu SHDH) GV thông báo: Những PƯHH trên đây thuộc loại phản ứng phân huỷ và yêu cầu HS trả lời câu hỏi: + Vậy phản ứng phân huỷ là gì? + Hãy so sánh phản ứng hoá hợp và phản ứng phân huỷ và điền vào bảng sau:
HS: Thảo luận và trả lời câu hỏi. | 2. Phản ứng phân huỷ VD: 2KMnO4 K2MnO4 + MnO2 + O2. 2KClO3 2KCl + 3O2. 2H2O 2H2 + O2 Kết luận: Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra hai hay nhiều chất mới.
| ||||||||||||||||||
GV biểu diễn thí nghiệm: + Đốt P đỏ (dư) ngoài không khí rồi đưa nhanh vào ống hình trụ và đậy kín miệng ống bằng nút cao su.( Hình 3.4 – Tr.21) GV: Yêu cầu HS quan sát và trả lời câu hỏi: + Mực nước trong ống thuỷ tinh thay đổi như thế nào khi P cháy? + Chất nào ở trong ống đã tác dụng với P để tạo ra khói trắng P2O5 đã tan dần trong nước? + Oxi trong không khí đã phản ứng hết chưa? Vì sao? (Vì P dư nên oxi trong kk p/ư hết. Vì vậy áp suất trong ống giảm, do đó nước dâng lên) + Nước dâng lên đến vạch số 2 chứng tỏ điều gì? + Tỉ lệ thể tích chất khí còn lại trong ống là bao nhiêu? Khí còn lại là khí gì? Tại sao? + Từ đó em hãy rút ra KL về thành phần của không khí. HS: Quan sát thí nghiệm, thảo luận nhóm trả lời các câu hỏi. + Đại diện nhóm báo cáo kết quả, các nhóm khác nhận xét, góp ý bổ sung. GV: Chuẩn hóa kiến thức | V. KHÔNG KHÍ – SỰ CHÁY 1. Thành phần của không khí: a. Thí nghiệm xác định thành phần của không khí Không khí là một hỗn hợp khí trong đó: + Khí oxi chiếm khoảng 1/5 về thể tích. (Chính xác là khoảng 21% về Vkk) + Phần còn lại hầu hết là khí nitơ. | ||||||||||||||||||
GV: Đặt câu hỏi cho HS thảo luận + Theo em trong không khí còn có những chất gì? Tìm các dẫn chứng để chứng minh. + Trả lời các câu hỏi trong SHDH. HS: + Hoạt động cá nhân đọc thông tin SHDH + Hoạt động cặp đôi chia sẻ kết quả + Đại diện một số nhóm trình bày câu trả lời, các nhóm khác nhận xét và góp ý GV: Nhận xét, tổng kết | b. Ngoài khí oxi và khí nitơ, không khí còn chứa những chất nào khác? Kết luận: Trong không khí ngoài khí oxi và khí nitơ; còn có hơi nước, khí cacbonic, một số khí hiếm như Ne, Ar, bụi khói...các chất này chiếm khoảng 1% thể tích không khí. | ||||||||||||||||||
GV: Yêu cầu các nhóm quan sát các hình ảnh, thảo luận và trả lời câu hỏi. + Không khí bị ô nhiểm gây ra những tác hại như thế nào. + Chúng ta nên làm gì để bảo vệ bầu không khí trong lành, tránh ô nhiểm. HS: + Hoạt động theo nhóm, quan sát hình, thảo luận và trả lười các câu hỏi. + Đại diện nhóm trình bày câu trả lời, các nhóm khác nhận xét và góp ý. GV: Tổng kết kiến thức GV: Giới thiệu thêm một số tư liệu, tranh ảnh về vấn đề ô nhiểm không khí và cách giữu cho không khí trong lành. | c. Nguyên nhân gây ô nhiễm không khí và biện pháp bảo vệ nguồn không khí trong lành, tránh ô nhiễm. - Không khí bị ô nhiểm sẽ ảnh hưởng đến sức khỏe của con người và đời sống của mọi sinh vật. - Biện pháp bảo vệ: Xử lí các khí thải, trồng và bảo vệ cây xanh. | ||||||||||||||||||
GV yêu cầu HS: + Hoạt động cá nhân đọc thông tin trong SHDH trang 22 + Thảo luận nhóm trả lời câu hỏi HS: Thảo luận nhóm và trả lời câu hỏi. + Đại diện nhóm báo cáo. Các nhóm nhận xét, bổ sung. GV yêu cầu HS trả lời câu hỏi: + Sự cháy của một chất trong oxi và trong không khí có gì giống và khác nhau ? Giải thích ? + Em hãy lấy ví dụ về sự cháy ? HS: Thảo luận và phát biểu GV: Tổng kết kiến thức GV yêu cầu thảo luận nhóm: + Đọc sách HDH, nêu định nghĩa về sự oxi hóa chậm. + Cho ví dụ. + Nêu sự giống và khác nhau và sự cháy và sự oxi hóa chậm. HS: Thảo luận nhóm và trả lời câu hỏi. + Đại diện nhóm báo cáo. + Các nhóm nhận xét, bổ sung. GV: Nhận xét và tổng kết kiến thức. | 2. Sự cháy và sự oxi hóa chậm: a. Sù cháy Kết luận: Sự cháy là sự oxi hoá có toả nhiệt và phát sáng. VD: lưu huỳnh, photpho cháy trong oxi. + Giống: đều là sự oxi hoá + Khác: sự cháy trong oxi xảy ra mãnh liệt hơn sự cháy trong không khí.
b. Sự oxi hoá chậm: Là sự oxi hoá có toả nhiệt nhưng không phát sáng. VD: Dao để lâu ngoài không khí sẽ bị gỉ. - Sự giống và khác nhau giữa sự cháy và sự oxi hoá chậm : + Giống nhau: Đều là sự oxi hoá có toả nhiệt. + Khác nhau: · Sự cháy: Phát sáng Sự oxi hoá chậm: Không phát sáng. | ||||||||||||||||||
GV: Yêu cầu HS nghiên cứu thông tin SHDH trang 23 và thảo luận nhóm trả lời câu hỏi: + Muốn dập tắt ngọn lửa do xăng dầu cháy, người ta thường trùm vải dày hoặc phủ cát lên ngọn lửa mà không dùng nước. Giải thích? HS: Hoạt động nhóm, thảo luận thống nhất ý kiến, báo cáo kết quả. GV: Yêu cầu HS hoạt động cá nhân đọc phần Kết luận SHDH trang 23 HS: Đọc kết luận | 3. Điều kiện phát sinh và các biện pháp để dập tắt sự cháy + Do xăng dầu nhẹ hơn nước, nhiệt độ cháy thấp. + Phủ cát, vải lên để ngăn cách không cho xăng dầu tiếp xúc với oxi trong KK | ||||||||||||||||||
C. HOẠT ĐỘNG LUYỆN TẬP 1. Phương pháp: Luyện tập, PP giải quyết vấn đề, PP thuyết trình. 2. Kĩ thuật: KT giao nhiệm vụ; KT đặt câu hỏi; Sơ đồ tư duy 3. Năng lực: Năng lực tự học; Năng lực sáng tạo; Năng lực tính toán; Năng lực tự quản lý; Năng lực sử dụng ngôn ngữ hoá học; Năng lực giải quyết vấn đề thông qua môn hoá học; Năng lực vận dụng kiến thức hoá học vào cuộc sống. | |||||||||||||||||||
GV: Yêu cầu HS hoạt động cặp đôi làm bài tập 1, 2 SHDH trang 24 HS: Thảo luận nhóm làm bài tập. Đại diện nhóm trình bày câu trả lời. Các nhóm khác nhận xét. GV: Nhận xét, đánh giá kết quả của HS
GV: Yêu cầu HS hoạt động cá nhân làm bài tập 3 HS: Hoạt động cá nhân nghiên cứu sau đó trao đổi với các bạn trong nhóm để làm bài GV: Kiểm tra, đánh giá kết quả của HS
GV: Yêu cầu HS: + Hoạt động cá nhân nghiên cứu bài 4,5 – đưa ra hướng giải quyết + Hoạt động nhóm, trao đổi với các bạn giải quyết bài toán HS: Hoạt động cá nhân viết bài và lên đóng vai trả lời GV: nhận xét, đánh giá kết quả của HS.
GV: Yêu cầu HS hoạt động cá nhân làm bài 6 HS: Hoạt động, trao đổi với bạn GV: Yêu cầu HS hoạt động cặp đôi hoàn thành bài 7 HS: Thảo luận và đại diện các nhóm trình bày câu trả lời. GV: Nhận xét, đánh giá HS | C. Hoạt động luyện tập Bài 1: Sử dụng bình oxi để thở trong các trường hợp: Leo lên núi cao, xuống các hang động nằm sâu trong long đất, xuống các hầm mỏ, bơi dưới nước, bệnh nhân khó thở ….. Bài 2: Cách 2,3: vì làm tăng diện tích tiếp xúc của củi với không khí Bài 3: 2Ca + O2 ® 2CaO 4Al + 3O2 2Al2O3 2Zn + O2 2ZnO 2Cu + O2 2CuO C + O2 CO2 S + O2 SO2 4P + 5O2 2P2O5 Bài 4: a, PTHH: C3H8 + 5O2 3CO2 + 4H2O (1) 1 mol 3 mol 2C4H10 + 13O2 8CO2 + 10H2O (2) 2 mol 8 mol b, Khối lượng C3H8 có trong 1kg gas là: m = = 264 (g) Số mol C3H8 là: n = = 6 (mol) Theo PTHH (1) => số mol CO2 là: 6.3 = 18 (mol) Khối lượng C4H10 có trong 1kg gas là: m = = 696 (g) Số mol C3H8 là: n = = 12 (mol) Theo PTHH (2) => số mol CO2 là: = 48 (mol) => Tổng số mol CO2 sinh ra khi đốt cháy hết 1kg gas là: 48 + 18 = 66 (mol) Thể tích CO2 thoát ra ở điều kiện thường là: V = 66.24 = 1584 (lít) Bài 5: PTHH: 2KMnO4 K2MnO4 + MnO2 + O2 2 mol 1 mol Tổng thể tích khí O2 dùng cho thí nghiệm là: 12.200 = 2400 (ml) = 2,4 (l) Số mol CO2 là: n = 2,4 : 24 = 0,1 (mol) Theo PTHH số mol KMnO4 cần dùng là: 2.0,1 = 0,2 (mol) => Khối lượng KMnO4 cần dùng là: 0,2.158 = 31,6 (g) Bài 6 Bài 7 | ||||||||||||||||||
D. HOẠT ĐỘNG VẬN DỤNG 1. Phương pháp: PP giải quyết vấn đề, PP thuyết trình; đàm thoại – gợi mở 2. Kĩ thuật: KT giao nhiệm vụ; KT đặt câu hỏi. 3. Năng lực: Năng lực tự học; Năng lực sáng tạo; Năng lực giao tiếp; Năng lực hợp tác; Năng lực tính toán; Năng lực sử dụng ngôn ngữ hoá học; Năng lực giải quyết vấn đề thông qua môn hoá học; Năng lực vận dụng kiến thức hoá học vào cuộc sống. 4. Phẩm chất: Trung thực, tự trọng, chí công vô tư; Tự lập, tự tin, tự chủ và có tinh thần vượt khó. | |||||||||||||||||||
GV: Yêu cầu HS hoạt động cá nhân tìm hiểu nội dung câu hỏi SHDH. + Yêu cầu HS hỏi người thân, trao đổi với các bạn trong lớp để trả lời câu hỏi + Yêu cầu HS treo, để sản phẩm lên giá sách để chia sẻ với lớp HS: Thảo luận chia sẻ kết quả | D. Hoạt động vận dụng | ||||||||||||||||||
E. HOẠT ĐỘNG TÌM TÒI MỞ RỘNG 1. Phương pháp: PP giải quyết vấn đề, PP thuyết trình; đàm thoại – gợi mở 2. Kĩ thuật: KT giao nhiệm vụ; KT đặt câu hỏi. 3. Năng lực: Năng lực tự học; Năng lực sáng tạo; Năng lực giao tiếp; Năng lực hợp tác; Năng lực sử dụng ngôn ngữ hoá học; Năng lực giải quyết vấn đề thông qua môn hoá học; Năng lực vận dụng kiến thức hoá học vào cuộc sống; Năng lực sử dụng CNTT - TT. 4. Phẩm chất: Trung thực, tự trọng, chí công vô tư; Tự lập, tự tin, tự chủ và có tinh thần vượt khó. | |||||||||||||||||||
GV: Yêu cầu HS sử dụng mạng internet tìm hiểu 2 câu hỏi SHDH. + Yêu cầu HS viết bài về 2 câu hỏi đó HS: báo cáo kết quả của mình trước lớp hoặc chia sẻ với các bạn trong lớp | E. Hoạt động tìm tòi mở rộng | ||||||||||||||||||

Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Tài liệu giảng dạy môn Hóa học THCS
