Giáo án và PPT Hoá học 11 cánh diều Bài 6: Sulfur và sulfur dioxide
Đồng bộ giáo án word và powerpoint (ppt) Bài 6: Sulfur và sulfur dioxide. Thuộc chương trình Hoá học 11 cánh diều. Giáo án được biên soạn chỉnh chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word





Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 cánh diều
BÀI 6: SULFUR VÀ SULFUR DIOXIDE
HOẠT ĐỘNG KHỞI ĐỘNG
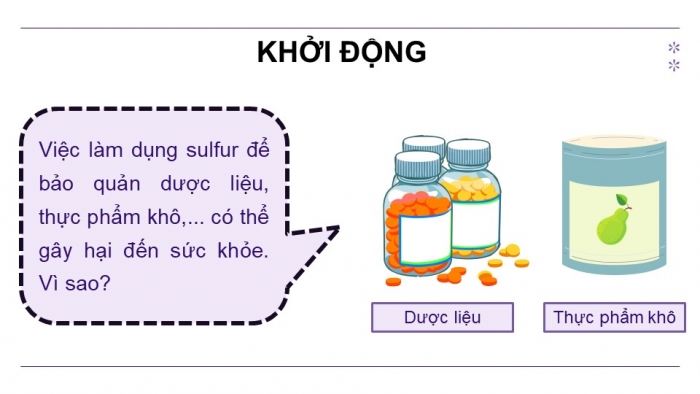
GV yêu cầu HS thảo luận và trả lời:
Việc làm dụng sulfur để bảo quản dược liệu, thực phẩm khô,... có thể gây hại đến sức khỏe. Vì sao?
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
I. SULFUR
Hoạt động 1: Trạng thái tự nhiên
HS thảo luận trả lời câu hỏi:
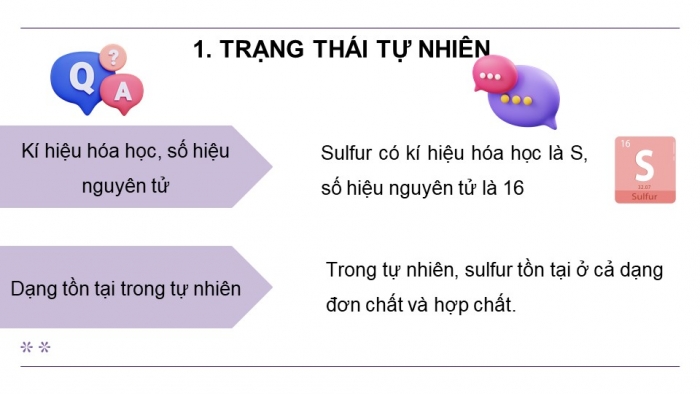
- Em hãy cho biết kí hiệu hoá học, số hiệu nguyên tử của sulfur.
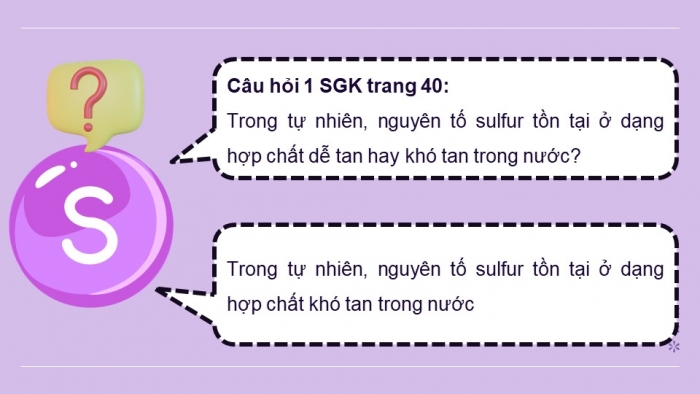
- Trong tự nhiên, sulfur tồn tại ở dạng nào?
Sản phẩm dự kiến:
- Sulfur có kí hiệu hóa học là S, số hiệu nguyên tử là 16
- Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất.
Hoạt động 2: Tính chất
HS thảo luận trả lời câu hỏi:
* Tính chất vật lí
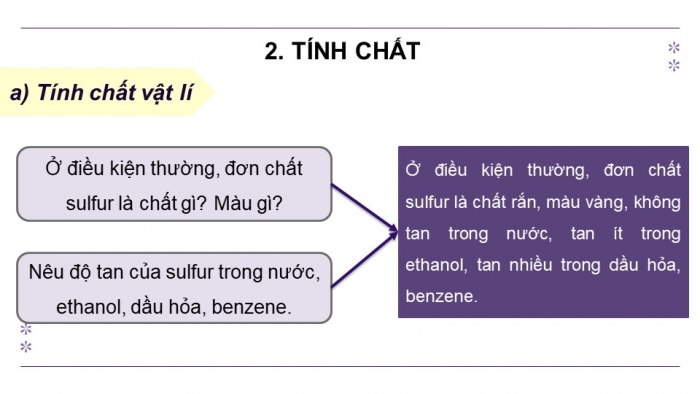
- Ở điều kiện thường, đơn chất sulfur là chất gì? Màu gì?
- Nêu độ tan của sulfur trong nước, ethanol, dầu hỏa, benzene.
* Tính chất hoá học
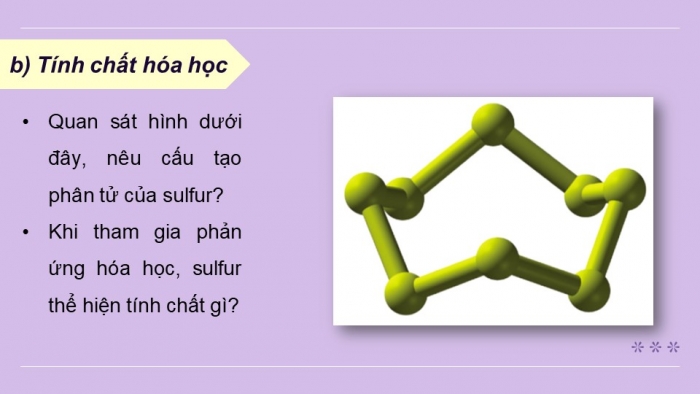
- Em hãy nêu cấu tạo phân tử của sulfur.
- Khi tham gia phản ứng hóa học, sulfur thể hiện tính chất gì?
* Tính oxi hoá và tính khử:
- Em hãy chứng minh sulfur đơn chất vừa có tính oxi hoá (tác dụng với kim loại), vừa có tính khử (tác dụng với oxy gen)
Sản phẩm dự kiến:
* Tính chất vật lí
- Ở điều kiện thường, đơn chất sulfur là chất rắn, màu vàng, không tan trong nước, tan ít trong ethanol, tan nhiều trong dầu hỏa, benzene.
* Tính chất hóa học
- Ở điều kiện thường, phân tử đơn chất sulfur gồm 8 nguyên tử S.
- Khi tham gia phản ứng hóa học, sulfur thể hiện tính oxi hóa hoặc tính khử
* Tính oxi hóa
- Sulfur phản ứng với nhiều kim loại, với hydrogen tạo ra các hợp chất sulfide
Ví dụ:
- Sulfur phản ứng với thủy ngân (mercury) ngay ở nhiệt độ thường:
 Có thể dùng sulfur để loại bỏ thủy phân rơi vãi khi nhiệt kế thủy ngân bị vỡ
Có thể dùng sulfur để loại bỏ thủy phân rơi vãi khi nhiệt kế thủy ngân bị vỡ
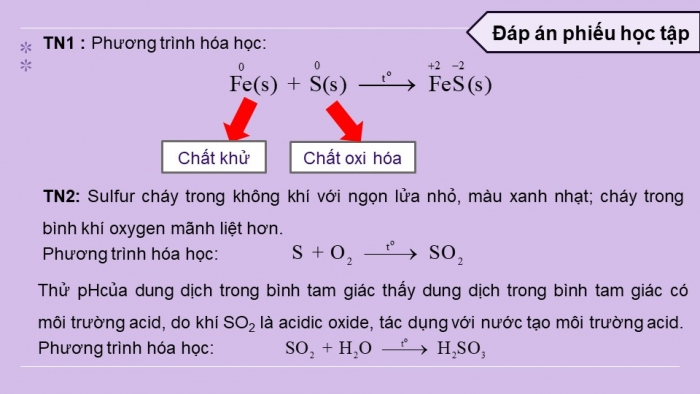
Trong các phản ứng trên, số oxi hóa của sulfur giảm từ 0 xuống –2.
* Tính khử
- Ở nhiệt độ thích hợp, sulfur phản ứng với một số phi kim như oxygen, chlorine, fluorine. Trong các phản ứng đó, số oxi hóa của sulfur tăng
- Ví dụ:
Hoạt động 3: Ứng dụng
HS thảo luận trả lời câu hỏi:
Em hãy trình bày ứng dụng của sulfur.
Sản phẩm dự kiến:
- Sản xuất sulfuric acid, dược phẩm, phẩn nhuộm, thuốc trừ sâu
- Lưu hóa cao su
- Diệt vi khuẩn và nấm mốc
II. SULFUR DIOXIDE
Hoạt động 1: Một số tính chất
HS thảo luận trả lời câu hỏi:
Em hãy trình bày một số tính chất của sulfur dioxide và nêu một số ví dụ cụ thể.
Sản phẩm dự kiến:
- Ở điều kiện thường, sulfur dioxide (SO2) là chất khí không màu, có mùi hắc, độc và tan nhiều trong nước.
- Sulfur dioxide thể hiện các tính chất của một oxide acid
- Sulfur còn thể hiện cả tính oxi hóa và tính khử
- Ví dụ:
Hoạt động 2: Ứng dụng
HS thảo luận trả lời câu hỏi:
Em hãy trình bày ứng dụng của sulfur dioxide.
Sản phẩm dự kiến:
- Sulfur dioxide là chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
- Dùng để tẩy trắng vải sợi, đường; sản xuất thuốc trừ sâu và thuốc sát trùng.
Hoạt động 3: Một số biện pháp làm giảm phát thải sulfur dioxide vào khí quyển
HS thảo luận trả lời câu hỏi:
- Em hãy cho biết tác hại của sulfur dioxide đối với môi trường và đối với con người.
- Sulfur dioxide phát sinh từ đâu?
- Nêu một số biện pháp giảm thiểu lượng sulfur dioxide vào không khí.
Sản phẩm dự kiến:
*Tác hại
- Đối với môi trường, khí SO2 là nguyên nhân chủ yếu gây ra mưa acid.
- Đối với con người, khí SO2 tạo cảm giác khó thở, gây bệnh viêm đường hô hấp; khi vào cơ thể kết hợp với nước tạo acid làm giảm pH của máu.
*Nguồn phát sinh SO2:
- Núi lửa hoạt động
- Đốt cháy nhiên liệu
- Quá trình sản xuất sulfuric acid
*Biện pháp làm giảm sulfur dioxide:
- Thay thế dần các nhiên liệu hóa thạch bằng nhiên liệu thân thiện môi trường, kết hợp khai thác nguồn năng lượng tái tạo.
- Dẫn khí thải của các nhà máy vào tháp hoặc bồn chứa các chất hấp phụ phù hợp.
- Chuyển hóa sulfur dioxide thành các chất ít gây ô nhiễm hơn bằng các hóa chất như vôi sống, vôi tôi hoặc đá vôi nghiền.
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Khi phản ứng với kim loại, sulfur thể hiện tính chất gì?
A. tính khử.
B. tính oxi hóa.
C. vừa tính oxi hóa, vừa tính khử.
D. tính lưỡng tính
Câu 2: Ứng dụng nào sau đây không phải của S ?
A. Làm nguyên liệu sản xuất Sulfuric acid.
B. Làm chất lưu hóa cao su.
C. Khử chua đất.
D. Điều chế thuốc súng đen.
Câu 3: Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a : b bằng
A. 3 : 2.
B. 1 : 1.
C. 2 : 1.
D. 3 : 1.
Sản phẩm dự kiến:
Câu 1: B
Câu 2: C
Câu 3: C
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Hấp thụ 0,15 mol khí SO2 vào 200 ml dung dịch NaOH aM. Tính a biết sau phản ứng chỉ thu được muối trung hòa.
Câu 2: Dẫn khí SO2 qua 200 ml dung dịch Ba(OH)2 aM thu được 21,7 g kết tủa, thêm tiếp dung dịch NaOH đến dư vào lại thu thêm 10,85 gam kết tủa nữa. Tính a
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 cánh diều
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 KẾT NỐI TRI THỨC
Giáo án hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 11 kết nối tri thức
Giáo án chuyên đề Hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 kết nối tri thức
Trò chơi khởi động Hoá học 11 kết nối tri thức
Câu hỏi và bài tập trắc nghiệm hóa học 11 kết nối tri thức
Đề thi hóa học 11 kết nối tri thức
File word đáp án hóa học 11 kết nối tri thức
Bài tập file word Hóa học 11 kết nối tri thức
Kiến thức trọng tâm hóa học 11 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 11 kết nối tri thức
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 kết nối tri thức
Phiếu học tập theo bài Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CHÂN TRỜI SÁNG TẠO
Giáo án hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 11 chân trời sáng tạo
Giáo án chuyên đề Hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 11 chân trời sáng tạo
Trò chơi khởi động Hoá học 11 chân trời sáng tạo
Câu hỏi và bài tập trắc nghiệm hóa học 11 chân trời sáng tạo
Đề thi hóa học 11 chân trời sáng tạo
File word đáp án hóa học 11 chân trời sáng tạo
Bài tập file word hóa học 11 chân trời sáng tạo
Kiến thức trọng tâm hóa học 11 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 11 chân trời sáng tạo
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CÁNH DIỀU
Giáo án hoá học 11 cánh diều đủ cả năm
Giáo án điện tử hoá học 11 cánh diều
Giáo án chuyên đề Hóa học 11 cánh diều đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 cánh diều
Trò chơi khởi động Hoá học 11 cánh diều
Câu hỏi và bài tập trắc nghiệm hóa học 11 cánh diều
Đề thi hóa học 11 cánh diều
Bài tập file word Hóa học 11 cánh diều
File word đáp án hóa học 11 cánh diều
Kiến thức trọng tâm hóa học 11 cánh diều
Đề kiểm tra 15 phút Hoá học 11 cánh diều
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 cánh diều
Phiếu học tập theo bài Hoá học 11 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 11 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 cánh diều cả năm
