Giáo án và PPT Hoá học 11 cánh diều Bài 7: Sulfuric acid và muối sulfate
Đồng bộ giáo án word và powerpoint (ppt) Bài 7: Sulfuric acid và muối sulfate. Thuộc chương trình Hoá học 11 cánh diều. Giáo án được biên soạn chỉnh chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word







Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 cánh diều
BÀI 7: SULFURIC ACID VÀ MUỐI SULFATE
HOẠT ĐỘNG KHỞI ĐỘNG
GV yêu cầu HS thảo luận và trả lời:
Nhãn dán trên chai đựng dung dịch sulfuric acid thường có hình như Hình 7.1. Giải thích ý nghĩa của hình và nguyên nhân gây nên hiện tượng được mô tả trong hình.
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
I. SUNFURIC ACID
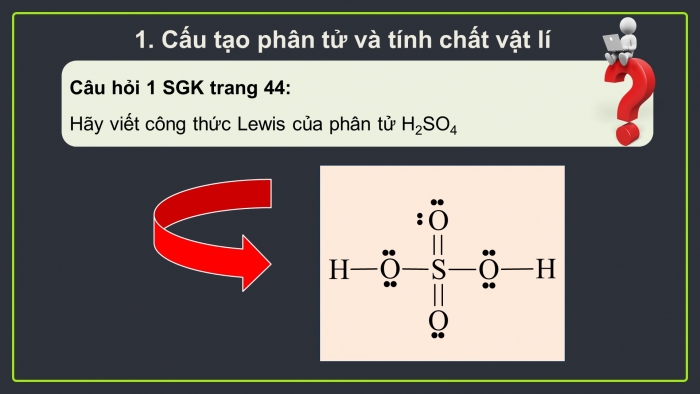
Hoạt động 1: Cấu tạo phân tử và tính chất vật lí
HS thảo luận trả lời câu hỏi:
Phân tử H2SO4 có cấu tạo như thế nào?
Em hãy nêu tính chất vật lí của phân tử H2SO4
Sản phẩm dự kiến:
- Sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi.
- Dung dịch sulfuric acid đặc có khả năng hút ẩm nên thường được dùng để làm khô hóa chất.
- Sulfuric acid tan tốt trong nước; quá trình hòa tan tỏa ra một lượng nhiệt lớn.
Hoạt động 2: Tính chất hóa học
HS thảo luận trả lời câu hỏi:
Em hãy mô tả hiện tượng trong thí nghiệm 1. Viết phương trình hoá học minh hoạ và xác định vai trò của mỗi chất phản ứng,
Em hãy nêu các tính chất của sulfuric acid.
Số oxi hóa lớn nhất cua sulfur trong các hợp chất là +6. Vậy H2SO4 có khả năng thể hiện tính khử không? Giải thích.
Em hãy cho biết tính oxi hoá mạnh của sulfuric acid, viết phương trình hoá học khi cho dung dịch sulfuric acid đặc tắc dụng với S và KBr.
Em hãy mô tả hiện tượng trong thí nghiệm 2. Giải thích và viết phương trình hoá học.
Sản phẩm dự kiến:
Thí nghiệm 1. Tính oxi hóa của dung dịch sulfuric acid loãng và dung dịch sulfuric acid đặc
Hiện tượng:
- Ống nghiệm 1: Không thấy xuất hiện hiện tượng gì
- Ống nghiệm 2: Mảnh đồng tan dần, có khí không màu thoát ra, sau phản ứng thu được dung dịch có màu xanh
Phương trình hóa học:
H2SO4 đóng vai trò là chất oxi hóa
Cu đóng vai trò là chất khử
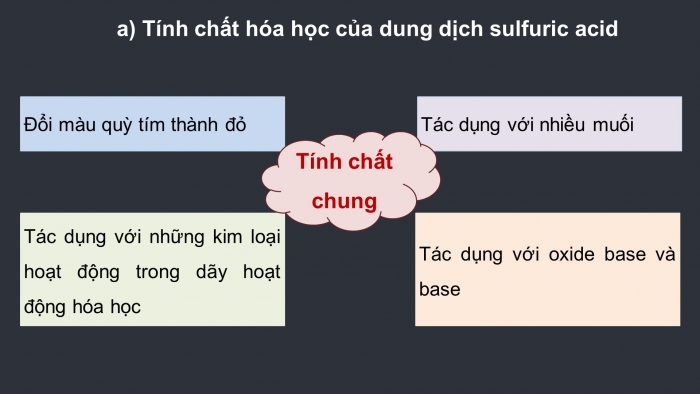
* Tính chất hóa học của dung dịch sulfuric acid
Dung dịch sulfuric acid loãng có các tính chất chung của một acid:
- Đổi màu quỳ tím thành đỏ
- Tác dụng với những kim loại hoạt động trong dãy hoạt động hóa học
- Tác dụng với oxide base và base
- Tác dụng với nhiều muối
Trong hợp chất H2SO4, sulfur có số oxi hóa là +6, đây là số oxi hóa cao nhất của sulfur do đó H2SO4 không thể hiện tính khử
* Tính chất hóa học của dung dịch sulfuric acid đặc
Tính oxi hóa mạnh
Dung dịch sulfuric acid đặc có tính oxi hóa rất mạnh; oxi hóa được hầu hết các kim loại (trừ vàng, platinum); nhiều phi kim và hợp chất
Ví dụ:
Tính háo nước
Thí nghiệm 2. Tính háo nước và tính oxi hóa của dung dịch sulfuric acid đặc
- Hiện tượng: Đường kính hoặc bột gạo hay bột mì dần dần hóa than, có hiện tượng sủi bọt đẩy C trào ra ngoài cốc
- Giải thích: Các hợp chất dạng Cn(H2O)m bị than hóa do phản ứng tạo ra carbon. Một phần carbon sẽ tiếp tục bị oxi hóa bởi acid tạo thành khí, đẩy C trào ra ngoài
- Phương trình hóa học:
Cn(H2O)m(s) nC(s) + mH2O(l)
C(s) + 2H2SO4(aq) CO2(g) + 2SO2(g) + 2H2O(l)
Họat động 3: Bảo quản và xử lí bỏng sulfuric acid
HS thảo luận trả lời câu hỏi:
Em hãy nêu cách bảo quản sulfuric acid.
Nêu nguyên tắc đảm bảo an toàn khi sử dụng sulfuric acid.
Khi bị bỏng sulfuric acid, cần sơ cứu như thế nào?
Sản phẩm dự kiến:
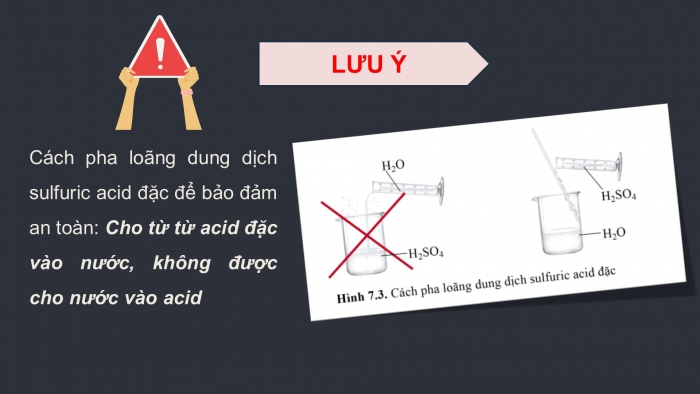
- Bảo quản ở nơi ít có nguy cơ bị va chạm, xa nguồn nhiệt và các hóa chất khác.
- Khi sử dụng với sulfuric acid, sử dụng các dụng cụ bảo hộ như áo bảo hộ, kính bảo hộ, găng tay chống thấm,...
- Sơ cứu khi bị bỏng bởi sulfuric acid:
+ Rửa sạch vết bỏng dưới vòi nước sạch trong ít nhất 20 phút
+ Tuyệt đối không chườm đá lạnh, không xoa vết bỏng bằng các loại kem, gel, dầu,...
Hoạt động 4: Ứng dụng và sản xuất sulfuric acid
HS thảo luận trả lời câu hỏi:
Em hãy trình bày về ứng dụng của sulfuric acid.
Viết các phương trình thể hiện các giai đoạn trong quá trình sản xuất sulfuric acid theo phương pháp tiếp xúc
‘Nhờ có chất xúc tác nên phản ứng giữa SO2 và O2 ưu tiên diễn ra theo chiều thuận’’. Phát biểu trên là đúng hay sai? Giải thích.
Sản phẩm dự kiến:
- Ứng dụng:
+ Sản xuất phân bón như ammonium, sulfate, calcium dihydrogenphosphate (Ca(H2PO4)2),...
+ Sản xuất chất tẩy rửa, sơn, phẩm màu, thuốc trừ sâu, giấy, chế hóa dầu mỏ,...
- Sản xuất sulfuric acid bằng phương pháp tiếp xúc:

- Phát biểu trên là sai. Do chất xúc tác làm tăng tốc độ phản ứng thuận và tốc độ phản ứng nghịch với số lần bằng nhau, do đó chất xúc tác không làm cân bằng
II. MUỐI SULFATE
Hoạt động 1: Một số muối sulfate
HS thảo luận trả lời câu hỏi:
Thế nào là muối sulfate?
Em hãy liệt kê một số muối sulfate phổ biến và các ứng dụng của chúng trong cuộc sống.
Sản phẩm dự kiến:
- Muối sulfate là hợp chất có chứa ion sulfate ( )
)
- Một số muối sulfate phổ biến cùng các ứng dụng của chúng trong cuộc sống:
+ Ammonium sulfate ((NH4)2SO4): dùng làm phân bón cung cấp đạm cho đất
+ Magnesium sulfate (MgSO4): làm phân bón; thuốc cung cấp magnesium cho cơ thể; chất hút ẩm, chất hút mồ hôi tay của vận động viên thể dục dụng cụ,...
+ Calcium sulfate dihydrate (CaSO4.2H2O): Thành phần chính của thạch nung cao, vật liệu xây dựng, nặn đúc tượng và khuôn đúc, bó chỉnh hình trong y học; chất phụ gia; hạn chế hiện tượng nhão của bột trong làm bánh; giữ nước bên trong các loại mứt;...
+ Barium sulfate (BaSO4): Sử dụng rộng rãi trong các lĩnh vực như sơn, mực in, lớp phủ, men, sản xuất các loại giấy trắng chất lượng cao; thành phần chính của thuốc cản quang trong chụp X-quang
Hoạt động 2: Nhận biết ion  trong dung dịch
trong dung dịch
HS thảo luận trả lời câu hỏi:
Làm thế nào để nhận biết ion  trong dung dịch?
trong dung dịch?
Sản phẩm dự kiến:
Để nhận biết sự có mặt của ion sulfate ( ) trong dung dịch, người ta thường sử dụng dung dịch muối của Ba2+, làm xuất hiện kết tủa màu trắng của barium sulfate:
) trong dung dịch, người ta thường sử dụng dung dịch muối của Ba2+, làm xuất hiện kết tủa màu trắng của barium sulfate:
Ba2+(aq) +  (aq)
(aq) BaSO4(s)
HOẠT ĐỘNG LUYỆN TẬP
Câu 1: Cho các chất: KBr, S, SiO2, P, Na3PO4, FeO, Cu và Fe2O3. Trong các chất đã cho, số chất có thể bị oxi hóa bởi dung dịch axit H2SO4 đặc, nóng là
A. 4
B. 5
C. 6
D. 7
Câu 2: Dung dịch axit sunfuaric để trong không khí sẽ:
A. Có vẩn đục màu vàng
B. Chuyển sang đen
C. Có bọt khí thoát ra
D. Không có hiện tượng gì
Câu 3: Hòa tan hết 0,2 mol FeO bằng dung dịch H2SO4 đặc, nóng (dư), thu được khí SO2 (sản phẩm khử duy nhất). Hấp thụ hoàn toàn khí SO2 sinh ra ở trên vào dung dịch chứa 0,13 mol KOH, thu được dung dịch chứa m gam muối. Giá trị của m là
A. 15,80
B. 14,66
C. 15,60
D. 13,14
Sản phẩm dự kiến:
Câu 1: B
Câu 2: A
Câu 3: D
HOẠT ĐỘNG VẬN DỤNG
Vận dụng kiến thức, GV yêu cầu HS trả lời câu hỏi:
Câu 1: Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,4874 lít hydrogen (ở đkc) và dung dịch chứa m gam muối. Giá trị của m là?
Câu 2: Cho hỗn hợp A gồm Al, Zn, Mg. Đem oxi hóa hoàn toàn 28,6 gam A bằng oxygen dư thu được 44,6 gam hỗn hợp oxide B. Hòa tan hết B trong dung dịch H2SO4 thu được dung dịch D. Cô cạn dung dịch D được hỗn hợp muối khan có khối lượng là bao nhiêu?
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 11 cánh diều
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 KẾT NỐI TRI THỨC
Giáo án hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 11 kết nối tri thức
Giáo án chuyên đề Hóa học 11 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 kết nối tri thức
Trò chơi khởi động Hoá học 11 kết nối tri thức
Video AI khởi động Hoá học 11 kết nối tri thức hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 kết nối tri thức
Đề thi hóa học 11 kết nối tri thức
File word đáp án hóa học 11 kết nối tri thức
Bài tập file word Hóa học 11 kết nối tri thức
Kiến thức trọng tâm hóa học 11 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 11 kết nối tri thức
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 kết nối tri thức
Phiếu học tập theo bài Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 11 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CHÂN TRỜI SÁNG TẠO
Giáo án hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 11 chân trời sáng tạo
Giáo án chuyên đề Hóa học 11 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 11 chân trời sáng tạo
Trò chơi khởi động Hoá học 11 chân trời sáng tạo
Video AI khởi động Hoá học 11 chân trời sáng tạo hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 chân trời sáng tạo
Đề thi hóa học 11 chân trời sáng tạo
File word đáp án hóa học 11 chân trời sáng tạo
Bài tập file word hóa học 11 chân trời sáng tạo
Kiến thức trọng tâm hóa học 11 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 11 chân trời sáng tạo
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 11 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 11 CÁNH DIỀU
Giáo án hoá học 11 cánh diều đủ cả năm
Giáo án điện tử hoá học 11 cánh diều
Giáo án chuyên đề Hóa học 11 cánh diều đủ cả năm
Giáo án điện tử chuyên đề hoá học 11 cánh diều
Trò chơi khởi động Hoá học 11 cánh diều
Video AI khởi động Hoá học 11 cánh diều hấp dẫn
Câu hỏi và bài tập trắc nghiệm hóa học 11 cánh diều
Đề thi hóa học 11 cánh diều
Bài tập file word Hóa học 11 cánh diều
File word đáp án hóa học 11 cánh diều
Kiến thức trọng tâm hóa học 11 cánh diều
Đề kiểm tra 15 phút Hoá học 11 cánh diều
Đề thi, đề kiểm tra cuối kì 2 hóa học 11 cánh diều
Phiếu học tập theo bài Hoá học 11 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 11 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 11 cánh diều cả năm
