Giáo án và PPT Hoá học 10 kết nối Bài 12: Liên kết cộng hoá trị
Đồng bộ giáo án word và powerpoint (ppt) Bài 12: Liên kết cộng hoá trị. Thuộc chương trình Hoá học 10 kết nối tri thức. Giáo án được biên soạn chỉn chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét












Giáo án ppt đồng bộ với word










Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 10 kết nối tri thức
BÀI 12. Liên kết cộng hóa trị
A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
- GV đưa ra câu hỏi: Nguyên tử hydrogen và chlorine dễ dàng kết hợp để tạo thành phân tử hydrogen chloride (HCl), liên kết trong trường hợp này có gì khác so với liên kết ion trong phân tử sodium chloride (NaCl)?
B.HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Sự tạo thành liên kết cộng hóa trị
- Trình bày liên kết cộng hóa trị
- Liên kết cộng hóa trị có mấy loại?
- Mô tả sự liên kết trong phân tử HCL.
- Sự liên kết trong phân tử O2
- Nêu khái niệm về liên kết cộng hóa trị.
- Có mấy loại liên kết cộng hóa trị? Là những loại nào? Phân biệt những loại đó?
Sản phẩm dự kiến:
- Các nguyên tử phi kim hóa trị gần bão hòa có xu hướng nhận thêm electron. Khi 2 nguyên tử phi kim liên kết với nhau, chúng sẽ góp electron để dung chung. Các cặp electron dùng chung tạo ra liên kết cộng hóa trị giữa hai nguyên tử.
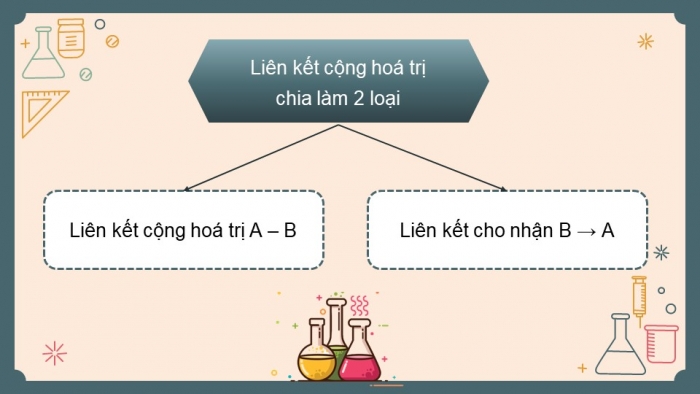
- Liên kết cộng hóa trị chia ra làm 2 loại:
+ Liên kết cộng hóa trị A - B
+ Liên hết cho nhận A→B
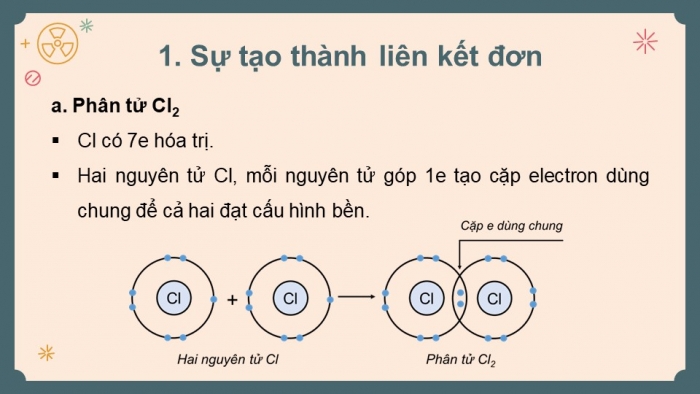
- Cl có 7 electron hóa trị; H có 1 electron hóa trị; H góp 1 electron, Cl góp 1 electron => tạo cặp electron dùng chung để cả 2 đạt cấu hình bền.
- Phân tử O2 : nguyên tử O có 6 electron hóa trị, hai nguyên tử O liên kết với nhau bằng cách mỗi nguyên tử góp 2 electron, tạo thành 2 cặp electron dùng chung
- Khái niệm: Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
- Có 2 loại liên kết cộng hóa trị là liên kết cộng hóa trị phân cực và không phân cực.
+ Các cặp electron dùng chung không bị hút lệch về phía nguyên tử nào được gọi là liên kết cộng hóa trị không phân cực (vd: Cl2, O2, N2,…).
+ Các cặp electron dùng chung bị hút lệch về phía nguyên tử có độ âm điện lớn hơn được gọi là liên kết cộng hóa trị phân cực.(vd: HCl, HBr,…).
Hoạt động 2: Độ âm điện và liên kết hóa học
- Hãy cho biết các liên kết: H-C, H-Br, H-Cl, H-F là thuộc loại liên kết gì?
Sản phẩm dự kiến:
- Liên kết H-C là liên kết cộng hóa trị không phân cực.
Liên kết H-Br là liên kết cộng hóa trị phân cực.
Liên kết H-Cl là liên kết cộng hóa trị phân cực.
Liên kết H-F là liên kết ion.
Hoạt động 3: Mô tả liên kết cộng hóa trị bằng sự xen phủ các orbital
- GV đặt câu hỏi cho HS trả lời:
+ Liên kết σ có bền không? Vì sao?
+ Liên kết cộng hóa trị đơn có phải là liên kết σ không?
Sản phẩm dự kiến:
- Liên kết σ khá bền. Nguyên nhân là do các orbital xen phủ trục liên kết dẫn đến vùng xen phủ cực đại, mà cùng xen phủ càng lớn thì liên kết càng bền.
- Liên kết cộng hóa trị đơn đều là là liên kết σ.
Hoạt động 3: Tinh thể ion
- Trình bày sự sắp xếp của ion?
- Nêu một số tính chất của hợ chất ion?
- So sánh độ bêng của liên kết π và σ. Nêu nguyên nhân?
Sản phẩm dự kiến:
- Các ion được sắp xếp theo một trật tự nhất định trong không gian theo kiểu mạng lưới, trong đó ở các nút của mạng lưới là những ion dương và ion âm được sắp xếp luân phiên, liên kết chặt chẽ với nhau do sự cân bằng giữa lực hút và lực đẩy.
- Hợp chất ion thường là chất rắn nhưng khá giòn, khó nóng chảy, khó bay hơi ở điều kiện thường.
- Hợp chất ion có thể dẫn điện ở trạng thái nóng chảy hoặc tan trong nước.
- Liên kết π kém bền hơn liên kết σ do vùng xen phủ orbital nhỏ hơn.
C. HOẠT ĐỘNG LUYỆN TẬP
GV yêu cầu HS thực hiện bài tập trắc nghiệm.
Câu 1: Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng
- Một electron chung
- Sự cho – nhận electron
- Một cặp electron góp chung
- Một hay nhiều cặp electron góp chung
Câu 2: Hợp chất nào sau đây có liên kết cộng hóa trị không phân cực?
- LiCl
- CF2Cl2
- CHCl3
- N2
Câu 3: Liên kết nào sau đây được hình thành nhờ sự xen phủ orbital s – p?
- H2
- NH3
- Cl2
- O2
Câu 4: Các liên kết trong phân tử oxygen gồm
- 2 liên kết π
- 2 liên kết σ
- 1 liên kết σ và 1 liên kết π
- 1 liên kết σ và 2 liên kết π
Câu 5: Cho hai nguyên tố X (Z=20) và Y (Z=17). Công thức hợp chất tạo thành từ nguyên tố X, Y và liên kết trong phân tử là:
- XY2 : liên kết ion
- X2Y3 : Liên kết cộng hóa trị
- X2Y : liên kết ion
- YX : Liên kết cộng hóa trị
Gợi ý đáp án:
1 | 2 | 3 | 4 | 5 |
D | D | B | C | A |
D. HOẠT ĐỘNG VẬN DỤNG
GV yêu cầu HS hoạt động hoàn thành bài tập trong sgk.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 10 kết nối tri thức
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 KẾT NỐI TRI THỨC
Giáo án Hoá học 10 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 10 kết nối tri thức
Giáo án chuyên đề Hóa học 10 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 kết nối tri thức
Trò chơi khởi động Hoá học 10 kết nối tri thức
Video AI khởi động Hoá học 10 kết nối tri thức hấp dẫn
Trắc nghiệm Hóa học 10 kết nối tri thức
Đề thi hóa học 10 kết nối tri thức
File word đáp án hóa học 10 kết nối tri thức
Bài tập file word Hóa học 10 kết nối tri thức
Kiến thức trọng tâm hóa học 10 kết nối tri thức
Câu hỏi tự luận Hóa học 10 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 10 kết nối tri thức
Phiếu học tập theo bài Hoá học 10 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 10 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 CHÂN TRỜI SÁNG TẠO
Soạn giáo án Hoá học 10 chân trời sáng tạo theo công văn mới nhất
Giáo án điện tử hoá học 10 chân trời sáng tạo
Giáo án chuyên đề Hóa học 10 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 chân trời sáng tạo
Trò chơi khởi động Hoá học 10 chân trời sáng tạo
Video AI khởi động Hoá học 10 chân trời sáng tạo hấp dẫn
Trắc nghiệm hoá học 10 chân trời sáng tạo
Đề thi hóa học 10 chân trời sáng tạo
File word đáp án hóa học 10 chân trời sáng tạo
Bài tập file word Hóa học 10 chân trời sáng tạo
Kiến thức trọng tâm hóa học 10 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 10 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 10 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 10 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 CÁNH DIỀU
Soạn giáo án Hoá học 10 cánh diều theo công văn mới nhất
Giáo án điện tử hoá học 10 cánh diều
Giáo án chuyên đề Hóa học 10 cánh diều đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 cánh diều
Trò chơi khởi động Hoá học 10 cánh diều
Video AI khởi động Hoá học 10 cánh diều hấp dẫn
Trắc nghiệm hoá học 10 cánh diều
Đề thi hóa học 10 cánh diều
File word đáp án hóa học 10 cánh diều
Bài tập file word Hóa học 10 cánh diều
Kiến thức trọng tâm hóa học 10 cánh diều
Đề kiểm tra 15 phút Hoá học 10 cánh diều
Phiếu học tập theo bài Hoá học 10 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 10 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 cánh diều cả năm
