Giáo án và PPT Hoá học 10 kết nối Bài 21: Nhóm halogen
Đồng bộ giáo án word và powerpoint (ppt) Bài 21: Nhóm halogen. Thuộc chương trình Hoá học 10 kết nối tri thức. Giáo án được biên soạn chỉn chu, hấp dẫn. Nhằm tạo sự lôi cuốn và hứng thú học tập cho học sinh.
Click vào ảnh dưới đây để xem giáo án WORD rõ nét










Giáo án ppt đồng bộ với word










Còn nữa....
Các tài liệu bổ trợ khác
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 10 kết nối tri thức
BÀI 21: NHÓM HALOGEN
A. HOẠT ĐỘNG KHỞI ĐỘNG (MỞ ĐẦU)
Trò chơi “AI NHANH HƠN” .
GV đưa ra lần lượt các câu hỏi và chỉ định HS trả lời
Câu 1: Nguyên tố trong tiếng Hy Lạp có nghĩa là hôi thối là nguyên tố nào?
Câu 2: Kí hiệu hóa học của nguyên tố Fluorine là gì?
Câu 3: Nguyên tố halogen nào có ở tuyến giáp (ở dạng hợp chất hữu cơ)?
Câu 4: Trong cơ thể người, nguyên tố halogen nào có trong máu và dịch vị dạ dày (ở dạng ion Cl-)?
Câu 5: Nhóm VIIA trong Bảng tuần hoàn có hai nguyên tố là nguyên tố phóng xạ. Em cho biết tên và kí hiệu hóa học của chúng?
B. HÌNH THÀNH KIẾN THỨC MỚI
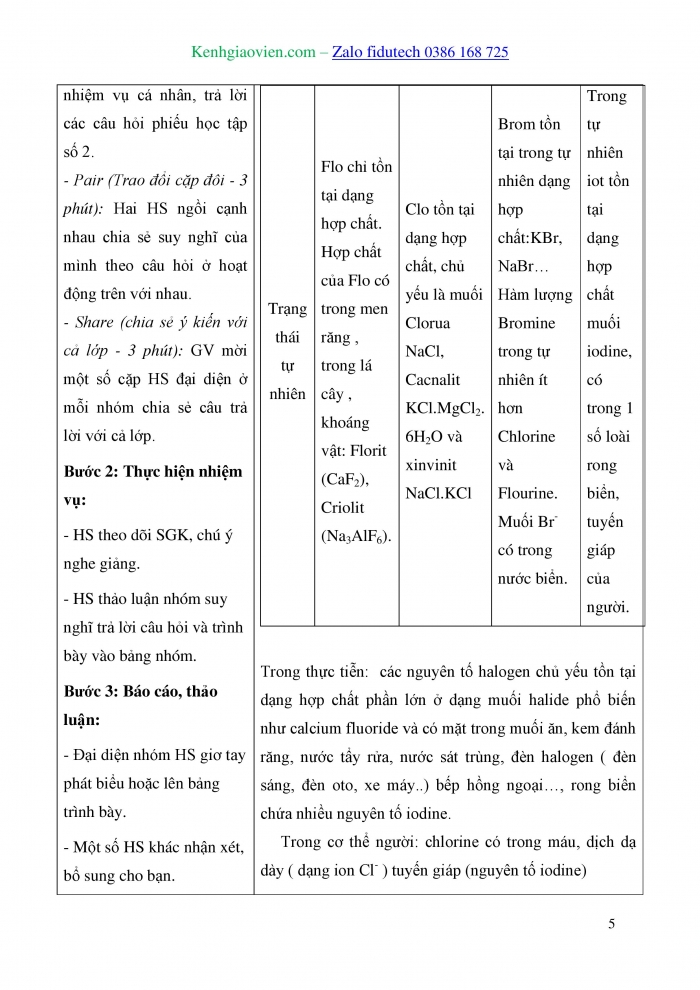
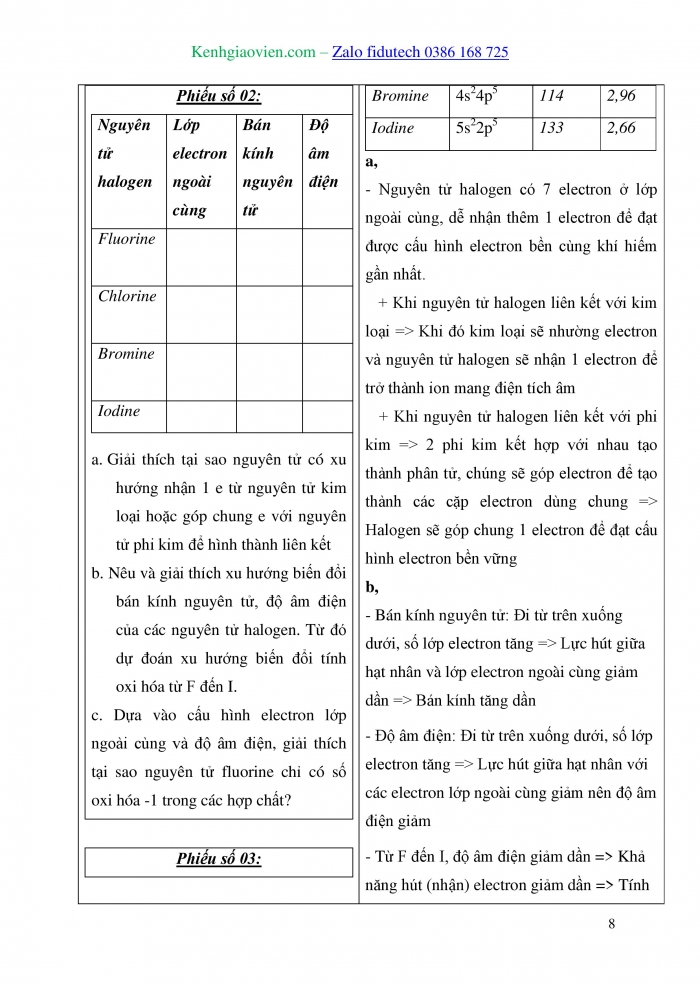
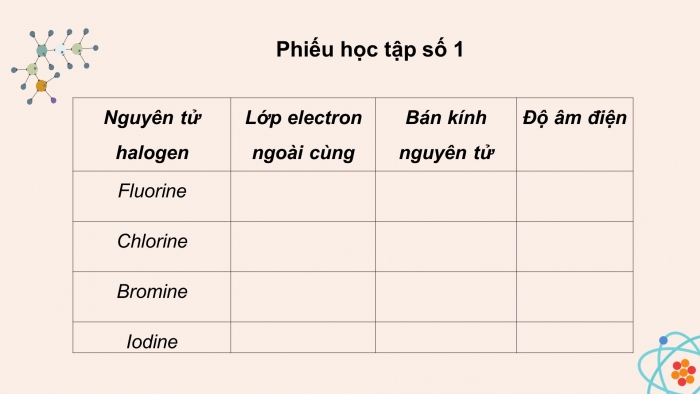
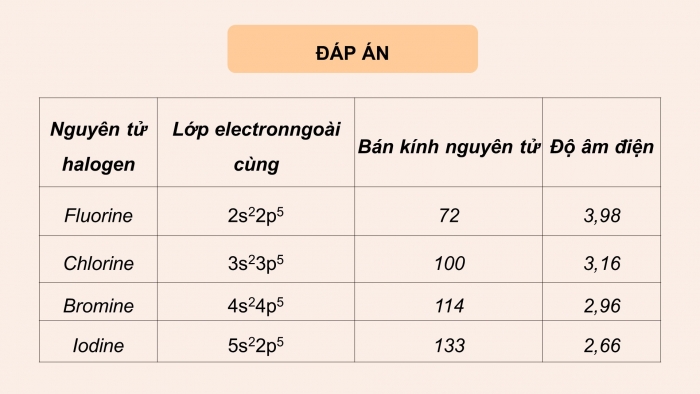
Hoạt động 1: Tìm hiểu cấu tạo nguyên tử , phân tử
- Nguyên tử halogen có mấy electron ngoài cùng? Chúng có đặc điểm gì?
- Nêu đặc điểm khi nguyên tử halogen liên kết với kim loại và với phi kim?
- Bán kính nguyên tử có đặc điểm gì?
- Đi từ trên xuống dưới, độ âm điện của nguyên tử có xu hướng như thế nào?
- Trong phân tử halogen, liên kết hình thành giữa 2 nguyên tử giống nhau hay khác nhau?
Sản phẩm dự kiến:
- Nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền cùng khí hiếm gần nhất.
- Khi nguyên tử halogen liên kết với kim loại => Khi đó kim loại sẽ nhường electron và nguyên tử halogen sẽ nhận 1 electron để trở thành ion mang điện tích âm
- Khi nguyên tử halogen liên kết với phi kim => 2 phi kim kết hợp với nhau tạo thành phân tử, chúng sẽ góp electron để tạo thành các cặp electron dùng chung => Halogen sẽ góp chung 1 electron để đạt cấu hình electron bền vững
- Bán kính nguyên tử: Đi từ trên xuống dưới, số lớp electron tăng => Lực hút giữa hạt nhân và lớp electron ngoài cùng giảm dần => Bán kính tăng dần
- Đi từ trên xuống dưới, số lớp electron tăng => Lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm nên độ âm điện giảm
- Trong phân tử halogen, liên kết hình thành giữa 2 nguyên tử giống nhau.
Hoạt động 2: Tìm hiểu tính chất vật lí của các halogen
- Trình bày sự biến đổi tính chất vật lý của các halogen?
Sản phẩm dự kiến:
- Sự biến đổi tính chất vật lý của các halogen:
+ Trạng thái: từ khí → lỏng→ rắn
+ Màu sắc: đậm dần
+ Nhiệt độ nóng chảy: tăng dần
+ Nhiệt độ sôi: tăng dần
+ Bán kính nguyên tử: tăng dần.
+ Độ âm điện: Giảm dần.
+ Khả năng tan: tan ít trong nước nhưng tan nhiều trong dung môi hữu cơ.
+ Bromine gây bỏng sâu khi tiếp xúc với da. Hít thở halogen với nồng độ vượt ngưỡng cho phép sẽ làm tổn thương niêm mạc tế bào hô hấp, phế quản.
Hoạt động 3: Tìm hiểu tính chất hóa học
- Nêu tính chất hóa học của nhóm halogen?
- Năng lượng liên kết H-X có xu hướng như thế nào?
Sản phẩm dự kiến:
- Xu hướng phản ứng của các đơn chất halogen với hydrogen giảm dần từ F2 đến I2 (giải thích dựa vào hiệu giữa năng lượng liên kết của các chất tham gia và tạo thành sau phản ứng).
- Năng lượng liên kết H-X giảm dần từ F đến I nên xu hướng phản ứng giảm dần tử F2 đến I2.
Hoạt động 4: Tìm hiểu điều chế chlorine
- Trình bày được phương pháp điều chế chlorine?
Sản phẩm dự kiến:
- Trong phòng thí nghiệm:
MnO2 + 4HCl ![]() MnCl2 + Cl2
MnCl2 + Cl2![]() + 2H2O
+ 2H2O
2KMnO4 + 16HCl ![]() 2MnCl2 + 2KCl + 5Cl2
2MnCl2 + 2KCl + 5Cl2![]() + 8H2O
+ 8H2O
- Trong công nghiệp:
2NaCl +2H2O ![]() 2NaOH + H2
2NaOH + H2![]() + Cl2
+ Cl2![]()
C. HOẠT ĐỘNG LUYỆN TẬP
GV yêu cầu HS thực hiện bài tập trắc nghiệm.
Câu 1: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là
A. ns2np4. B. ns2np3. C. ns2np5. D. ns2np6.
Câu 2: Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen?
A. Ở điều kịên thường là chất khí. B. Tác dụng mạnh với nước.
C. Vừa có tính oxi hoá, vừa có tính khử. D. Có tính oxi hoá mạnh.
Câu 3: Phản ứng giữa H2 và Cl2 có thể xảy ra trong điều kiện
A. Nhiệt độ thường và bóng tối. B. Ánh sáng khuếch tán.
C. Nhiệt độ tuyệt đối 273K. D. Xúc tác MnO2, nhiệt độ.
Câu 4: Sục khí clo vào lượng dung dịch NaOH ở nhiệt độ thường thu được nước Javen dùng làm chất tẩy rửa khử trùng, nước Javen có chứa các chất tan là:
A. NaCl, NaClO, NaOH. B. NaCl, NaClO.
C. NaCl, NaClO3, NaOH. D. Chỉ có NaClO.
Câu 5: Trong phòng thí nghiệm, clo được điều chế bằng cách cho HCl đặc phản ứng với
A. NaCl. B. Fe. C. F2. D. KMnO4.
Gợi ý đáp án:
1 | 2 | 3 | 4 | 5 |
C | D | B | A | D |
D. HOẠT ĐỘNG VẬN DỤNG
GV yêu cầu HS hoạt động hoàn thành bài tập trong sgk.
Trên chỉ là 1 phần của giáo án. Giáo án khi tải về có đầy đủ nội dung của bài. Đủ nội dung của học kì I + học kì II
Đủ kho tài liệu môn học
=> Tài liệu sẽ được gửi ngay và luôn
Cách tải:
- Bước 1: Chuyển phí vào STK: 1214136868686 - cty Fidutech - MB
- Bước 2: Nhắn tin tới Zalo Fidutech - nhấn vào đây để thông báo và nhận tài liệu
Xem toàn bộ: Trọn bộ giáo án và PPT Hoá học 10 kết nối tri thức
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 KẾT NỐI TRI THỨC
Giáo án Hoá học 10 kết nối tri thức đủ cả năm
Giáo án điện tử hoá học 10 kết nối tri thức
Giáo án chuyên đề Hóa học 10 kết nối tri thức đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 kết nối tri thức
Trò chơi khởi động Hoá học 10 kết nối tri thức
Video AI khởi động Hoá học 10 kết nối tri thức hấp dẫn
Trắc nghiệm Hóa học 10 kết nối tri thức
Đề thi hóa học 10 kết nối tri thức
File word đáp án hóa học 10 kết nối tri thức
Bài tập file word Hóa học 10 kết nối tri thức
Kiến thức trọng tâm hóa học 10 kết nối tri thức
Câu hỏi tự luận Hóa học 10 kết nối tri thức
Đề kiểm tra 15 phút Hoá học 10 kết nối tri thức
Phiếu học tập theo bài Hoá học 10 kết nối tri thức cả năm
Trắc nghiệm đúng sai Hoá học 10 kết nối tri thức cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 kết nối tri thức cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 CHÂN TRỜI SÁNG TẠO
Giáo án Hoá học 10 chân trời sáng tạo đủ cả năm
Giáo án điện tử hoá học 10 chân trời sáng tạo
Giáo án chuyên đề Hóa học 10 chân trời sáng tạo đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 chân trời sáng tạo
Trò chơi khởi động Hoá học 10 chân trời sáng tạo
Video AI khởi động Hoá học 10 chân trời sáng tạo hấp dẫn
Trắc nghiệm hoá học 10 chân trời sáng tạo
Đề thi hóa học 10 chân trời sáng tạo
File word đáp án hóa học 10 chân trời sáng tạo
Bài tập file word Hóa học 10 chân trời sáng tạo
Kiến thức trọng tâm hóa học 10 chân trời sáng tạo
Đề kiểm tra 15 phút Hoá học 10 chân trời sáng tạo
Phiếu học tập theo bài Hoá học 10 chân trời sáng tạo cả năm
Trắc nghiệm đúng sai Hoá học 10 chân trời sáng tạo cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 chân trời sáng tạo cả năm
TÀI LIỆU GIẢNG DẠY HOÁ HỌC 10 CÁNH DIỀU
Giáo án Hoá học 10 cánh diều đủ cả năm
Giáo án điện tử hoá học 10 cánh diều
Giáo án chuyên đề Hóa học 10 cánh diều đủ cả năm
Giáo án điện tử chuyên đề Hoá học 10 cánh diều
Trò chơi khởi động Hoá học 10 cánh diều
Video AI khởi động Hoá học 10 cánh diều hấp dẫn
Trắc nghiệm hoá học 10 cánh diều
Đề thi hóa học 10 cánh diều
File word đáp án hóa học 10 cánh diều
Bài tập file word Hóa học 10 cánh diều
Kiến thức trọng tâm hóa học 10 cánh diều
Đề kiểm tra 15 phút Hoá học 10 cánh diều
Phiếu học tập theo bài Hoá học 10 cánh diều cả năm
Trắc nghiệm đúng sai Hoá học 10 cánh diều cả năm
Trắc nghiệm dạng câu trả lời ngắn Hoá học 10 cánh diều cả năm
